feto
Il prodotto del concepimento dei Mammiferi dalla comparsa dei caratteri propri della specie al momento del parto. Nella specie umana tali caratteri compaiono al 3° mese di gestazione, quando termina la fase embrionale dello sviluppo intrauterino e inizia il periodo fetale, nel quale gli abbozzi di tutti gli organi e apparati formatisi nel periodo embrionale si accrescono e maturano. Il f. può essere studiato direttamente nell’utero, senza che le condizioni di omeostasi vengano alterate; è però un organismo vulnerabile, la cui vitalità può essere compromessa dalle alterazioni delle condizioni di omeostasi materne e dalle sostanze farmacologiche somministrate alla madre.
La fetoscopia consente di individuare lesioni del f., della placenta o del cordone ombelicale. Per la visualizzazione diretta del f. e degli annessi fetali si utilizzano fibre ottiche che, tramite agocannula, sono introdotte nel sacco amniotico attraverso la parete addominale ( fetoscopia addominale), o attraverso il fornice vaginale anteriore ( fetoscopia transvaginale). A tale indagine endoscopica, non priva di rischi, si preferiscono l’amniocentesi precoce, l’amniografia, l’indagine ecografica (➔ ostetricia).
Delle funzioni del f. si occupa anche la psicologia, rintracciando in esse i presupposti dello sviluppo della mente.
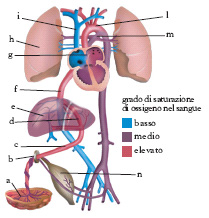
Circolazione fetale
Le sostanze necessarie al mantenimento e all’accrescimento arrivano al f. attraverso la placenta e dalla vena ombelicale, che decorre nel cordone ombelicale e porta al f. il sangue ossigenato e ricco di sostanze nutritizie (v. .). La vena ombelicale entra attraverso l’anello ombelicale e sale lungo la parete addominale anteriore fino a livello del fegato fetale; quindi si divide: alcuni rami forniscono sangue alle vene epatiche, che irrorano principalmente il lobo epatico sinistro; altri riforniscono la circolazione intraepatica; il ramo principale è rappresentato dal dotto venoso, che cortocircuita il fegato per gettarsi direttamente nella vena cava inferiore. In alcuni animali, come il cavallo e il maiale, il dotto venoso perde la funzionalità nell’ultima parte della gravidanza; pertanto esso svolgerebbe un ruolo di scarsa importanza. Il sangue della vena cava inferiore raggiunge l’atrio destro del cuore fetale; è costituito da una miscela di sangue ossigenato, proveniente dal dotto venoso, e di sangue meno ossigenato che è raccolto da alcune vene sovraepatiche a livello sottodiaframmatico. Ne consegue che la quantità di ossigeno presente nel sangue portato all’atrio destro del cuore fetale dalla vena cava inferiore è minore rispetto a quella presente nel sangue al momento in cui lascia la placenta, ma è maggiore di quella presente nella vena cava superiore.
Nell’atrio destro è presente il forame ovale, un condotto che rappresenta una continuazione della vena cava inferiore e attraverso il quale la maggior parte del sangue della vena cava inferiore stessa è direttamente deviato, dalla crista dividens, nell’atrio sinistro. In condizioni normali, nell’atrio destro passa anche una minima quantità di sangue meno ossigenato proveniente dalla vena cava superiore. Il flusso preferenziale, dunque, passa dalla vena cava inferiore, attraverso il forame ovale, nell’atrio sinistro, cortocircuitando il ventricolo destro e la circolazione polmonare; al ventricolo sinistro giunge così una miscela di sangue dal contenuto in ossigeno superiore a quello che si determinerebbe se il sangue si fosse completamente mescolato nell’atrio destro. Il sangue con maggiore tasso di ossigeno che attraversa il forame ovale è spinto dal ventricolo sinistro per perfondere due organi vitali: il cervello e il cuore. Il sangue proveniente dalla cava superiore, le cui caratteristiche sono tipiche del sangue venoso è, per la maggior parte, deviato, con un meccanismo di shunt, attraverso il dotto arterioso nella porzione discendente dell’aorta. Solo un terzo circa del sangue circola dal dotto arterioso nei polmoni.
Le funzioni del dotto arterioso sono quelle di convogliare il flusso sanguigno verso la placenta, evitando in questo modo le alte resistenze del letto vascolare polmonare e, quindi, riducendo l’entità del lavoro cardiaco, e di stabilire un equilibrio pressorio tra arteria polmonare e aorta. Le modificazioni emodinamiche determinate dalla presenza del forame ovale e del dotto arterioso fanno sì che i due ventricoli funzionino in parallelo. Circa il 40% della portata cardiaca si distribuisce alla placenta, il 7% ai polmoni.
Cuore fetale. - A causa delle estese comunicazioni tra cuore destro e cuore sinistro, contrariamente a quanto accade in quello dell’adulto, il cuore fetale ha una limitata capacità di incrementare la portata cardiaca con un aumento del volume di eiezione ventricolare; l’incremento della portata cardiaca si realizza principalmente attraverso un aumento della frequenza: una bradicardia, comunque indotta, determina una riduzione della portata cardiaca. Nel corso della gravidanza aumenta la percentuale della gettata cardiaca fetale destinata al cervello, ai polmoni e al tratto gastrointestinale e diminuisce la quota percentuale destinata alla placenta. Si ha inoltre un progressivo aumento della pressione arteriosa sistemica fino al termine di gestazione; contemporaneamente si instaura una diminuzione della frequenza cardiaca da una media di 170 battiti al minuto nel primo trimestre di gravidanza a 140 battiti al minuto al termine. L’alta gettata cardiaca fetale potrebbe servire a compensare il basso contenuto di ossigeno del sangue fetale. Dopo la nascita, i vasi ombelicali, il dotto arterioso, il forame ovale e il dotto venoso normalmente si chiudono oppure collabiscono.
Sistema cardiovascolare. -Il sistema cardiovascolare del f. è sottoposto al controllo diretto del sistema nervoso autonomo per mezzo di chemocettori e barocettori. L’ipossiemia e l’ipercapnia di grado moderato provocano aumento della pressione arteriosa e vasocostrizione nei polmoni e nei tessuti periferici. Le risposte cardiocircolatorie del f. all’asfissia sono caratterizzate dalla ridistribuzione della circolazione sistemica agli organi vitali e costituiscono un meccanismo di difesa che tende a conservare l’apporto di ossigeno a questi organi, mettendoli in grado di tollerare gli effetti di un accumulo di metaboliti acidi, quali anidride carbonica, idrogenioni e acido lattico. Il f. umano reagisce in modo analogo ad altri Mammiferi quando si immergono temporaneamente sott’acqua. È stato suggerito che il dotto arterioso e la circolazione polmonare svolgano un ruolo importante, durante gli episodi di asfissia fetale, nella ridistribuzione del sangue agli organi vitali, grazie all’azione del sistema nervoso autonomo e dei chemocettori aortici e carotidei. Questo meccanismo di difesa ha comunque un’efficacia limitata poiché, rimanendo pressoché costante la portata cardiaca, l’aumento del volume di sangue ridistribuito agli organi vitali tende a deviare il flusso ematico ombelicoplacentare, compromettendo così l’ossigenazione del feto. Il f. possiede dunque la capacità di modificare il flusso ematico ai vari organi, ridistribuendolo in risposta a sollecitazioni diverse. Questo controllo sembra esercitarsi sia per via nervosa sia mediante la liberazione di ormoni e si esplica tempestivamente in risposta alle modificazioni circolatorie che si realizzano alla nascita.
Sistema nervoso e muscolare
L’attività riflessa spinale e le risposte alla stimolazione corticale dipendono, oltre che dalla maturazione dei centri cerebrali, dall’adeguato sviluppo dei nervi periferici e dei muscoli. Nell’uomo la mielinizzazione delle fibre si realizza con ritmo lento dalla 12a settimana di gestazione; in altre specie animali avviene più rapidamente. Il normale sviluppo dei muscoli scheletrici dipende dalla loro innervazione. I neuroni motori sono differenziati prima dei muscoli che li innervano, per cui è l’organizzazione centrale dei neuroni a determinare la differenza fra i muscoli scheletrici rapidi e lenti. Questo processo influenza lo sviluppo dei riflessi da stiramento (per es. nel polmone), della rigidità da decerebrazione dei movimenti coordinati e dei movimenti fini; solo all’età di 3 settimane si realizza un quadro simile all’innervazione dell’adulto. La comparsa di differenti meccanismi riflessi si correla con la maturazione dei nervi periferici, in particolare con il progredire della loro mielinizzazione e delle loro connessioni centrali. La presenza nei muscoli intercostali di una notevole quantità di fusi neuromuscolari dimostra l’importanza di queste strutture nella regolazione del respiro.
All’8a settimana di gestazione, l’attività sinaptica è sufficientemente sviluppata da permettere la flessione del collo e del tronco. Alla 10a, stimoli localizzati possono provocare movimenti dei bulbi oculari, apertura delle labbra, parziale chiusura delle dita della mano e flessione delle dita dei piedi. La capacità di chiudere completamente il pugno è acquisita al 4° mese, quando si evidenziano anche i movimenti di deglutizione e di respirazione; ma il riflesso della suzione non è presente prima del 6° mese.
Nel 3° trimestre l’integrazione tra funzione nervosa e muscolare procede rapidamente, cosicché la maggior parte dei feti nati dopo la 32a settimana di gestazione sarebbe in grado di sopravvivere, in quanto capace di respirare. Dal 7° mese l’occhio è sensibile alla luce, ma la capacità di percepire le forme e i colori non è completa fino a circa un anno dopo la nascita. L’orecchio interno, medio ed esterno appaiono sviluppati a metà gravidanza. Probabilmente, il f. ode alcuni suoni già a partire dalla 24a settimana. Al 3° mese lunare sono istologicamente evidenziabili le papille gustative; dal 7° il f. è sensibile a variazioni di gusto delle sostanze ingerite.
Corteccia cerebrale. - Nella prima parte della gravidanza è particolarmente evidente l’accrescimento del cervello, più veloce di quello corporeo. Il cervello fetale a 10, 12 e 14 settimane pesa rispettivamente lo 0,75, il 4,8 e il 6,9% del peso a termine, mentre il resto del corpo pesa lo 0,14, l’1,99 e il 3%. Nella seconda metà della gravidanza, in particolare nelle ultime 10 settimane, il cervello e il corpo raddoppiano di peso. Questi gradienti ponderali non riflettono uniformemente la maturità dei costituenti cerebrali e corporei. In molte specie animali il periodo critico per lo sviluppo del cervello si colloca in fasi avanzate della gravidanza. Nell’uomo, studi istologici sulla corteccia sembrano suggerire che il periodo corrispondente si colloca più precocemente (tra la 12ª e la 16ª settimana di gravidanza); nonostante il precoce sviluppo corticale, la funzione cerebrale si presenta alla nascita notevolmente immatura rispetto a quella di altre specie animali. Alcuni riflessi motori sembrano dipendere solo dall’età gestazionale, mentre lo sviluppo di altri si realizza con l’apprendimento, dopo la nascita.
In genere, meno differenziato è il tessuto nervoso, minore quantità di ossigeno viene consumata e, conseguentemente, il cervello è meno vulnerabile all’ipossia. Nelle ultime 10 settimane, il notevole accrescimento del cervello, la differenziazione citoarchitettonica e lo sviluppo concorrente delle funzioni aumentano le richieste di ossigeno e, quindi, la vulnerabilità all’ipossia. Le conseguenze dell’ipossia in questo stadio non possono essere determinate con sicurezza; tuttavia, possono essere responsabili di deficit cognitivi in feti con ritardi di accrescimento.
Rene
La funzione escretrice del rene fetale inizia nell’uomo intorno alla 18a settimana e, verso il termine della gestazione, è prodotta una quantità tale di urina da modificare in modo significativo la composizione del liquido amniotico. Alla fine del 1° trimestre, i nefroni hanno una certa capacità di escrezione grazie alla filtrazione glomerulare, ma dal punto di vista funzionale sono immaturi per tutta la vita fetale. Nel f. umano, la frazione della gettata cardiaca che perfonde i reni è bassa e le resistenze vascolari renali sono alte, se confrontate con i valori rilevati nella vita extrauterina. Normalmente si trova una certa quantità di urina anche nella vescica di f. abbastanza piccoli. I reni non sono indispensabili per la sopravvivenza nella vita intrauterina, ma hanno un ruolo nel controllo della composizione e del volume del liquido amniotico e nella secrezione di fosfolipidi tensioattivi polmonari. Alla nascita, la funzione renale del f. non ha ancora raggiunto una completa maturazione; è, tuttavia, generalmente adeguata alla sopravvivenza del neonato, a meno che non siano presenti gravi anomalie delle vie escretrici.
Apparato digerente
Alla 19a settimana di gestazione, nell’intestino tenue sono evidenziabili l’attività peristaltica e la capacità di trasporto attivo del glucosio. Al 4° mese di gravidanza, il tratto gastrointestinale è sviluppato al punto di permettere al f. di deglutire liquido amniotico, di assorbire buona parte dell’acqua in esso contenuta, di fare avanzare la parte non assorbita fino al tratto distale del colon. Nel primo periodo dello sviluppo fetale sono evidenziabili acido cloridrico e alcuni enzimi digestivi caratteristici dell’apparato digerente dell’adulto, sebbene in quantità molto basse a confronto con quelle presenti durante la vita postnatale. Nelle prime fasi della gravidanza la deglutizione del f. ha un modesto effetto sul volume del liquido amniotico, dal momento che l’entità della deglutizione stessa è bassa se paragonata al volume totale di liquido amniotico presente. Nelle fasi più avanzate della gravidanza sembra che il volume del liquido amniotico che circonda il f. sia regolato in maniera significativa dall’attività di deglutizione fetale: se quest’ultima è inibita, non è infrequente il polidramnio (➔). L’attività di deglutizione può favorire l’accrescimento e lo sviluppo del tratto digestivo e risultare essenziale per l’alimentazione dopo la nascita; tuttavia, il tratto gastrointestinale di alcuni f. anencefali, che normalmente presentano attività di deglutizione ridotta, appare normale. A gravidanza avanzata, la deglutizione serve a rimuovere i detriti insolubili che normalmente si riversano nel sacco amniotico e, in taluni casi, sono in esso escreti in maniera anomala. Probabilmente la quantità di liquido amniotico deglutita contribuisce in misura modesta alla richiesta calorica fetale, ma può fornire sostanze nutritizie essenziali. Il meconio che si forma nell’intestino del f. dal 4°-5° mese è costituito da frammenti indigeriti presenti nel liquido amniotico deglutito e da vari prodotti di secrezione, escrezione e desquamazione del tratto gastrointestinale. Il colore verde scuro è dovuto alla presenza di pigmenti, in particolare la biliverdina. In genere un’ipossia marcata determina una scarica di meconio dal crasso-sigma nel liquido amniotico.
Fegato e pancreas
La funzionalità epatica del f. differisce per alcuni aspetti da quella dell’adulto. Alcuni enzimi sono presenti nel fegato in quantità considerevolmente ridotte rispetto alla vita postnatale. Il fegato ha una scarsa capacità di trasformare la bilirubina libera in bilirubina diglucuronoside. Maggiore è il grado di immaturità del f., minore è la capacità di coniugare la bilirubina. Solo una piccola quantità di bilirubina viene coniugata ed escreta attraverso le vie biliari direttamente nell’intestino, mentre per la maggior parte è trasformata in biliverdina. La bilirubina non coniugata è rapidamente rimossa dalla placenta a opera del circolo fetale per essere coniugata dal fegato della madre ed escreta attraverso le sue vie biliari. Il glicogeno è presente in basse concentrazioni nel fegato fetale nel 2° trimestre di gravidanza; in prossimità del parto, però, il suo contenuto subisce un aumento tale da determinare tassi più elevati di due o tre volte rispetto a quelli riscontrabili nell’adulto. Dopo il parto il contenuto di glicogeno decresce in modo molto rapido. L’attività esocrina del pancreas fetale appare limitata, ma non assente. Si possono identificare nel pancreas acini contenenti insulina alla 9a settimana di gestazione; l’insulina plasmatica è presente alla 12a settimana. Il pancreas fetale risponde all’iperglicemia aumentando l’insulina plasmatica. Per quanto il ruolo preciso dell’insulina di origine fetale non sia chiaro, l’accrescimento del f. è determinato in notevole misura dalla grande quantità di sostanze nutritizie fondamentali che giungono dalla madre, grazie all’azione dell’insulina e all’attività anabolica operata dal f. stesso su queste sostanze. La quantità di insulina è alta non solo nel siero di nati da madre diabetica, ma anche in nati di dimensioni eccessive per l’età gestazionale, mentre è bassa in nati piccoli per l’età gestazionale; anche la placenta è in grado di produrre questa somatomedina (➔).
Ghiandole endocrine
L’ipofisi è in grado di sintetizzare e di immagazzinare ormoni prima della fine del primo trimestre. Nell’ipofisi di feti umani di 10 settimane di gestazione sono stati identificati GH (growth hormone, ormone della crescita), ACTH (adrenocorticotropic hormone, ormone adrenocorticotropo), prolattina, LH (luteinizing hormone, ormone luteinizzante) e FSH (follicle stimulating hormone, ormone follicolostimolante). Dalla 12a settimana i tassi di ACTH sono elevati nel plasma fetale e rimangono tali fino a gravidanza avanzata, quando la loro concentrazione plasmatica si riduce sensibilmente. L’ipofisi fetale produce anche ormoni oppioidi, quali le endorfine, le encefaline e altri. Con il procedere della gravidanza, la prolattina aumenta considerevolmente nel plasma fetale: dalla 35a alla 42a settimana raggiunge valori medi sei volte superiori a quelli presenti alla 16a e alla 19a settimana. Questi ormoni sono secreti anche dalla placenta. I livelli di GH dell’ipofisi sono piuttosto elevati nel sangue del cordone, ma il ruolo di questo ormone nell’accrescimento e nello sviluppo del f. non è chiaro. Dal momento che la placenta umana concentra attivamente iodio durante il secondo e il terzo trimestre, la tiroide fetale concentra iodio con intensità maggiore rispetto alla tiroide materna. I rischi per il f. connessi con la somministrazione alla madre di iodio marcato o di notevoli quantità di iodio normale sono ovvi. Molti fatti indicano che gli ormoni tiroidei di origine materna passano la placenta in quantità molto limitata o nulla; la tirotropina, invece, attraversa facilmente la placenta e viene impiegata per indurre la maturazione del polmone fetale. Il f., probabilmente, dipende soprattutto dagli ormoni prodotti dalla propria tiroide. Il fatto che i figli affetti da cretinismo tireoprivo abbiano in genere madri eutiroidee può indicare che un tasso normale di secrezione tiroidea materna non può compensare completamente una sintesi inefficace da parte delle ghiandole fetali. Esistono prove convincenti che le paratiroidi fetali elaborano paratormone dalla fine del 1° trimestre e sembrano rispondere in utero a stimoli regolatori; per es., il neonato da madre affetta da iperparatiroidismo può soffrire di tetania ipocalcemica. L’incapacità, da parte del neonato, di concentrare le urine suggerisce che il f. non produce ormone antidiuretico. Tuttavia, è dimostrato che i livelli di arginina-vasopressina nel plasma del funicolo sono notevolmente aumentati rispetto ai valori nel plasma materno.
La surrenale di un f. umano è, in rapporto alle sue dimensioni corporee, superiore a quella dell’adulto; la massa di tessuto che rende così grande la surrenale è costituita dalla zona centrale, definita zona fetale della surrenale. Dopo la nascita, la zona fetale subisce un rapido processo di involuzione. In alcuni rari casi, quando è assente l’ipofisi del f., essa può essere molto ridotta o mancare. Il surrene fetale sintetizza aldosterone. I tassi di aldosterone nel plasma del cordone a termine superano quelli nel plasma materno, così come quelli della renina e della prorenina. Le catecolamine sono presenti nella midollare surrenale fin da stadi molto precoci della vita fetale; esse rivestono un ruolo essenziale nella risposta fetale a situazioni stressanti, all’ipossia e all’asfissia.
Nel corso della gravidanza, la placenta produce quantità di progestinici ed estrogeni in concentrazioni progressivamente crescenti. Questi ormoni hanno effetti importanti, quali la regolazione dell’accrescimento fetale, dello sviluppo e della differenziazione sessuale, della crescita e contrattilità uterina, dell’inizio del travaglio di parto e del flusso ematico uteroplacentare. La produzione di estrogeni non è il risultato della sola attività della placenta, ma dell’integrazione tra madre, placenta e f., che agiscono come una singola unità ( unità fetomaternoplacentare). Ciò è dovuto al fatto che nella madre e nel f. sono presenti solo alcuni precursori degli estrogeni e che gli enzimi necessari per la conversione, quali l’aromatasi e le sulfatasi, si trovano unicamente nella placenta. La mancanza di tali enzimi determina una scarsa o assente produzione di estriolo ed è seguita dalla comparsa di una forma di ittiosi alla nascita nel bambino di sesso maschile, per cui si parla di malattia diaginico-oloandrica (trasmessa dalla madre e che colpisce il f. di sesso maschile). La sintesi di testosterone dal testicolo fetale a partire dal progesterone e dal pregnenolone inizia dalla 10a settimana di gestazione. La possibilità della steroidogenesi da parte dell’ovaio è limitata prima dello sviluppo del follicolo primario e del follicolo del Graaf nella seconda parte della gravidanza. I costituenti del sistema endocrino fetoplacentare, molto probabilmente, giocano un ruolo di rilievo nell’inizio del travaglio spontaneo.
Sistema emopoietico
La prima sede di eritropoiesi è il sacco vitellino dell’embrione in fase iniziale. Successivamente, le sedi di maggiore importanza diventano il fegato e, infine, il midollo. I primi globuli rossi formati sono provvisti di nucleo, ma con il progredire dello sviluppo fetale, un numero via via crescente di essi è privo di nucleo. Con l’accrescersi del f. aumentano sia la volemia sia il numero delle emazie nella circolazione fetale, e quindi si osserva un considerevole incremento della concentrazione di emoglobina (Hb). L’emoglobina fetale (HbF; ➔ emoglobina) raggiunge livelli di oltre 17,0 g/dl a metà della gravidanza. È quindi caratteristica del sangue fetale, presso il termine o a termine della gravidanza, la presenza di una concentrazione di HbF che appare alta rispetto ai valori medi dell’HbA materna. Verso l’8° mese di gestazione compare HbA, che raggiunge valori del 20%. La conta dei reticolociti diminuisce da livelli molto alti, quali sono quelli che si possono riscontrare nei primi stadi della vita fetale, fino a 55‰ nel f. a termine. I globuli rossi del f. differiscono, da un punto di vista metabolico, da quelli di un adulto.
Sindrome alcolica fetale Complesso di alterazioni fisiche a carico del f., attribuibili al consumo di bevande alcoliche da parte della madre nel corso della gestazione. Tra le manifestazioni più frequenti al momento della nascita figurano microcefalia, rime palpebrali corte, naso fortemente camuso, solco labiale superiore ipoplasico. In seguito si manifesta moderato ritardo mentale, insufficiente coordinazione motoria, abnorme irritabilità.