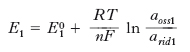pila
Araldica
Tipo di pezza onorevole (➔ pezze).
Chimica e fisica
Dispositivo generatore di corrente elettrica per trasformazione di energia chimica.
La p. di Volta
La prima p. fu ideata e costruita da A. Volta, che ne dette notizia alla Royal Society di Londra il 20 marzo 1800. Volta pervenne a tale realizzazione nel corso delle sue celebri esperienze sulla differenza di potenziale insorgente al contatto fra conduttori diversi (effetto Volta): precisamente constatò che in un circuito costituito da conduttori metallici e da conduttori elettrolitici scorreva una corrente elettrica (che invece non scorreva in un circuito di soli conduttori metallici). L’invenzione della p. costituì una tappa fondamentale nello sviluppo dell’elettrologia; per la prima volta, infatti, si veniva a disporre di un apparecchio capace di far scorrere apprezzabili correnti elettriche in un circuito (sino ad allora si disponeva soltanto delle macchine elettrostatiche, assai poco efficienti come generatori di corrente).
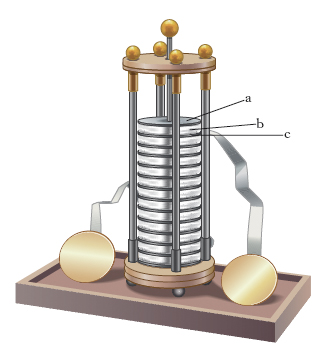
Il dispositivo di cui Volta dette notizia, chiamato p. di Volta a colonna, era costituito (fig. 1) da un certo numero di coppie di dischi di rame a e di zinco c separati da dischi di panno b imbevuto di acqua acidulata; ogni terna disco di rame-disco di panno-disco di zinco costituiva un elemento (in seguito detto elemento voltaico), con una forza elettromotrice (f.e.m.) di circa 1 volt. Il funzionamento era però irregolare, in quanto i dischi di panno, premuti dai dischi sovrastanti, facevano scolare l’acqua acidulata lungo la colonna; Volta, per ovviare a tale inconveniente, realizzò un altro dispositivo, la p. a tazze, in cui ogni elemento era costituito (fig. 2) da un elettrodo di rame e uno di zinco, immersi in un recipiente contenente acqua acidulata; i vari elementi erano collegati in serie, l’elettrodo di zinco di un elemento essendo connesso con quello di rame dell’elemento successivo. In un circuito esterno collegato ai due elettrodi liberi della serie (poli o morsetti della p.) si ha passaggio di corrente, diretta dall’elettrodo libero di rame (polo positivo, a potenziale maggiore dell’altro) all’elettrodo libero di zinco (polo negativo, a potenziale minore dell’altro); l’intensità della corrente si riduce però rapidamente col passare del tempo, sino ad annullarsi, in conseguenza dell’insorgere di una forza controelettromotrice di polarizzazione, dovuta all’elettrolisi operata dalla corrente che percorre ogni elemento dall’elettrodo di zinco verso quello di rame.
Teoria della p. voltaica
In una catena chiusa di soli conduttori metallici omotermi non si ha passaggio di corrente: quindi il prodursi di una corrente in un circuito comprendente un elemento voltaico è dovuto alla presenza dell’elettrolito. Del funzionamento della p. voltaica sono state fornite varie spiegazioni, oltre che dallo stesso Volta, da H. Davy (1826), M. Faraday (1835), lord Kelvin (1879), H. Helmholtz (1884), fino alla teoria di W.H. Nernst (1889), che per prima fornì una spiegazione sul meccanismo di produzione della forza elettromotrice in termini di tendenza di ogni metallo immerso in una soluzione elettrolitica a scambiare ioni con la soluzione; la teoria di Nernst è stata successivamente completata dalla piena comprensione dell’effetto Volta nell’ambito della teoria quantistica dei metalli. Quando un metallo è immerso in acqua o in una soluzione di un suo sale in acqua, viene a modificarsi l’energia potenziale degli ioni costituenti il reticolo cristallino nello strato superficiale del metallo; ciò è dovuto al fatto che alle forze attrattive vincolanti gli ioni al reticolo si aggiungono le forze esercitate sugli ioni dalle molecole di acqua polarizzate elettricamente dagli ioni medesimi.
Possono verificarsi due situazioni: la prima si ha quando allo ione della ‘superficie’ del metallo compete un’energia potenziale maggiore di quella dello ione in soluzione; gli ioni tendono quindi ad abbandonare la fase solida e a passare in soluzione. L’eccesso di carica negativa che così rimane sul metallo ostacola il processo di dissoluzione, ovvero si ha una diminuzione dell’energia potenziale nel metallo fino al raggiungimento di un equilibrio tra le due fasi. La seconda situazione si ha quando allo ione della ‘superficie’ del metallo compete un’energia minore; gli ioni tendono allora a passare dalla soluzione alla fase solida. L’eccesso di carica positiva, che così si realizza nel metallo, porta anche in questo caso al raggiungimento dell’equilibrio.
Poiché i processi esaminati dipendono, oltre che dalla natura del metallo, anche dalla concentrazione degli ioni in soluzione, la prima situazione (dissoluzione di ioni) si ha quando il metallo è immerso in acqua pura o in una soluzione molto diluita di un suo sale, mentre l’altra (deposito di ioni) si ha quando si è in presenza di una soluzione concentrata.
Il processo di dissoluzione di ioni consiste in una reazione di ossidazione, in quanto lo ione che abbandona il metallo ha una carica positiva non più bilanciata dagli elettroni liberi della struttura cristallina; in definitiva, il processo ha luogo come se l’atomo metallico acquistasse una o più cariche positive nette secondo lo schema Me → Me+n+ne–, dove n è l’elettrovalenza del metallo ed e– l’elettrone. La deposizione degli ioni, al contrario, consiste in una reazione di riduzione secondo lo schema Me+n+ne– → Me. La ridistribuzione di carica tra soluzione e metallo determina una differenza di potenziale elettrico che misura la tendenza di un metallo a cedere ioni in soluzione. Poiché la differenza di potenziale, secondo l’equazione di Nernst, dipende dalla concentrazione della soluzione e dalla temperatura, si conviene di far riferimento a soluzione ad attività unitaria; la corrispondente forza elettromotrice di una cella elettrolitica di cui un elettrodo è il metallo in esame e l’altro è l’elettrodo normale a idrogeno, alla temperatura di 25 °C, ha il nome di potenziale elettrochimico standard di riduzione del metallo.
P. chimica
Ordinando secondo il valore crescente del potenziale elettrochimico i vari metalli, si ottiene una serie (serie elettrochimica), in cui ciascun metallo è capace di spostare da una soluzione gli ioni dei metalli che lo seguono; in questa serie lo zinco, per es., il cui potenziale elettrochimico è −0,76 V, precede il rame, il cui potenziale elettrochimico è +0,34 V. Da quanto detto risultano varie possibilità per realizzare una p. chimica. Così, poiché la differenza di potenziale tra un metallo e un elettrolito dipende, a parità di ogni altra condizione, dalla concentrazione dell’elettrolito, una p. può essere costituita da due elettrodi dello stesso metallo immersi in una soluzione di un sale di quel metallo, avente diversa concentrazione presso l’uno e presso l’altro elettrodo: sono, queste, le cosiddette p. a concentrazione. Oppure si possono realizzare due celle elettrolitiche, una, per es., con elettrodo di zinco in una soluzione diluita di un sale di zinco, l’altra con elettrodo di rame in una soluzione concentrata di un sale di rame, e far comunicare le due celle in modo che ioni possono diffondere lentamente da una all’altra: si hanno allora le cosiddette p. a due liquidi. O, ancora, si possono avere due celle elettrolitiche formate dal medesimo elettrolito e alla stessa concentrazione, ma a diversa temperatura. Consideriamo un generico processo riduttivo che avviene in una p.:
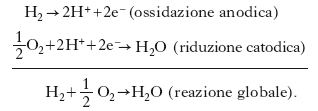
[1] formula,
dove gli indici 1 e 2 indicano le due specie reagenti, che danno luogo, come è noto, a una coppia ossidoriduttiva coniugata. In elettrochimica si conviene di chiamare catodo e anodo i comparti dove avvengono rispettivamente la semireazione di riduzione e quella di ossidazione; così al comparto catodico si ha la semireazione:
[2] formula
e in quello anodico
[3] formula,
dove n rappresenta il numero di elettroni scambiati nel processo elementare. Si noti che nelle p. il catodo risulta l’elettrodo a maggior potenziale, cioè quello positivo, e l’anodo quello negativo, al contrario di quel che avviene nei processi elettrolitici. Per es., nel caso di una p. rame/zinco, governata dalla reazione Cu2++Zn0⇔Cu0+Zn2+, la semireazione catodica è Cu2++2e−⇔Cu0 e quella anodica Zn0⇔Zn2++2e−. La forza elettromotrice di una p., se E1 e E2 sono i potenziali rispettivamente del semi;elemento ossidante e di quello riducente, è data da
[4] formula.
I potenziali dei due semielementi sono ricavabili dall’equazione di Nernst; così per il semielemento 1 si ha:
[5] formula
dove E10 è il potenziale standard del semielemento, R la costante dei gas, T la temperatura termodinamica, F la costante di Faraday, aoss1 e arid1 rispettivamente l’attività della specie nella forma ossidata e nella forma ridotta. La forza elettromotrice della p. perciò risulta:
[6] formula.
L’argomento del logaritmo rappresenta il quoziente di reazione Q che indica lo stato di avanzamento della medesima. Come si può notare, la forza elettromotrice dipende dalla natura degli elettrodi, dall’attività (cioè dalla concentrazione) dei due semielementi e dalla temperatura. Quando l’attività di tutte le specie coinvolte è unitaria, la forza elettromotrice corrisponde a quella di una p. standard e dalla [6] si ottiene
[7] formula.
Spesso, in elettrochimica, si fa riferimento a una p. nelle condizioni di temperatura standard (298 K) e, passando ai logaritmi in base 10, si ottiene
[8] formula.
In tal modo, note le attività delle specie interessate (o le concentrazioni, a condizione che siano tanto piccole che il coefficiente di attività risulti unitario) e i potenziali standard di riduzione, è possibile ricavare la f.e.m. di una pila. Per es., nel caso della p. rame/zinco, considerando che le attività nella fase solida sono da considerarsi unitarie, si ha
[8′] formula.
La forza elettromotrice standard di questa p. risulta E0=0,34−(−0,76)=1,10 V. Durante il funzionamento della p. le attività delle specie reagenti diminuiscono e aumentano quelle dei prodotti, cosicché il valore di Q diminuisce e con esso la forza elettromotrice finché, all’equilibrio, essa diventa nulla e la p. risulta scarica. In tali condizioni, l’inverso del quoziente di reazione coincide con la costante d’equilibrio K della reazione e si ha
[9] formula.
È perciò possibile ricavare la costante d’equilibrio per qualsiasi processo ossidoriduttivo, una volta noti i potenziali standard e la temperatura di riferimento. Così, per la p. zinco/rame, a 25 °C, si ha
[9′] formula
da cui K ≃ 1037; dal valore della costante si può evincere che la reazione considerata è del tutto irreversibile. La forza elettromotrice di una p. è legata alla variazione di energia libera standard della reazione di ossidoriduzione, che è pari al massimo lavoro elettrico ottenibile dalla p., cioè
[10] formula.
Così, noto tale valore, è possibile ricavare la forza elettromotrice di una p., oppure è possibile ricavarne l’energia libera standard dai dati elettrochimici. Per es., per la p. rame/zinco (E=1,10 V) si ha ΔG0=−2∙9,65∙104∙1,10=−2,12∙104 J. Poiché l’energia libera è data da
[11] formula
e all’equilibrio ΔG=0, si ottiene:
[12] formula.
Combinando la [10] con la [12] si ottiene nuovamente la [9], che è perciò derivabile anche da considerazioni puramente termodinamiche. Facendo poi intervenire l’equazione di Gibbs-Helmholtz, è possibile correlare la f.e.m., la temperatura, il coefficiente termico di f.e.m. (variazione della f.e.m. per una variazione di 1 °C della temperatura), grandezze tutte direttamente misurabili, e la variazione di entalpia, ΔH, nella trasformazione:
i risultati che si ottengono sono in buon accordo tra loro, e ciò conferma il fatto sostanziale che l’energia elettrica generata da una p. deriva dalla conversione di energia libera messa in gioco nelle reazioni chimiche sviluppantisi nella p. medesima.
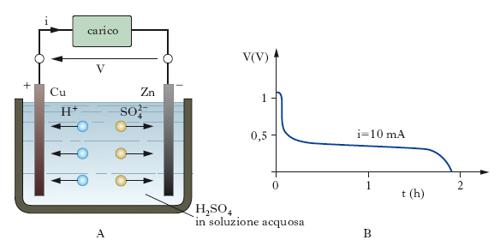
Per svolgere la teoria che porta alla determinazione analitica della forza elettromotrice di una p. chimica occorre però poter fare riferimento a trasformazioni reversibili, e la p. di Volta non è un dispositivo a funzionamento reversibile. Infatti nella p. il rame funziona da catodo, cioè da elettrodo al quale si manifesta una reazione di riduzione, e lo zinco da anodo, cioè da elettrodo al quale si manifesta una reazione di ossidazione (fig. 3A). Tali reazioni sono rispettivamente la formazione di idrogeno gassoso a partire dagli ioni H+ (da cui un impoverimen;to di questi in vicinanza dell’elettrodo di rame e un flusso di tali ioni dal corpo della soluzione verso l’elettrodo) e la dissoluzione dello zinco (da cui un flusso di ioni SO42– verso l’elettrodo di zinco per bilanciare l’eccesso di ioni Zn2+ prodotti). Come conseguenza, l’elettrodo di zinco continua a dissolversi e sull’elettrodo di rame si formano molecole di idrogeno gassoso, che si libera irreversibilmente. A causa di queste reazioni secondarie, insorge rapidamente una forza controelettromotrice dell’ordine di 0,5 V, che all’incirca dimezza la forza elettromotrice; per di più, quando la polarizzazione è abbastanza spinta, gli ioni Zn2+, a causa del progressivo impoverimento della soluzione in ioni H+, si depositano sull’elettrodo di rame, facendo venir meno il normale meccanismo e determinando un brusco annullarsi della f.e.m.; tutto ciò appare chiaramente dalla curva sperimentale di scarica riportata nella fig. 3 B. Questi gravi inconvenienti sono in gran parte eliminati nelle p. depolarizzate, nelle quali le reazioni secondarie agli elettrodi sono ritardate in virtù della presenza di opportune sostanze (depolarizzatori) che assorbono o fissano in composti non volatili gli ioni indesiderati. È una p. depolarizzata, per es., la p. Daniell, direttamente derivata da quella di Volta ma, a differenza di questa, caratterizzata da un funzionamento più vicino a una condizione di reversibilità.
P. a combustibile
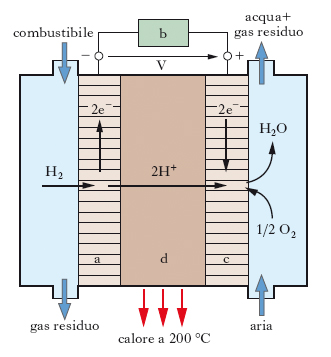
La p. a combustibile (o a combustione; ingl. fuel cell) è un sistema elettrochimico che converte l’energia chimica di un combustibile direttamente in energia elettrica in continuo, senza richiedere di essere ricaricato. La fig. 4 illustra il principio di funzionamento di una p. a combustibile che utilizza l’idrogeno e l’ossigeno come reagenti e l’acido fosforico come elettrolito. Agli elettrodi di platino, anodo a e catodo c, fluiscono rispettivamente un combustibile ricco di idrogeno e un ossidante (l’ossigeno dell’aria). Gli elettrodi si comportano da siti catalitici per le due semireazioni elettrochimiche che consumano idrogeno e ossigeno con produzione di acqua:
L’ossidazione elettrochimica del combustibile all’anodo produce elettroni che, passando attraverso un circuito esterno b, raggiungono il catodo dove si combinano con l’ossidante, con formazione di acqua quale prodotto refluo. L’elettrolito d si comporta da conduttore per gli ioni idrogeno che, prodotti dalla semireazione anodica, sono utilizzati nella semireazione catodica, consentendo così di chiudere il circuito elettrico della cella elementare. Una singola cella del tipo rappresentato in fig. 4 produce una tensione V di poco inferiore a 1 V; cosicché per raggiungere un valore significativo di tensione è necessario, come nelle batterie, collegare in serie più celle.
Gli impianti completi sono costituiti, oltre che dalla parte elettrochimica (cella), da un sistema per la produzione dell’idrogeno, costituito da un reattore in cui avviene la conversione ossidante di idrocarburi (gas naturale, frazioni liquide petrolifere ecc.) in gas di sintesi, e da un sistema per la conversione della corrente continua, prodotta dalle celle, in corrente alternata. A causa dei fenomeni di polarizzazione, la trasformazione elettrochimica è accompagnata da produzione di energia termica che deve essere rimossa (poiché è necessario mantenere costante la temperatura di lavoro della cella) e che può trovare varie utilizzazioni (cogenerazione, produzione di energia elettrica mediante cicli termici convenzionali).
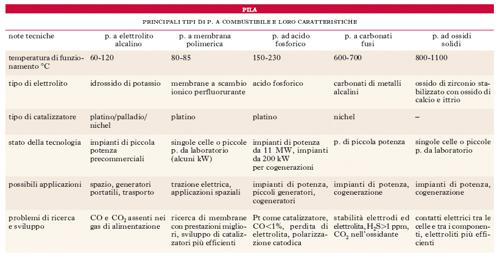
Le p. a combustibile vengono classificate sulla base dell’elettrolito impiegato; infatti, la natura dell’elettrolito comporta, oltre alle diverse specie di ioni che migrano all’interno della cella elementare, differenti caratteristiche di funzionamento per quanto riguarda la temperatura del processo, la struttura degli elettrodi e la composizione dei gas reagenti. I tipi di p. a combustibile di maggiore interesse sono: a elettrolito alcalino, a membrana polimerica, ad acido fosforico, a carbonati fusi e a ossidi solidi. I principali dati caratteristici sono riportati in tab.
Rispetto agli impianti che utilizzano cicli termici, gli impianti con p. a combustibile presentano rendimenti elettrici nettamente superiori (dal 40-48% per le p. ad acido fosforico al 60% per la p. a carbonati fusi); inoltre, hanno prestazioni praticamente indipendenti dalle variazioni del carico elettrico applicato e impatto ambientale estremamente ridotto.
Tecnica
Nelle costruzioni civili, struttura portante verticale che sorregge due arcate o travate contigue di un ponte, mediante la quale si trasmettono al terreno i carichi permanenti e quelli accidentali causati dal transito sul ponte. Le p., come elementi di sostegno di ponti, sono generalmente in muratura o in calcestruzzo, oppure, specialmente se di grande altezza, in cemento armato con strutture per lo più a traliccio o internamente cave; per ponti di acciaio e per grandi altezze, si costruiscono anche p. in acciaio a traliccio; in tal caso sono in genere incernierate agli estremi inferiore e superiore e sono dette stilate pendolari; per ponti provvisori o in zone ricche di legname da costruzione, le p. possono anche essere eseguite in legno; in tal caso sono dette palate o stilate.
P. spalla P. impiegate, soprattutto in passato, nei ponti e nei viadotti con rilevante numero di arcate, intercalate a p. normali, e capaci di sostenere da sole la spinta di una delle due arcate che gravano su di esse anche senza il contrasto dell’arcata contigua.