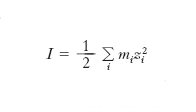ione
Atomo o gruppo atomico dotato di carica elettrica, positiva o negativa a seconda che abbia perduto o acquistato uno o più elettroni rispetto alla configurazione di sistema elettricamente neutro (➔ ionizzazione). Il nome deriva dall’inglese ion, termine coniato nel 1834 da M. Faraday, che lo trasse dal greco ἰόν «andato», con allusione al movimento da un polo all’altro. Uno i. si indica con il simbolo chimico dell’atomo o del gruppo atomico, portante in alto a destra tanti + o − quanti sono gli elettroni perduti o acquistati o anche tali segni preceduti o seguiti dal numero indicante gli elettroni.
Il termine fu inizialmente usato per indicare gli i. elettrolitici, quelli cioè provenienti dalla dissociazione di un elettrolito in soluzione, e passò poi a indicare particelle cariche comunque presenti in una sostanza solida, liquida o aeriforme. La caratteristica peculiare degli i., che ne giustifica la denominazione, è la loro capacità di muoversi sotto l’azione di un campo elettrico, quelli positivi (perciò detti cationi) dirigendosi verso le regioni catodiche, cioè a potenziale minore, e quelli negativi (anioni) dirigendosi verso le regioni anodiche, cioè a potenziale maggiore, con un moto d’insieme (migrazione ionica) che, come si dimostra, è assimilabile, in un campo uniforme, a un moto rettilineo uniforme; tale capacità di movimento degli i., che determina la conducibilità elettrica del mezzo che li contiene, è caratterizzata dalla cosiddetta mobilità ionica, che è per l’appunto la velocità con cui gli i. considerati si muovono in un campo elettrico uniforme e di intensità unitaria. La mobilità è evidentemente ristretta agli i. che si producono in sostanze fluide; gli atomi o i gruppi atomici carichi presenti in sostanze solide cristalline a legame ionico non possono in generale muoversi sotto l’azione di un campo elettrico.
Particolare interesse rivestono nei liquidi gli i. che provengono dalla dissociazione elettrolitica: lo i. anfotero (o anfoione) è uno i. che presenta contemporaneamente una carica positiva e una negativa; tali cariche sono di solito localizzate alle estremità opposte di una catena più o meno lunga, come per es., in certe condizioni di pH, negli amminoacidi, H3N+−R−COO−, dove R è un radicale, generalmente idrocarburico; lo i. complesso è uno i. ottenuto dalla combinazione di un catione con una o più molecole neutre o altri i. di segno opposto; gli i. complessi in soluzione si presentano come individualità distinte dalle specie che li compongono. Così, mescolando quantità opportune di una soluzione di cloruro sodico e di cloruro platinico si ha nella soluzione la presenza di i. sodio, Na+, e di i. complessi PtCl6––, mentre mancano gli i. cloro o gli i. platino; lo i. solvatato è uno i. al quale si sono associate una o più molecole di solvente; se questo è costituito da acqua lo i. si dice anche idratato.
Per quanto riguarda la valutazione del numero di i. presenti in un gas a un certo istante, accanto ai processi di ionizzazione connessi con la loro creazione vanno considerati anche quelli associati alla loro scomparsa. Essi sono principalmente dovuti alla scarica sugli elettrodi e alla ricombinazione ionica quando due di essi di segno contrario si uniscono per ricostituire un sistema elettricamente neutro. Se il tasso di ionizzazione e quello di deionizzazione (i. prodotti o scomparsi, per unità di volume e per unità di tempo) si mantengono uguali, si viene a stabilire nella massa del gas una condizione di equilibrio, per cui il numero complessivo di i. presenti si mantiene costante. La presenza di i. in un gas conferisce a questo una sia pur piccola conducibilità elettrica. Un’importante proprietà degli i. gassosi in generale è quella di dar luogo ad alterazioni locali dell’equilibrio metastabile di un fluido, per es. soprassaturo o surriscaldato, agendo quindi rispettivamente come centri di formazione di goccioline liquide o di bollicine di vapore: su tale proprietà si fonda il funzionamento delle camere a nebbia e delle camere a bolle, apparecchi mediante i quali si rende visibile la scia di i. che una particella ionizzante si lascia dietro (➔ camera).
Si chiama forza ionica la grandezza che permette di esprimere il contributo delle cariche presenti in una soluzione elettrolitica sul loro comportamento termodinamico. È espressa dalla relazione:
dove mi sono le concentrazioni delle specie ioniche, cationiche e anioniche, espresse come molalità, e zi la loro carica.