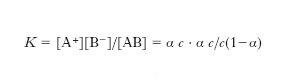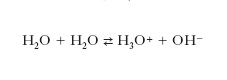elettrolito
Ogni sostanza che si dissoci, in misura maggiore o minore, in ioni, quando venga disciolta in acqua (o in altri solventi dissocianti).
Soluzioni elettrolitiche
Le soluzioni elettrolitiche costituiscono i cosiddetti conduttori elettrici di seconda specie o ionici. In tale categoria di conduttori, alla quale appartengono le soluzioni acquose degli acidi, delle basi e dei sali, gli ossidi ionici e i sali allo stato fuso, la conduzione avviene attraverso un doppio flusso, in direzione opposta, di particelle materiali cariche ( ioni) che si muovono dalle zone a potenziale maggiore verso quelle a potenziale minore se hanno carica positiva ( cationi) o in direzione opposta se hanno carica negativa ( anioni). La possibilità di fornire ioni in soluzione è la caratteristica principale degli elettroliti.
Nei solidi ionici, tali ioni preesistono nel reticolo cristallino dell’e., ma in questa condizione sono parzialmente bloccati dalla rigidità del reticolo; quando l’e. è messo in contatto con un solvente polare, caratterizzato quindi da un valore sufficientemente elevato della costante dielettrica, si ha un abbassamento tale della forza di interazione elettrostatica (che è inversamente proporzionale alla costante dielettrica del mezzo) da portare alla rottura del legame ionico. Dal reticolo vengono liberati gli ioni in numero dipendente dalla forza dell’elettrolito: per gli e. forti la massima parte delle molecole è in forma dissociata, per gli e. deboli gli ioni liberati dalle molecole sono invece in numero esiguo rispetto alle molecole che conservano la loro identità.
La forza di un e. può essere determinata da misure di conducibilità elettrica, forza elettromotrice, abbassamento del punto di gelo; essa è quantitativamente espressa dal grado di dissociazione α, inteso come rapporto fra il numero di molecole dissociate e il numero di molecole totali. La dissociazione è regolata dalla legge dell’equilibrio chimico, per cui a ogni e., a una certa temperatura, corrisponde un valore della costante di dissociazione espressa in attività. Nel caso più semplice di un e. univalente la relazione fra costante di dissociazione, grado di dissociazione e concentrazione della soluzione, per le soluzioni diluite (nelle quali i coefficienti di attività possono considerarsi unitari) segue la legge di Ostwald:
indicandosi con AB l’e. univalente, con K la costante di dissociazione, con α il grado di dissociazione, con c la concentrazione dell’elettrolito nella soluzione. Mentre la costante di equilibrio espressa in termini di attività varia soltanto con la temperatura, il grado di dissociazione risulta influenzato dal valore della concentrazione (aumenta con l’aumentare della diluizione), della pressione (aumenta all’aumentare della pressione se la reazione avviene con variazione di volume, come nel caso di sviluppo di gas dalla soluzione), della temperatura (generalmente diminuisce al crescere della temperatura).
Il grado di dissociazione di un e. è uguale al rapporto fra la conducibilità equivalente al valore di concentrazione considerato e la conducibilità equivalente limite, intesa come valore a diluizione infinita. Nel caso dell’acqua, per esempio, che può essere definita un elettrolito debole in considerazione del fatto che si ionizza in piccola parte secondo l’equilibrio:
la conducibilità specifica a 25 °C è pari a 5,5‧10–8 S‧cm–1 e la conducibilità equivalente limite, determinata dai singoli valori degli ioni costituenti (H3O+ e OH–), è 547,8 S. Poiché la conducibilità equivalente (in S‧cm2) è data dal prodotto della conducibilità specifica per il volume (in cm3) che contiene una mole di acqua, risulta α=5,5‧10−8‧18/547,8=1,81‧10−9, da cui: K=c2α2/c (1−α)=10−14.
Tipi di elettroliti
E. anfotero (o anfolito) viene definito ogni elettrolito che, sciolto in soluzione, si può comportare da acido o da base a seconda del pH; comunque la concentrazione acida che si può realizzare in soluzione alcalina e quella alcalina che si può realizzare in soluzione acida sono perfettamente uguali. L’acido o la base prodotti non sono fra loro coniugati. Al punto isoelettrico un anfolito si comporta in uguale misura da acido e da base; così per es. gli amminoacidi contengono nella loro molecola un gruppo acido (COOH) e uno alcalino (NH2): al punto isoelettrico il numero di gruppi acidi che si dissocia (COOH ⇄ COO– + H+) è uguale a quello dei gruppi basici che si protona (NH2 + H+ ⇄ NH3+).
E. colloidale È costituito da una molecola con un gruppo ionizzabile unito però a un residuo organico a elevato numero di atomi di carbonio (per es., saponi, tensioattivi). La soluzione di un e. colloidale ha proprietà contemporaneamente simili per alcuni aspetti a quelle delle soluzioni saline (elevata conducibilità elettrica) e per altri a quelle delle soluzioni colloidali (valori assai bassi dell’abbassamento del punto di gelo, dell’innalzamento del punto di ebollizione, della diminuzione della tensione di vapore). E. fuso Un sale di tipo ionico riscaldato alla temperatura di fusione subisce dissociazione ionica, provocata dall’agitazione termica che rompe i legami che tengono uniti gli ioni, e il sale fuso diviene un e., cioè un conduttore di 2a classe nel quale il trasporto della corrente avviene per mezzo degli ioni. Il comportamento elettrochimico di un sale fuso sotto certi aspetti è analogo a quello di un e. forte in soluzione diluita; entrambi sono dissociati in massima parte; la loro conducibilità equivalente è dello stesso ordine di grandezza. Se a un e. fuso se ne miscela un altro proveniente da un sale forte, la conduttività varia in modo quasi additivo; se il sale aggiunto è poco dissociato, allora si ha, di solito, la formazione di ioni complessi; la loro produzione implica lo stabilirsi di legami covalenti temporanei o stabili che influenzano il coefficiente di conducibilità e di attività degli ioni interessati. Gli e. fusi trovano applicazione in metallurgia per la preparazione di metalli che a causa del valore del loro potenziale di riduzione non possono essere preparati in soluzione acquosa (Al, Mg, Zn). Le elevate densità di corrente che si possono impiegare provocano polarizzazioni di concentrazione, mentre (anche se i fenomeni non sono ancora del tutto chiari) sembrano trascurabili le sovratensioni di scambio ionico. Dal punto di vista teorico il processo opposto alla deposizione, e cioè la dissoluzione dei metalli in elettroliti fusi, è di particolare interesse in quanto decorre per numerosi metalli in maniera praticamente reversibile.