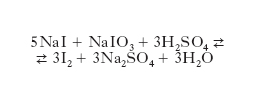iodio
Elemento chimico, appartenente al gruppo degli alogeni, scoperto da B. Courtois nel 1812; simbolo I, numero atomico 53, peso atomico 126,90. Il nome deriva dal francese iode, coniato nel 1812 da J.-L. Gay-Lussac, che lo trasse dal greco ἴον «violetto», per il colore dei suoi vapori.
Caratteri generali
È noto un solo isotopo stabile, ma se ne conoscono una ventina radioattivi, dei quali il più importante è quello con numero di massa 131 e vita media di circa 8 giorni.
In natura lo i. non si trova allo stato libero ma sempre allo stato combinato con diversi metalli. I minerali nei quali lo i. è un elemento essenziale sono una dozzina, di cui il più importante è la lautarite, iodato di calcio anidro, che è la forma sotto cui si trova lo i. nel nitrato del Cile. In piccole quantità esso è contenuto nelle acque del mare (0,06 mg/l) e nelle acque salate presenti nei giacimenti petroliferi. Nel regno vegetale si trova i. solo nelle alghe; nel mondo animale si trova i. sia negli Invertebrati, in tessuti diversi a seconda della specie, sia nei Vertebrati, nei quali è concentrato soprattutto a livello della tiroide.
Estrazione e usi
Lo i. si estrae dalle acque madri di cristallizzazione del nitrato di sodio, dalle acque di sorgenti salsoiodiche e da alcune varietà di alghe (nelle quali lo i. è presente nella misura dello 0,2-0,4% rispetto al prodotto secco e dalle cui ceneri può essere estratto). Nelle acque di cristallizzazione del nitrato di sodio esso si trova sotto forma di iodato sodico; una parte di questa soluzione viene trattata con acido solforoso o con un bisolfito in modo da ridurre lo iodato in ioduro. Contemporaneamente la soluzione diventa acida per acido solforico perché il gruppo SO2– – si ossida a SO4– –. Questa soluzione acida contenente i. come ioduro viene aggiunta alle acque madri contenenti lo iodato e si ha la reazione seguente, con formazione di i. libero (che precipita e può essere recuperato per filtrazione):
Dalle acque salsoiodiche e dalle ceneri delle alghe lo i., che si trova sotto forma di ioduro, si ottiene allo stato libero mediante ossidazione. Gli agenti ossidanti più usati sono l’acido nitroso e il bicromato di potassio. Lo i. può essere recuperato anche dalle salamoie provenienti dall’estrazione del bromo. Lo i. greggio comunque ottenuto viene purificato mediante sublimazione.
Alla temperatura ordinaria lo i. si presenta come un solido cristallino avente notevole tensione di vapore (4 Pa a 0 °C; 287 Pa a 50 °C; 3.600 Pa a 90 °C), lucentezza metallica, colore violetto nero; fonde a 113,6 °C e bolle a 184,3 °C; è poco solubile in acqua (circa 0,3 g/l), facilmente solubile in numerosi solventi organici (alcol, etere, benzene, solfuro di carbonio) nonché nelle soluzioni acquose contenenti acido iodidrico o ioduri o bromuri alcalini ecc.; per riscaldamento anche blando si ha sublimazione, cioè passaggio diretto da solido a vapore.
Le soluzioni di i. presentano tinte diverse, variabili dal violetto al giallo bruno, in dipendenza dello stato in cui l’elemento si trova in soluzione: quando si trova nello stato di molecole biatomiche non solvatate, le soluzioni hanno un colore violetto analogo a quello dei vapori di i.; quando si trova nello stato solvatato, possiedono un colore giallo-bruno o intermedio fra questo e il violetto.
Chimicamente lo i. si comporta in modo analogo agli altri alogeni, ma rispetto a questi ha un’affinità minore sia per l’idrogeno sia per gli altri metalli in genere. Nei suoi composti mostra numeri di ossidazione −1, +1, +3, +5 e +7. È anche noto un ossido in cui lo iodio ha numero di ossidazione +4. Forma composti con tutti gli elementi eccetto che con i gas nobili, lo zolfo e il tellurio; è usato, sotto forma di diversi composti, per preparati fotografici, nell’industria del cuoio, nell’industria dei coloranti sintetici, come catalizzatore, nella preparazione di germicidi, di antisettici, come reattivo in chimica analitica.
Acidi e composti
L’acido iodico ha formula HIO3, e si presenta sotto forma di cristalli incolori solubili in acqua. È l’ossiacido più stabile dello i.; si prepara per azione di un acido forte (solforico ecc.) sui sali di i., o per azione di un ossidante (acido nitrico concentrato, acqua ossigenata, acido perclorico ecc.) sullo i., o per idratazione dell’anidride iodica. A caldo perde acqua e si trasforma nell’anidride iodica, I2O5; ha proprietà ossidanti e agisce come astringente. Dà origine sia a sali acidi del tipo KIO3•HIO3, KIO3•2HIO3, caratterizzati da legami idrogeno e perciò facilmente decomponibili, sia a sali neutri (iodati). Questi hanno formula MeIO3, dove Me è un metallo monovalente. Sono sostanze cristalline, in genere incolori, che si ottengono per ossidazione dei corrispondenti ioduri; gli iodati alcalini e di magnesio sono solubili in acqua, i rimanenti (a eccezione di quelli dei metalli tetravalenti che si sciolgono però in soluzione diluita di acido nitrico) sono tutti più o meno insolubili. Al riscaldamento si decompongono in maniera diversa: si può avere sviluppo di ossigeno e formazione degli ioduri corrispondenti oppure liberazione dello iodio e dell’ossigeno e formazione dell’ossido metallico ecc.; in miscela con sostanze organiche formano spesso miscugli esplosivi.
L’acido iodidrico è un composto dell’idrogeno con lo iodio, HI. In condizioni ordinarie è un gas incolore di odore pungente. Si scioglie facilmente in acqua dando una soluzione dotata di carattere acido che fuma all’aria e che, sotto l’azione della luce e dell’aria, si decompone liberando iodio. Alla temperatura −35,4 °C condensa in un liquido incolore che solidifica a −50 °C. Industrialmente si ottiene per reazione dell’idrogeno con vapori di iodio in presenza di un catalizzatore di platino; in piccoli quantitativi si prepara aggiungendo acqua a una miscela di fosforo rosso e di iodio. Serve a preparare composti dello iodio e come riducente. Gli ioduri sono i sali dell’acido iodidrico, MeI, con Me metallo monovalente. Sono i composti più importanti dello i.; quelli della maggior parte dei metalli sono solidi solubili in acqua; soltanto alcuni, come lo ioduro rameoso, quello di piombo e quelli di mercurio, sono insolubili. Gli ioduri, soprattutto quello di potassio, sono utilizzati nella somministrazione terapeutica dello iodio.
Lo iodo;formio, CHI3, triiodometano, si presenta sotto forma di cristalli tabulari, lucenti, untuosi al tatto, di colore giallo, di odore penetrante, persistente, di sapore sgradevole, insolubili in acqua, poco solubili in alcol e in etere, solubili in cloroformio.
La iodometria è un metodo di analisi chimica che si basa sulla proprietà dello iodio libero di reagire quantitativamente con il tiosolfato di sodio secondo la reazione:
2Na2S2O3 + I2 ⇄ 2NaI + Na2S4O6.
Poiché numerose sostanze ossidanti liberano i. dagli ioduri, esse possono essere determinate, indirettamente, titolando lo i. liberato con una soluzione di tiosolfato sodico di concentrazione nota.
Aspetti medici
Nella tiroide, che regola il metabolismo iodico, lo i. è in gran parte legato a una sostanza proteica, la tireoglobulina, che incorpora circa il 95% dello i. della tiroide e dalla cui idrolisi si liberano gli ormoni tiroidei, di natura amminoacidica, tiroxina e triiodotironina.
Nell’uomo, il fabbisogno giornaliero di i., che è di circa 1,2 μmol (150 μg), viene solitamente soddisfatto dallo i. presente nell’acqua potabile. Nelle regioni in cui l’acqua potabile è povera di i., quest’ultimo, sotto forma di ioduri, viene addizionato all’acqua potabile stessa o al sale da cucina in modo da evitare, agli individui che vi risiedono, l’insorgenza di una ipofunzionalità della tiroide. L’isotopo radioattivo 131, captato dalle cellule tiroidee, viene usato in radioterapia medica per la cura del carcinoma.
In terapia lo i. si impiega per uso locale, soprattutto sotto forma di tintura di i., come antisettico della cute e delle mucose e come revulsivo. Per uso interno lo i. e i suoi composti sono usati nella cura sia del gozzo semplice endemico (che può giungere sino al quadro dell’ipotiroidismo) sia dell’ipertiroidismo (in quest’ultimo caso si utilizzano alte dosi di i. che bloccano sia la sintesi sia la dismissione di ormoni iodati: effetto Wolff-Chaikoff), della lue terziaria (come coadiuvante), delle micosi (ad alte dosi), dell’arteriosclerosi, del saturnismo, del mercurialismo ecc. L’isotopo radioattivo 13153I è impiegato, in diagnostica, per lo studio funzionale della tiroide (prova di captazione dell’isotopo radioattivo), in terapia nell’ipertiroidismo e nel cancro della tiroide. Come mezzo di contrasto ai raggi X viene impiegata la iodipamide, acido adipilamminotriiodobenzoico, di formula C20H14I6N2O6.
Le manifestazioni tossiche da i. sono rappresentate da alterazioni cutanee e delle mucose e, nei casi più gravi, da fenomeni generali che vanno sotto il nome di iodismo. Questo si osserva nel corso di trattamenti terapeutici e, in forma più grave e acuta, in seguito a introduzione nell’organismo di dosi abnormi di preparati iodici. Si manifesta con irritazione della mucosa congiuntivale, nasale, orale, bronchiale, e con eruzioni cutanee (eritemi, papule, vescicole, pustole). Lo iodismo acuto-grave può provocare lesioni del sistema nervoso centrale e periferico. Quello cronico, oltre all’irritazione cronica delle mucose, è caratterizzato da lesioni renali e dal colorito giallo dei denti. Iodemia è il contenuto di i. nel sangue. Se ne distingue una quota organica e una inorganica: la loro somma oscilla normalmente tra 4 e 8 microgrammi per 100 ml di plasma.