magnesio
Elemento chimico bivalente di numero atomico 12, peso atomico 24,312, simbolo Mg, del 2° gruppo del sistema periodico.
Chimica
Generalità
È noto fin dal 1808, quando H. Davy ne descrisse la preparazione per via elettrolitica. È diffuso in natura: allo stato di minerale (magnesite, dolomite, kieserite, carnallite, cainite, schoenite, brucite, talco, serpentino, forsterite, olivina, diopside ecc.), nelle acque del mare come cloruro, nelle acque di alcune sorgenti salate, nei depositi salini del tipo Stassfurt ecc.
Da un punto di vista geochimico il m., presente nella crosta terrestre con un’abbondanza media di 23.000 ppm (parti per milione), è considerato un elemento litofilo e nell’ambito della consolidazione magmatica esso si concentra soprattutto nei minerali ferro-magnesiaci di prima segregazione (forsterite, olivina), tanto che nelle rocce ignee il rapporto Fe/Mg aumenta con il procedere del processo di differenziazione magmatica.
Di colore bianco lucente, è il metallo più leggero usato in metallurgia (densità a 20 °C: 1,74 g/cm3) e per questo è impiegato nelle costruzioni automobilistiche, aeronautiche ecc., solo o in leghe. Cristallizza nel sistema esagonale, fonde a 650 °C e bolle a 1090 °C, a pressione normale. Il carico di rottura del m. è di circa 150 N/mm2, mentre allo stato di lamiera laminata a freddo è di circa 250 N/mm2.
Oltre alla leggerezza (4 volte meno pesante del ferro, 1,5 volte meno dell’alluminio), il m. ha diverse proprietà tecnologiche favorevoli: facile lavorabilità alle macchine utensili, facile forgiabilità per colata, per fucinatura, per laminazione, per estrusione; la lavorabilità allo stato plastico è modesta a freddo, ma buona a caldo (200 °C). Nella lavorazione per colata si deve proteggere il bagno dal contatto con l’aria a causa dell’elevata ossidabilità del metallo fuso. I vari pezzi di m. si prestano a essere saldati (con sistemi ad arco, a resistenza, brasatura ecc.). Il m. presenta inoltre buona conduttività elettrica e termica, non è ferromagnetico, resiste abbastanza bene all’attacco degli agenti atmosferici, degli alcali, di molte sostanze organiche, forma una larga serie di leghe, soprattutto con alluminio, zinco, manganese, zirconio.
Il m. brucia con fiamma viva, ricca di raggi attinici, dando ossido e anche azoturo di m.; all’aria secca a temperatura ordinaria è abbastanza stabile, all’aria umida forma uno strato protettivo di ossido; a contatto dell’acqua calda sviluppa idrogeno, ma la reazione si arresta per formazione di uno strato protettivo di idrossido; ciò si verifica anche in soluzioni alcaline ma non in quelle acide, in cui il m. si dissolve rapidamente. Il m. si combina direttamente con gli alogeni, con il fosforo, con lo zolfo. La combustione avviene facilmente quando il m. è in polvere fine o in nastri; se in pezzi di un certo spessore e ampia area, la combustione si mantiene con difficoltà poiché mentre il metallo conduce facilmente il calore, lo strato di ossido lo conduce difficilmente; per la stessa ragione la saldatura autogena si deve fare in ambiente di gas inerte così da impedire la formazione dell’ossido.
Preparazione
Per la preparazione del m. si hanno diversi metodi di riduzione sia elettrolitica sia termica.
Processi elettrolitici
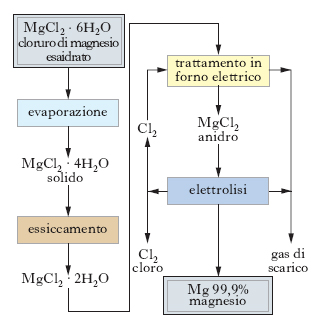
I processi elettrolitici (v. fig.) partono da cloruro di m. che può anche essere ottenuto direttamente dall’acqua di mare o dalle acque madri delle saline. In questo caso all’acqua di mare (filtrata e addizionata di piccole percentuali di cloro per evitare la crescita di alghe) si aggiunge idrossido di calcio (per es., ottenuto per calcinazione di gusci di conchiglie), ottenendosi così la precipitazione dell’idrossido di m.; un altro agente precipitante usato è la dolomite calcinata: in tal modo circa il 50% del m. proviene dall’acqua di mare, la parte restante dal minerale. La precipitazione dell’idrossido di m. viene effettuata in sedimentatori-ispessitori di grandi dimensioni controllando accuratamente il dosaggio dell’agente precipitante in modo da impedire l’adsorbimento di composti del boro da parte del precipitato con conseguente notevole diminuzione dell’efficienza di corrente durante l’elettrolisi. Per migliorare le caratteristiche di sedimentabilità e di filtrabilità dell’idrossido di m. si ricorre talvolta all’addizione di agenti flocculanti, a scapito però della purezza del prodotto finale. I fanghi in uscita dagli ispessitori hanno una concentrazione in Mg(OH)2 variabile fra il 10 e il 15%, subiscono dapprima un lavaggio con acqua dolce per eliminare le impurezze solubili e sono poi sottoposti a filtrazione sotto vuoto. I pannelli così ottenuti (25-50% in Mg(OH)2) vengono trattati con acido cloridrico per la conversione in cloruro di m. esaidrato; questo deve essere poi disidratato prima per evaporazione della soluzione di partenza, poi per essiccamento in un forno rotativo e infine per trattamento in forno elettrico in corrente di cloro. La disidratazione del cloruro di m., necessaria per la produzione di m. per via elettrolitica, presenta alcune difficoltà connesse soprattutto al pericolo di una concomitante formazione di idrossicloruri.
Sono stati sperimentati anche altri metodi di recupero del m. dall’acqua di mare (idrolisi diretta, evaporazione solare per la precipitazione diretta del cloruro ecc.), ma nessuno sembra competitivo rispetto alla precipitazione con la calce. Al cloruro, comunque ottenuto, si addizionano cloruro di calcio (25-35%) e cloruro di sodio o di potassio (40-50%), e la miscela risultante costituisce l’elettrolito che, una volta fuso, è mantenuto a 700-750 °C; l’acqua ancora presente nel cloruro di m. evapora istantaneamente e senza difficoltà. L’elettrolisi si compie in celle formate da cassoni metallici rivestiti internamente di refrattario, chiusi a tenuta da un coperchio; le pareti della cassa agiscono da catodo, mentre l’anodo è formato da barre verticali di grafite fissate al coperchio; durante l’elettrolisi si produce cloro gassoso e m. puro, che, essendo più leggero del bagno, viene in superficie: di qui è prelevato e versato in lingottiere; ha una purezza che può arrivare anche al 99,9%. La produzione di ciascuna cella può raggiungere 500 kg di m. al giorno, con consumi di energia elettrica di 18-20 kWh/kg di metallo prodotto. Si hanno anche processi di elettrolisi che partono da ossido di m., mescolato con coke in polvere e foggiato in granuli, i quali vengono trattati con cloro a circa 1100 °C; il cloruro di m. fuso che si forma dalla reazione MgO+C+Cl2 ⇄ MgCl2+CO alimenta direttamente le celle insieme a cloruri di altri metalli, che assicurano stabilità e buona conduttività.
Processi basati sulla riduzione termica
L’ossido di m. viene ridotto a metallo da un riducente che deve vincere la forte affinità che il m. ha per l’ossigeno e che può essere costituito da idrogeno, da carbone, da silicio (più economica riesce una lega ferro-silicio al 70-80% circa di quest’ultimo), da alluminio, da carburo di calcio ecc. Il riducente più diffuso è la ferrolega, che si mescola intimamente con la dolomite calcinata e s’introduce in storte speciali nelle quali il riscaldamento, a temperatura strettamente controllata, si ottiene per irraggiamento mediante resistori elettrici posti all’interno. Durante il funzionamento le storte sono mantenute in depressione molto spinta. In seguito alla reazione 2CaO•MgO+FexSi ⇄ 2Mg+(CaO)2•SiO2+xFe, si sviluppano vapori di m., che attraversano filtri a letto di dolomite granulare e vanno poi in camere di condensazione, fredde, in fondo alle quali è posto un crogiolo da cui periodicamente si spilla il m. raccolto.
Il processo di riduzione termica può anche avvenire in speciali forni elettrici ad arco in cui è possibile raggiungere temperature di regime di oltre 1500 °C e dove la reazione fra la dolomite calcinata e la ferrolega è fatta avvenire in presenza di allumina: si ottiene in tal modo, oltre allo sviluppo di vapori di m., anche la completa fusione dei residui e il loro facile allontanamento, come scoria liquida, attraverso un canale di colata posto sul fondo del forno.
In Italia è stato messo a punto anche un procedimento termico (processo Amati-Ravelli) in cui il riempimento delle storte, di grande capacità, avviene sovrapponendo alternativamente strati di carica (bricchette di dolomite calcinata e di ferrolega) con dischi metallici che agiscono da resistenze elettriche e che permettono di riscaldare direttamente la carica a 1200 °C. I vapori di m. che si sviluppano vanno a condensare sulle pareti fredde di campane che chiudono, a perfetta tenuta di vuoto, le estremità superiori delle storte.
Impiego e produzione
Il m. si usa come disossidante di alcuni metalli e leghe (nichel, argento, bronzi ecc.), nella preparazione di composti organici (in particolare, dei sali di alchilmagnesio, detti anche reattivi di Grignard (➔ Grignard, Victor), in alcune metallurgie speciali (titanio, berillio ecc.), nella preparazione di leghe caratterizzate da elevate caratteristiche meccaniche e da buona resistenza alla corrosione. Sono costituiti da m. gli elettrodi usati per la protezione catodica dalla corrosione in impianti interrati, cisterne e in molti elettrodomestici. Le buone proprietà di resistenza all’attacco chimico e all’usura fanno del m. un metallo adatto alla fotoincisione.
Il maggiore produttore mondiale di m. è la Cina, con 526.000 t (2006); in Italia la produzione, pur se in calo, supera il fabbisogno interno.
Biologia
Il m. svolge una funzione biochimica essenziale come costituente della clorofilla e come cofattore per l’attività catalitica di numerosi enzimi. Negli animali rappresenta lo 0,05% della massa corporea, di questo il 60% si trova nello scheletro. A livello cellulare consente le reazioni enzimatiche che determinano la rottura degli esteri fosforici e il trasferimento di gruppi fosforici. Ioni Mg++ sono indispensabili per l’attività delle fosfatasi e per permettere le reazioni di fosforilazione che coinvolgono l’ATP, per es. l’esochinasi, la piruvatodeidrogenasi, la fosfofruttochinasi. In quanto legato all’utilizzazione dell’ATP, il m. esplica una funzione importante in molti processi metabolici, come la sintesi delle proteine, dei grassi, degli acidi nucleici e nell’incamerare e utilizzare l’energia derivante dal catabolismo di grassi e carboidrati.
La carenza del m. provoca una tetania, dovuta a un’alterazione della trasmissione neuromuscolare. Gli ioni m. sono farmacologicamente attivi nel deprimere il sistema nervoso centrale e periferico. Questi effetti sono controbilanciati dall’azione del calcio.
Farmaceutica
Il carbonato, l’ossido, il silicato di m. sono impiegati per uso esterno, aspersorio. Assunti per bocca, i vari sali di m. non vengono assorbiti dal tubo digerente e determinano, con meccanismo osmotico, azione purgativa, lassativa o colagoga a seconda delle dosi.
Il nome magnesia, sinonimo di ossido di m., o MgO, ricorre in alcune espressioni, in parte disusate, come magnesia leggera (o calcinata o decarbonata), ossido di m., nella forma di massa rigonfia, proveniente dalla decomposizione termica del carbonato di m., MgCO3 (da non confondersi con la magnesia alba, carbonato basico di magnesio). Magnesia pesante o usta è l’ossido di m., nella forma di massa compatta, derivante dall’ulteriore calcinazione della magnesia leggera. Latte (o magma) di magnesia è una sospensione di idrossido di m. in veicolo acquoso, usata in medicina per la cura di disturbi gastrici (acidità).