cloro
Elemento chimico del gruppo degli alogeni, scoperto da K. W. Scheele nel 1774 e isolato da H. Davy nel 1810; simbolo Cl, numero atomico 17, peso atomico 35,457; sono noti due isotopi stabili 3517Cl e 317Cl presenti in natura nel rapporto all’incirca di 3:1.
Caratteristiche
Il c. è un gas giallo verdastro, di odore soffocante che si liquefa a 15 °C, alla pressione di 6 bar; esso bolle a −34 °C, a pressione atmosferica e solidifica a −101 °C; la densità relativa all’aria è 2,49. È solubile nell’acqua: a 15 °C un litro d’acqua scioglie 2,5 volumi di c.; questa soluzione, verdastra, costituisce l’ acqua di c.; una parte del c. presente reagisce con l’acqua formando gli acidi cloridrico e ipocloroso; quest’ultimo poi sotto l’azione della luce si decompone dando acido cloridrico e ossigeno. Il c. è monovalente rispetto all’idrogeno e ai metalli; verso l’ossigeno si comporta da mono-, tri-, tetra-, penta- ed eptavalente e talvolta da esavalente; è trivalente nel composto interalogenico ClF3. È molto reattivo e si combina direttamente con tutti gli elementi a eccezione dell’azoto, del carbonio, dell’ossigeno e dei gas rari. All’oscuro o alla luce diffusa il c. reagisce lentamente con l’idrogeno formando acido cloridrico, ma per riscaldamento o in presenza di luce intensa la reazione diventa esplosiva. Il c. sposta lo iodio e il bromo dalle loro combinazioni binarie.
Produzione
Il c. non si trova mai libero, salvo in qualche emanazione vulcanica; è molto diffuso allo stato di cloruro, specialmente come cloruro di sodio, di potassio e di magnesio, che si trovano disciolti nelle acque del mare e allo stato solido in diversi depositi terrestri, alcuni dei quali molto ricchi (per lo più derivati dalla lenta evaporazione di acque marine). Nel passato il c. veniva preparato industrialmente secondo i processi Weldon e Deacon. Il primo consiste nell’ossidazione dell’acido cloridrico con il biossido di manganese secondo la reazione:
MnO2 + 4HCl ⇆ MnCl2 + Cl2 + 2H2O.
Il processo Deacon è basato sull’ossidazione dell’acido cloridrico con l’ossigeno dell’aria alla temperatura di 400 °C e in presenza di un catalizzatore costituito da argilla imbevuta con una soluzione di cloruro e di solfato rameico. Attualmente il c. si ottiene, con la soda, tramite elettrolisi delle soluzioni dei cloruri alcalini ( industria c.-soda). Nell’elettrolisi di una soluzione acquosa, per es., di cloruro di sodio, il c. si raccoglie all’anodo, di solito di grafite, mentre al catodo si forma l’idrossido alcalino e si libera l’idrogeno; i due elettrodi devono essere mantenuti separati per evitare reazioni secondarie che porterebbero alla formazione di altri prodotti (ipocloriti ecc.). Per l’elettrolisi si usano celle a diaframma o a catodo di mercurio. Nelle celle a diaframma si usano numerosi artifici per realizzare una zona catodica e una anodica separate; di solito s’interpone fra gli elettrodi un diaframma (tela di amianto, lamiere metalliche finemente bucherellate ecc.) che, senza impedire il passaggio della corrente, evita o limita il diffondere dei prodotti sia gassosi sia in soluzione; in queste celle s’impiega una tensione di 3,2-3,5 V, si ha un rendimento di corrente del 90-93% e si ottiene una soluzione di idrossido di sodio diluita (10-12%), impura per cloruro di sodio.
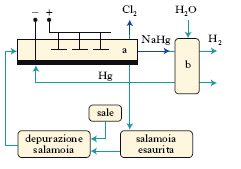
Le celle a catodo di mercurio (v. fig.) risultano divise in due parti distinte: elettrolizzatore a e decompositore b; il primo è formato da una lunga vasca leggermente inclinata, sul fondo della quale scorre un sottile strato di mercurio che funziona da catodo; la soluzione (salamoia) di cloruro di sodio depurata, alimentata con continuità, viene decomposta: in corrispondenza dell’anodo si sviluppa c. mentre il sodio al catodo è fissato dal mercurio con formazione di un amalgama. Questo, portato nel decompositore, costituito da un cilindro ripieno di pezzi di grafite irrorati da una pioggia d’acqua pura, si decompone secondo la reazione:
NaHg + H2O ⇆ NaOH + 1/2H2 + Hg
formando idrossido sodico e idrogeno e mettendo in libertà il mercurio che ritorna in ciclo. I problemi di inquinamento ambientale hanno indotto, nei tempi recenti, a rivalutare l’impiego delle celle a diaframma.
I principali prodotti industriali contenenti c. sono i polimeri clorurati (PVC ecc.), i solventi clorurati (percloroetilene, tricloroetilene ecc.), le paraffine clorurate, i clorobenzeni, l’ipoclorito di sodio ecc. Numerosi composti del c. sono caratterizzati da energica azione ossidante.
Aspetti biomedici
Il c. ha notevole importanza biologica: è presente in tutti gli organismi animali e vegetali, sotto forma inorganica come cloruro e acido cloridrico, e partecipa a importantissime funzioni, come la regolazione della pressione osmotica, del ricambio dell’acqua ecc.; nell’uomo, inoltre, anche alla sudorazione, uno dei meccanismi della termoregolazione, e, come acido cloridrico nello stomaco, alla sterilizzazione e alla digestione gastrica degli alimenti.
Composti
Acido clorico (HClO3) Si prepara trattando una soluzione di clorato di bario con acido solforico diluito. Non è noto allo stato libero, ma soltanto nelle sue soluzioni di concentrazione inferiore al 40%, oltre la quale si ha decomposizione in biossido di c. e acido perclorico. La soluzione acquosa di acido clorico è inodore e incolore, si comporta da acido molto forte e possiede energiche proprietà ossidanti.
Biossido di c. Composto del c. tetravalente con ossigeno, ClO2; gas giallo, di odore sgradevole e irritante, che a freddo condensa in un liquido rosso bruno che bolle a 10 °C e solidifica a −59 °C in una massa di color arancio, cristallina. Si ottiene per azione dell’acido solforico sul clorato di potassio (o dell’acido cloridrico sul clorato di calcio ecc.); prima si forma acido clorico, che poi si decompone dando biossido di c.; si prepara anche per azione del c. sul clorito di sodio. Si scioglie facilmente in acqua e reagisce con gli idrossidi alcalini formando una miscela di clorito e di clorato; per questo il biossido di c. si chiama anche anidride cloroso-clorica. È usato come sbiancante della cellulosa e delle paste per carta, nell’industria dei grassi, degli oli, delle farine, come sterilizzante e battericida per l’acqua ecc.