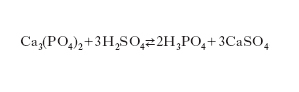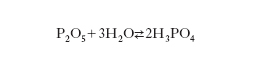fosforo
Elemento chimico di numero atomico 15, peso atomico 30,98, di cui sono noti un isotopo stabile (di massa atomica 31) e 6 radioattivi, dei quali il più importante è quello di massa atomica 32, con vita media di circa 14 giorni.
Generalità
Non si trova libero in natura, per la sua tendenza a reagire con l’ossigeno, bensì combinato nei fosfati minerali ( fosforiti), nelle ossa degli animali, in composti organici. Fu scoperto (1669) dall’alchimista tedesco H. Brand per distillazione, fuori del contatto dell’aria e in presenza di sabbia silicea, del residuo dell’evaporazione delle urine. Il nome, derivante dal gr. ϕωσϕόρος «portatore di luce», gli fu attribuito per la proprietà di emettere radiazioni luminose per chemiluminescenza.
Il f. esiste in diverse forme allotropiche contraddistinte da differenti proprietà chimiche e fisiche. Il f. comune, detto giallo o bianco, è un solido bianco, ceroso, di densità 1,82 g/cm3, che fonde a 44 °C dando un liquido limpido e incolore; bolle a 280 °C, è insolubile nell’acqua, solubile nei solventi organici in genere; per riscaldamento fuori del contatto dell’aria a 250-300 °C si trasforma nel f. rosso, di densità 2,1-2,3 g/cm3, costituito da più modificazioni. Il f. nero si ottiene pure da quello giallo per riscaldamento sotto elevatissime pressioni; ha aspetto grigio metallico, densità elevata (2,70 g/cm3), bassa solubilità. Il f. bianco è la varietà più reattiva, si combina con quasi tutti gli elementi, separa molti metalli dai loro sali, si accende all’aria già a circa 40 °C bruciando con intenso sviluppo di luce e di calore e formando l’anidride fosforica, P2O5; si conserva sotto acqua; è fortemente velenoso. Il f. rosso è più stabile, si accende verso i 44 °C, ha reattività chimica molto minore, non è velenoso.
Preparazione e impieghi
Il f. si ottiene industrialmente mediante il processo di riduzione delle fosforiti: 2Ca3(PO4)2+6SiO2+10C⇄6CaSiO3+10CO+P4, cioè riscaldando intorno a 1400 °C un miscuglio di fosforite, sabbia silicea e coke in un forno elettrico costituito in genere da un involucro metallico rivestito internamente di refrattario, avente una suola di carbone ed elettrodi verticali di grafite raffreddati con acqua. Il coke impiegato deve essere privo di polveri e contenere la minima quantità possibile di ceneri e di umidità; anche gli altri componenti della carica devono essere esenti da polveri e da umidità: le polveri, infatti, possono in parte essere trascinate nel gas che esce dal forno, mentre l’umidità può promuovere l’ossidazione del f. gassoso ad anidride fosforica, P2O5. In genere, è necessario sottoporre la fosforite e la silice a un trattamento preventivo di agglomerazione termica, in cui i minerali sono portati a una temperatura tale da dar luogo a una fusione superficiale. Dal forno si ottiene una massa fusa, costituita da una scoria, a base prevalentemente di silicato di calcio e prodotti gassosi, costituiti da ossido di carbonio, vapori di f. e piccole quantità di varie impurezze (fluoruro di silicio, polveri ecc.). Da questi gas, per raffreddamento e lavaggio con acqua, si condensa il f., mentre l’ossido di carbonio separato si utilizza come combustibile o per sintesi organiche. Il f. allo stato fuso viene lasciato riposare in serbatoi, così da privarlo delle impurezze solide che lo accompagnano. Il f. bianco che così si ottiene, riscaldato gradualmente in presenza di catalizzatori (iodio ecc.) in recipienti di ferro, si converte nella varietà rossa.
Il f. si usa per preparare anidride e acido fosforico (quest’ultimo usato nella preparazione dei fosfati) e anche altri composti tra cui, importanti, i solfuri, gli alogenuri, gli ossidi, i fosfuri metallici; entra inoltre nella composizione di alcune leghe (con ferro, con rame ecc.) usate in metallurgia. Il f. si usa anche nella fabbricazione dei fiammiferi, in pirotecnica, nell’allestimento di artifici fumogeni e incendiari.
Aspetti medici
Il f. contenuto nel sangue ( fosforemia) viene distinto in una frazione inorganica, costituita da orto- e pirofosfati e una frazione organica, costituita da acido fosforico legato a proteine, glicidi, lipidi e nucleotidi.
Il fosforismo è l’avvelenamento cronico da f. o da composti contenenti f., la fosfonecrosi è la necrosi caratteristica del mascellare nei lavoratori esposti ai vapori di f., in locali poco ventilati; è dovuta all’azione tossica dei vapori del f. bianco; si sviluppa in genere da una carie dentaria con infiammazione alveolo-gengivale e ulcerazioni necrotiche che si approfondano al periostio e all’osso.
Acido fosforico e acido fosforoso
L’ acido fosforico (o ortofosforico) è un acido tribasico, H3PO4; allo stato puro si presenta come un solido bianco, cristallino, che fonde a circa 41 °C dando un liquido sciropposo. Si trova in natura sotto forma di fosfati e di fosfolipidi. Si prepara industrialmente per via umida o per via termica. Il metodo per via umida consiste nel trattare il fosfato tricalcico, Ca3(PO4)2, con acido solforico, secondo la reazione:
Poiché si opera con acido solforico non anidro si ottiene una soluzione di acido fosforico che può essere separata (per filtrazione o per decantazione) dal solfato di calcio precipitato e usata tale e quale (per preparare fertilizzanti) o depurata e concentrata. Il metodo per via termica consiste nella riduzione delle fosforiti al forno elettrico e nella successiva ossidazione ad anidride fosforica che, trattata con la quantità stechiometrica di acqua, dà acido fosforico:
Il consumo di energia richiesto dal metodo per via termica può essere notevolmente diminuito facendo avvenire la riduzione delle fosforiti (endotermica) e l’ossidazione del f. (esotermica) nello stesso ambiente di reazione così da realizzare una parziale compensazione degli effetti termici. Il metodo per via umida, pur dando luogo a un acido fosforico molto più diluito e per di più inquinato da ferro, calcio, alluminio e altre sostanze estranee, è più impiegato del metodo per via termica sia perché è notevolmente meno costoso sia perché, per la preparazione dei fertilizzanti fosfatici che rappresenta l’impiego più esteso dell’acido fosforico, non richiede una purezza particolare dell’acido stesso. L’acido fosforico si può anche ottenere, su piccola scala, per azione dell’acido nitrico sul fosforo.
Tutti e tre gli atomi d’idrogeno dell’acido fosforico sono sostituibili con metalli e quindi si possono ottenere sali acidi (fosfati primari e secondari) o neutri (fosfati terziari). L’acido fosforico attacca quasi tutti i metalli, specie a caldo; al di sopra di 200 °C perde acqua trasformandosi in acido pirofosforico (H4P2O7) che per ulteriore riscaldamento si trasforma in acido metafosforico (HPO3).
L’acido fosforico è usato nella preparazione di fertilizzanti fosfatici (fosfati di calcio e di ammonio), di pirofosfati e di polifosfati, nella preparazione di bevande (diluito notevolmente ha sapore acidulo gradevole ed è ben tollerato dallo stomaco), nell’industria tessile (per mordenti, per ravvivare colori ecc.), come opacizzante nella fabbricazione del vetro, come catalizzatore. È inoltre usato per la fosfatazione, trattamento superficiale eseguito su materiali metallici (ferro, zinco, alluminio e loro leghe) immergendo i pezzi da trattare (preventivamente preparati, decapati ecc.) in bagni contenenti acido fosforico (meglio se addizionato di acceleranti, stabilizzanti ecc.). Si forma un velo più o meno sottile di fosfato insolubile che costituisce un efficace strato protettivo e, ancor più, un solido ancoraggio e sottofondo per successivi trattamenti di verniciatura.
L’ acido fosforoso è un acido dibasico del f. H3PO3; solo due degli idrogeni sono acidi in quanto uno è legato direttamente al f.; masse cristalline bianche o giallastre, igroscopiche, che fondono a 70 °C e si decompongono a circa 200 °C. Si ottiene idrolizzando il tricloruro di f.; si usa come agente riducente. Oltre all’acido precedente (detto pure orto-fosforoso) esistono anche l’acido piro-fosforoso, H4P2O5, e l’acido ipo-fosforoso (H3PO2)2.
Fosfuri
I fosfuri sono composti chimici risultanti dalla diretta combinazione del f. con un elemento più elettropositivo. Quelli dei metalli alcalini e alcalinoterrosi (e d’alluminio) si possono formare per sostituzione di uno o più atomi di idrogeno della fosfina (PH3) con i relativi elementi e si idrolizzano (rigenerando PH3) per trattamento con acidi diluiti o con acqua. Con il ferro, rame e zinco si originano vere leghe di f., con caratteristiche simili a quelle dei composti intermetallici; alcuni di tali fosfuri (per es. il fosfuro di rame) trovano impiego in metallurgia come disossidanti; il fosfuro. di zinco è usato in medicina e come topicida.