imaging
Modalità di formazione delle immagini biomediche utilizzate a scopo diagnostico e, in alcuni casi, terapeutico. L’i. comprende la radiologia, sia convenzionale sia digitale, la tomografia computerizzata (TC), l’ecografia, la risonanza magnetica nucleare (RMN), le procedure terapeutico-radiologiche guidate dalle stesse modalità che vanno sotto il nome di radiologia interventistica (per es., la coronarografia), nonché la medicina nucleare (PET, SPET).
Abstract di approfondimento da Imaging diagnostico computerizzato di Arturo Brunetti e Marco Salvatore (Enciclopedia della Scienza e della Tecnica)
Imaging e programmazione della terapia
I dati di imaging sono utilizzati per guidare biopsie, per posizionare correttamente cateteri, protesi vascolari e altri impianti e per programmare e guidare approcci terapeutici di diverso tipo.
L’imaging diagnostico computerizzato dà un supporto fondamentale alla radioterapia e alla chirurgia. Uno degli obiettivi della chirurgia assistita dal computer è la realizzazione di una guida intraoperatoria completa con l’utilizzazione di sistemi robotizzati in cui la funzione dell’operatore diventa di supervisione e controllo.
Chirurgia e radiologia interventistica
La visualizzazione 3D offre al chirurgo un’anteprima dell’area di intervento e dei percorsi di accesso, con una visualizzazione dettagliata e interattivamente modificabile. La visualizzazione di punti di riferimento anatomici e soprattutto dei vasi sanguigni ha grande importanza per programmare l’approccio chirurgico, e con la navigazione virtuale si possono provare percorsi alternativi. Oltre alla valutazione preoperatoria si stanno sviluppando sistemi dedicati all’imaging in sala operatoria per migliorare la coordinazione della procedura con la corretta localizzazione delle lesioni e la definizione dei margini, consentendo, per esempio, resezioni complete e accurate dei tumori.
Tra le tecniche utilizzabili per esami intraoperatori, la radioscopia ha un ruolo storicamente importante in chirurgia ortopedica, per il posizionamento dei cateteri e per procedure interventistiche endovascolari (posizionamento di stent, impianti, embolizzazioni). L’ecografia intraoperatoria è particolarmente interessante per la non invasività e l’agevole uso in chirurgia addominale (per es., in chirurgia epatica) anche per le piccole dimensioni dello strumento. In ambito medico-nucleare rientra la chirurgia guidata da rilevatori portatili (sonde) di radiazioni utilizzata soprattutto in chirurgia oncologica addominale per localizzare lesioni non visibili in superficie.
Per l’eccellente valutazione 3D e l’elevato contrasto e risoluzione spaziale, c’è grande interesse per la RM come strumento di supporto intraoperatorio. Sono oggi disponibili magneti a configurazione aperta, che consentono un agevole accesso al paziente e sono dotati di sistemi di tracciamento degli strumenti chirurgici. Con queste apparecchiature avanzate, è possibile eseguire biopsie guidate, procedure percutanee o endoscopiche oppure operazioni chirurgiche a cielo aperto e procedure interventistiche quali l’ablazione termica. L’alto costo di questi apparecchi ne ha limitato finora la diffusione.
Una guida intraoperatoria completa richiede una mappatura in tempo reale delle coordinate effettive del paziente con i dati delle immagini di riferimento. La registrazione immagine-paziente e gli strumenti di tracciamento all’interno dell’area di intervento sono elementi chiave per il controllo interattivo di un’operazione chirurgica attraverso una procedura di navigazione computer-assistita. Per gli interventi neurochirurgici guidati, così come per la radioterapia, è possibile utilizzare dati acquisiti in precedenza, servendosi di marcatori (markers) esterni collegati al paziente oppure utilizzare immagini registrate rispetto a determinati riferimenti anatomici. La seconda opzione, più impegnativa per i computer, è in genere la più valida. Un monitoraggio intraoperatorio con videocamere può essere utilizzato per identificare i marcatori superficiali esposti (orecchio, naso, corteccia cerebrale) da associare ai punti corrispondenti nelle immagini.
La coregistrazione con dati funzionali ottenuti mediante SPECT, PET, MRS e/o fMRI, può aggiungere ulteriori dati utili all’esecuzione dell’intervento chirurgico
La diffusione delle procedure basate su computer oltre a ridurre la durata degli interventi e l’insorgenza di complicanze, influenza direttamente le strategie terapeutiche e gli approcci chirurgici.
Radioterapia
La programmazione della radioterapia dipende strettamente dalle immagini diagnostiche per l’individuazione delle strutture da trattare e dei tessuti sani circostanti che devono essere risparmiati dalle radiazioni.
Le prime applicazioni della radioterapia si basavano solo sui dati clinici e sulla valutazione dell’anatomia di superficie. Sono stati poi utilizzati simulatori di trattamento che utilizzavano raggi X per ottenere immagini dell’area da trattare, simulando l’operazione dell’apparecchio di radioterapia, senza supporto informatico. Poi, la TC ha rivoluzionato la radioterapia, con lo sviluppo di sistemi informatizzati per programmare il trattamento sulla base di modelli 3D e di software che forniscono calcoli dosimetrici accurati con algoritmi appositi ed elaborazioni ad alta velocità indispensabili per eseguire l’enorme numero di operazioni necessarie per confrontare diverse opzioni di trattamento.
Anche per la radioterapia è utile l’integrazione di dati ottenuti con diverse modalità di imaging. Per il trattamento dei tumori, per esempio, la fusione dei dati TC e RM migliora notevolmente sia l’individuazione del bersaglio sia i calcoli dosimetrici. In prospettiva, la fusione di informazioni funzionali e metaboliche ottenute con SPECT e PET, insieme ai dati morfologici forniti dalla TC e dalla RM amplieranno ulteriormente la possibilità di focalizzare il fascio di radiazioni sui bersagli metabolicamente più attivi, potenziando al massimo i risultati terapeutici e limitando gli effetti dannosi collaterali ai tessuti normali, utilizzando anche sistemi di controllo dei movimenti (imaging 4D).
Abstract di approfondimento da Imaging diagnostico computerizzato. Neuroimaging di Valeria Cozzolino, Roberto Floris e Orazio Schillaci (Enciclopedia della Scienza e della Tecnica)
Le tecniche di diagnostica per immagini del sistema nervoso comprendono sia l’imaging morfologico come la tomografia computerizzata (TC) e la risonanza magnetica (RM) che permettono di valutare la struttura cerebrale, sia gli studi funzionali come la PET (Positron emission tomography), la SPECT (Single photon emission computed tomography) e la fMRI (Functional magnetic resonance imaging) che visualizzano l’attività cerebrale. Negli ultimi decenni si è assistito a un enorme sviluppo delle tecniche di neuroimaging: ciò ha consentito di intraprendere lo studio in vivo del cervello sia per migliorare la comprensione degli aspetti funzionali, sia per analizzare con il miglior dettaglio possibile le alterazioni che si verificano nelle patologie neurologiche, con il fine ultimo di sviluppare nuove ed efficaci strategie terapeutiche.
La TC è stata la prima di queste tecniche a essere utilizzata nello studio del cervello, già negli anni Settanta del XX sec. Essa sfrutta le radiazioni ionizzanti per produrre immagini di sezioni corporee. Attualmente è impiegata principalmente nelle emergenze cliniche che riguardano il cranio e l’encefalo, negli studi vascolari del circolo cerebrale e nella valutazione dello stadio di progressione dei tumori.
La RM è la principale tecnica di studio del cervello consentendo un’eccellente valutazione morfologica grazie all’elevata risoluzione di contrasto e una valutazione funzionale grazie alle nuove tecniche RM quali la fMRI. Essa non utilizza radiazioni ionizzanti ma un campo magnetico statico e onde di radiofrequenza per produrre immagini in tutti i piani dello spazio. È la tecnica più indicata per lo studio delle patologie del sistema nervoso centrale, dalle anomalie di sviluppo alle patologie acquisite neoplastiche, vascolari, infettive, degenerative, post-traumatiche e da coinvolgimento del cervello in corso di patologie sistemiche. Un notevole impatto clinico lo ha avuto l’applicazione della RM in regime d’urgenza, con tecniche di diffusione e perfusione per la valutazione dell’ictus cerebrale ischemico: ciò consente l’attuazione immediata di terapie specifiche per limitare i danni neurologici.
Le tecniche di medicina nucleare sono state, fino allo sviluppo della fMRI, le uniche in grado di fornire immagini rappresentative della funzione cerebrale, ovvero che rendevano possibile individuare spazialmente determinati processi fisiologici e patologici. Le metodiche utilizzate in campo neurologico sono la SPECT e la PET.
La SPECT cerebrale viene eseguita somministrando al paziente un radiofarmaco marcato con isotopi emettenti radiazioni g, mentre la PET è basata sulla somministrazione di radiofarmaci marcati con radionuclidi emettenti positroni (b1). Con queste metodiche si producono immagini che riflettono la distribuzione all’interno dell’organismo del tracciante, consentendo pertanto d’identificare le aree in cui avvengono determinati processi. Queste tecniche trovano applicazione principalmente nella patologia vascolare, la patologia neoplastica e quella neuro-degenerativa.
Nel corso degli ultimi due decenni le tecniche di neuroimaging – sia di tipo morfologico come la TC e la RM che permettono di valutare la struttura cerebrale, sia di tipo funzionale come la PET, la SPECT e la fMRI che visualizzano l’attività cerebrale – sono andate incontro a una tumultuosa evoluzione, anche grazie al miglioramento degli strumenti informatici che consentono l’elaborazione grafica dei dati ottenuti. I recenti sviluppi tecnologici hanno reso possibile lo studio del sistema nervoso, in particolare lo studio in vivo del cervello, con la finalità di comprendere la relazione intercorrente tra specifiche aree cerebrali e le funzioni da esse svolte, localizzare le aree coinvolte nelle patologie neurologiche, e infine sviluppare nuove strategie terapeutiche per trattare tale categoria di malattie.
L’interesse verso le neuroscienze e le tecnologie di neuroimaging è legato anche all’impatto che le malattie che colpiscono il sistema nervoso hanno sulla salute pubblica: le malattie del sistema nervoso rappresentano una delle principali cause di ospedalizzazione; gli ictus sono la terza (la seconda, stando ad alcune stime) causa di morte dopo le malattie cardiovascolari e le neoplasie, essendo responsabili del 10412% di tutti i decessi per anno. L’aumento dell’aspettativa di vita media e l’invecchiamento della popolazione, inoltre, con il conseguente incremento di incidenza e prevalenza delle malattie neurodegenerative, costituisce un altro motivo d’interesse da un punto di vista sanitario.
Tecniche di medicina nucleare
L’imaging medico-nucleare ha come scopo lo studio di processi metabolico-biochimici e fisiologici in vivo mediante la somministrazione di un appropriato radiofarmaco, denominato tracciante, e costituito da una molecola biologicamente attiva legata a un isotopo radioattivo. Le immagini ottenute riproducono la distribuzione all’interno dell’organismo del tracciante, consentendo pertanto di identificare le aree in cui avvengono determinati processi fisiologici.
Il tracciante è un composto scelto in base al tipo di processo biochimico di interesse, e marcato con un radionuclide; quest’ultimo in seguito al decadimento radioattivo può essere fotone emittente o positrone emittente. La radiazione emergente dal paziente è poi rivelata da apparecchiature dedicate. Le metodiche utilizzate in campo neurologico sono la SPECT e la PET.
SPECT
La SPECT cerebrale viene eseguita somministrando al paziente un radiofarmaco: gli isotopi più impiegati in neurologia sono il 99mTc e lo 123I, che emettono radiazioni g, rivelate dalla gammacamera che in seguito produce un’immagine della distribuzione del radiofarmaco all’interno del paziente. Un limite generale delle immagini di medicina nucleare è quello dalla scarsa informazione anatomica. A tal proposito sono stati messi a punto dei software in grado di coregistrare e correlare le immagini di medicina nucleare con quelle provenienti da altre modalità, come la RM e la TC, che forniscono un dettaglio anatomico eccellente. Di recente sono state sviluppate macchine ibride SPECT/TC che consentono insieme l’acquisizione di immagini funzionali (SPECT) e morfologiche (TC), che sono poi fuse insieme per formare una mappa anatomica dei dati funzionali, con una migliore accuratezza dello studio.
PET
La PET è una metodica di imaging basata sulla somministrazione di radiofarmaci marcati con radionuclidi emettenti positroni (b1), prodotti da acceleratori di particelle (ciclotroni).
Il radioisotopo più comune è il 18F che viene utilizzato per la produzione del 318F4-fluorodesossiglucosio(FDG), il radiofarmaco più usato nella clinica; in ambito neurologico vengono impiegati anche altri radioisotopi come il 11C e il 15O.
Una volta emesso all’interno del paziente, il positrone percorre una breve distanza all’interno dei tessuti (per es., distanza media percorsa dai positroni del 18F in acqua è ca. 1 mm), interagisce con un elettrone e va incontro al processo di annichilazione: le masse delle due particelle scompaiono e al loro posto vengono generati due raggi g da 511 keV emessi in direzione opposte. Se i due raggi g vengono rivelati simultaneamente (entro un intervallo di tempo chiamato finestra temporale di coincidenza) da due diversi rivelatori si ottiene una ‘rivelazione in coincidenza’.
I rivelatori nei tomografi PET sono disposti ad anello (full-ring scanner); più anelli sono connessi tra loro costituendo un campo di vista cilindrico (di ca. 15 cm), all’interno del quale viene posta la regione corporea da esaminare. L’acquisizione delle immagini può avvenire con due modalità: (a) 2D, in è permessa, cui con la presenza di setti di tungsteno o di piombo, una collimazione dei fotoni emergenti lungo la linea di rivelazione dei detettori contrapposti, all’interno di ciascun anello. Questo tipo di acquisizione determina una riduzione degli eventi scatter (raggio g che subisce una deviazione all’interno del paziente, non fornisce un’informazione corretta relativa alla posizione del decadimento), una maggior risoluzione spaziale e un minor tempo di ricostruzione, ma comporta una riduzione nel conteggio provocando quindi una minor sensibilità; (b) 3D, la cui applicazione eliminando i setti, permette di mostrare eventi anche tra rivelatori appartenenti ad anelli diversi aumentando l’efficienza di rivelazione, a scapito però di un incremento dello scatter e delle coincidenze casuali che determinano un peggioramento della qualità dell’immagine.
Nel caso delle PET cerebrali la modalità 3D garantisce complessivamente prestazioni superiori rispetto a quella 2D. Infatti, mentre da un lato si assiste all’incremento dell’efficienza di rilevazione, dall’altro il problema dello scatter e delle coincidenze casuali, date le dimensioni dell’organo in studio e dell’attività in esso presente, non è così rilevante come per altri distretti corporei.
La metodica PET, non richiedendo sistemi di collimazione per la determinazione della direzione di volo delle radiazioni, ha intrinsecamente un’efficienza di rivelazione di gran lunga superiore rispetto alla SPECT; inoltre, la risoluzione spaziale, cioè la capacità di distinguere due punti vicini tra loro, in PET (446 mm) è migliore rispetto a quella che si può raggiungere in SPECT.
Un’innovazione relativamente recente è costituita dalla PET-TC. Questa apparecchiatura combina un tomografo PET con una TC, consentendo di correlare l’eccellente dettaglio anatomico fornito dalla TC con l’informazione funzionale della PET e di migliorare la qualità delle immagini. Oggi i tomografi PET disponibili sul mercato sono tutti costituiti da macchine ibride PET/TC, che rappresentano pertanto, la standard tecnico di riferimento.
Ancora in fase sperimentale è la messa a punto di un tomografo PET/RM dedicato agli studi di imaging cerebrale, che rappresenterà sicuramente una novità molto interessante in questo campo.
Esistono diversi tipi di radiofarmaci. I traccianti di perfusione cerebrale si concentrano nel cervello in funzione delle variazioni, fisiologiche o patologiche, del flusso cerebrale regionale. Il flusso cerebrale è infatti considerato l’elemento macroscopico basilare della funzionalità neuronale in quanto fornisce i substrati per i processi metabolici. Una modificazione della normale funzione neuronale può derivare da una riduzione del flusso ematico cerebrale (come nella patologia cerebrovascolare) o essere espressione di una primitiva alterazione del neurone a cui consegue una riduzione delle richieste energetiche e quindi del flusso cerebrale (come nelle malattie degenerative o in alcune forme di epilessia).
La valutazione del flusso ematico cerebrale mediante SPECT ha luogo mediante l’iniezione endovena di 99mTc-esametil-propilene-amino-ossina (HMPAO) oppure di dietil-estere dell’etil-cisteinato (ECD). Questi radiofarmaci superano rapidamente la BEE in virtù della loro lipofilia, e si distribuiscono nel cervello in proporzione al flusso ematico; la molecola diffonde poi dallo spazio extracellulare a quello intracellulare dove viene intrappolata attraverso un meccanismo di tipo enzimatico. L’informazione è pertanto duplice flusso-dipendente e metabolica.
I traccianti gluco-metabolici sfruttano il fatto che il glucosio è il principale substrato metabolico del tessuto cerebrale e la sua completa ossidazione produce l’energia necessaria per un adeguato svolgimento dell’attività cerebrale. Pertanto, lo studio in vivo del metabolismo del glucosio consente di valutare non solo le modificazioni metaboliche indotte dall’attività neuronale ma anche le disfunzioni metaboliche causate da vari stati di malattia nonché gli effetti funzionali di strategie terapeutiche.
Il glucosio attraversa la BEE ed entra nelle cellule (neuroni e astrociti) dove viene metabolizzato per la produzione di energia. È noto da tempo che il consumo locale di glucosio è associato all’attività neuronale aumentando in modo proporzionale a essa.
Il tracciante per lo studio in vivo del metabolismo del glucosio è l’FDG che attraversa la BEE, entra nelle cellule come il glucosio, ma a differenza di quest’ultimo non viene metabolizzato, accumulandosi nel tessuto cerebrale per un tempo sufficientemente lungo per consentire l’acquisizione PET.
L’utilizzo di traccianti recettoriali prevede la marcatura con radionuclidi dei ligandi di specifici recettori. In questo modo è possibile caratterizzare i recettori: per es., è stato possibile distinguere i recettori D1 e D2 dopaminergici, i sottotipi di recettori serotoninergici e istaminergici; un loro ulteriore impiego in questo ambito è quello di valutare l’azione di farmaci attivi a livello di questi recettori.
I cosiddetti indicatori positivi sono invece radiofarmaci SPECT (99mTc sestamibi, 99mTc tetrofosmin, 123I-alfa-metil tiroxina) e PET (8FDG, 11C-colina, 11C-metionina) a tropismo tumorale che si accumulano preferenzialmente nelle lesioni neoplastiche.
Applicazioni cliniche
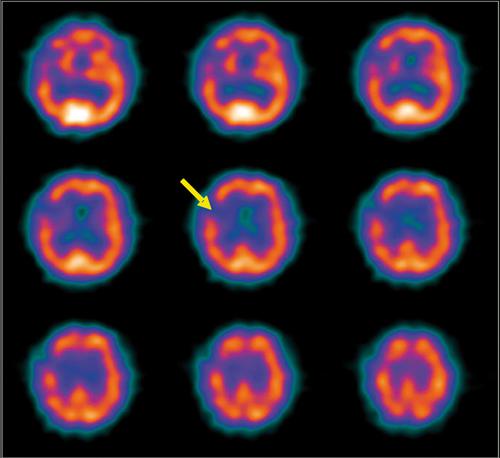
Nelle patologie cerebro-vascolari, gli studi SPECT perfusionali cerebrali eseguiti con i più comuni traccianti tecneziati (99mTc HMPAO e 99mTc ECD) descrivono direttamente la distribuzione tomografica attuale della perfusione cerebrale e offrono informazioni sullo stato metabolico energetico delle cellule nervose. Essi attraversano la BEE ed entrano nella cellula nervosa dove vengono trasformati, per cui rimangono intrappolati al loro interno. La distribuzione della perfusione ottenibile con questi traccianti necessita pertanto sia di un flusso tale da garantire un’adeguata pressione di perfusione sia della vitalità cellulare. Lo studio SPECT di perfusione consente quindi in modo diretto di valutare l’impatto tissutale di una caduta del flusso in termini perfusivo-metabolici cellulari, permettendo di distinguere le aree potenzialmente recuperabili da quelle ormai in evoluzione necrotica (fig.). Inoltre, in base alla distribuzione delle alterazioni rilevate è possibile stabilire il livello di ostruzione vascolare, e di differenziarle da quelle causate da altre patologie (per es., lesioni occupanti spazio o foci epilettici). La SPECT consente infine di identificare precocemente iperemie precoci da ricanalizzazione spontanea o farmaco-indotta, di valutare il recupero perfusionale o eventuali stati ipoperfusivi che sono importanti determinanti prognostici.
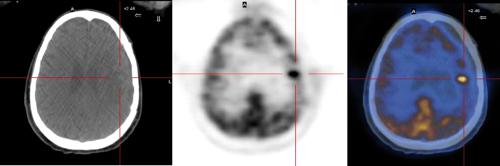
Per le patologie neoplastiche, la SPECT e la PET consentono di valutare e quantificare in vivo e in maniera non invasiva numerosi parametri fisio-patologici utili nell’analisi dei tumori cerebrali. Possono essere utilizzati diversi traccianti. Il 201Ta, un analogo del potassio, è un tracciante a distribuzione intracellulare. Le immagini ottenute sono analizzate attraverso il posizionamento di ROI (regioni di interesse) sulla lesione e sulla zona controlaterale indenne al fine di calcolare l’indice di ritenzione del radiofarmaco tra le immagini precoci, che danno informazioni relative al flusso, al volume ematico principale e alla permeabilità della BEE, e quelle più tardive, che riflettono i meccanismi di funzione cellulare. È stata dimostrata una buona correlazione tra l’indice di ritenzione e gli indici di proliferazione cellulare; inoltre, l’alterazione della BEE, indotta dal tumore, determina una maggior concentrazione del tracciante a tale livello, mentre il danno della BEE da altre cause (radionecrosi, ematomi) non comporta aumento del tracciante.
Il 99mTc-sestamibi e il 99mTc-tetrofosmin sono traccianti tecneziati che forniscono immagini di qualità superiore rispetto al 201Ta; non sono in grado di differenziare tra tumori a basso grado e tumori ad alto grado, ma possono essere utilizzati per la diagnosi differenziale tra recidiva di malattia e radionecrosi. La 123I-alfa-metil tiroxina (123I-IMT) è un tracciante utilizzato nello studio dei tumori cerebrali in quanto la sua captazione dipende dalla proliferazione cellulare. L’FDG è invece utilizzato per individuare tumori cerebrali ad alto consumo di glucosio: la captazione del tracciante è correlata con il grado di malignità, con la densità cellulare e con l’aggressività biologica (fig.). Infatti, i tumori a basso grado di malignità e a bassa attività metabolica sono difficilmente identificabili. L’analisi quantitativa effettuata mediante il calcolo del SUV (Standardised uptake value) correla con la prognosi: tanto maggiore è il SUV (alto grado di malignità, elevato metabolismo) tanto peggiore è la prognosi. Anche l’FDG è impiegato nella diagnosi differenziale tra ripresa di malattia e necrosi/fibrosi dopo trattamento radioterapico: in quest’ultimo caso infatti non vi è aumentata captazione dell’FDG. Come tracciante viene usata anche la 11C-colina, un precursore dei lipidi di membrana presente in elevate concentrazioni nei tumori cerebrali, specialmente quelli ad alto grado di malignità, e captata anche dai tumori a basso grado di malignità consentendo lo studio anche di questi ultimi. La 11C-metionina è invece un amminoacido utilizzato perché indicativa della proliferazione cellulare.
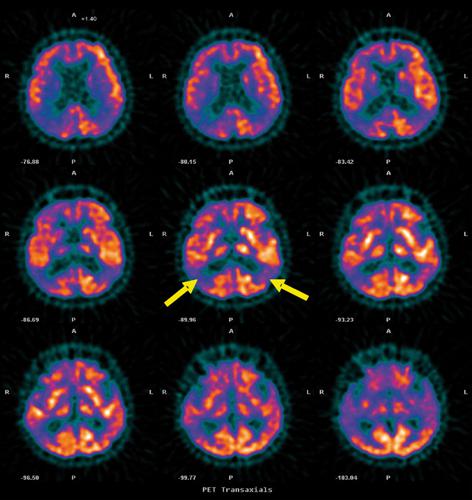
Per le malattie neuro degenerative, e in particolare per la demenza di Alzheimer e la malattia di Parkinson, le tecniche di imaging nucleare rivestono un grande interesse. Nella demenza di Alzheimer il paziente presenta disturbi della sfera cognitiva e comportamentale ad andamento progressivo, iniziando con deficit della memoria per arrivare alla demenza completa. È causata dalla deposizione di una molecola, la beta-amiloide, sia a livello intercellulare sia intracellulare causando un danno tossico ai neuroni. È stato osservato che le prime alterazioni funzionali interessano l’ippocampo e la corteccia entorinale, prima ancora che si manifesti l’atrofia. Gli esami di neuroimmagini funzionali con 18FDG PET e 99mTc HMPAO o 99mTc ECD SPECT evidenzieranno un’ipofunzione di queste regioni. Successivamente sono colpite le aree associative neocorticali che manifestano ipofunzione e atrofia, prima a livello temporo-parietale e poi a livello prefrontale (fig.). A tal proposito è importante poter disporre, oltre che del dato funzionale, anche di immagini morfologiche per apprezzare quanto di una data area di ipocaptazione è ascrivibile a un vero deficit funzionale o quanto non sia semplicemente dovuto alla mancanza di tessuto nervoso per l’atrofia. Attualmente grazie ad alcuni software di coregistrazione è possibile unire le immagini funzionali a quelle morfologiche per apprezzare direttamente le aree di ipocaptazione che esprimono una vera ipofunzione. L’estensione e la severità dell’ipofunzione corticale è correlata alla severità della malattia. La sensibilità della PET e SPECT nella diagnosi della demenza di Alzheimer cambiano in funzione dello stadio della malattia, raggiungendo il 100% nei casi di malattia conclamata.
La malattia di Parkinson è la seconda più comune forma di malattia neurodegenerativa. Le alterazioni neuropatologiche caratteristiche della malattia sono la perdita di neuroni dopaminergici nella pars compacta della sostanza nera e la presenza di depositi proteici nei neuroni (corpi di Lewy). I neuroni dopaminergici proiettano allo striato intervenendo nei meccanismi di controllo extrapiramidale del movimento: nel Parkinson si determina quindi una disfunzione del sistema nigrostriatale.
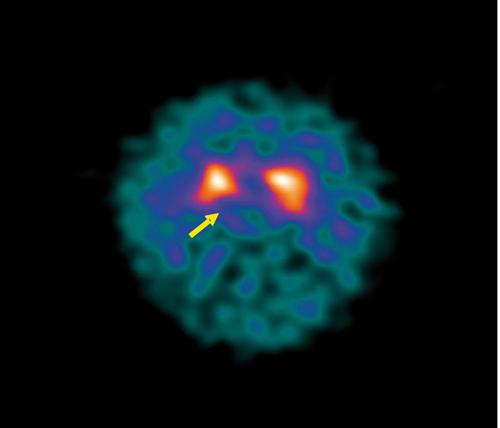
L’imaging con SPECT e PET consente di valutare in vivo l’entità della disfunzione dopaminergica in pazienti con malattia di Parkinson, utilizzando vari tipi di traccianti tra cui uno dei più utilizzati è il [123I]FP-CIT (DatSCAN), che si lega a una proteina trasportatrice della dopamina (DAT) presente sui neuroni nigrostriatali a livello presinaptico e che riflette la funzione di tali neuroni. Studi multicentrici hanno dimostrato che la SPECT con [123I]FP-CIT ha un elevata sensibilità (95498%) e specificità (83494%) per la diagnosi di parkinsonismo rispetto all’invecchiamento normale e al tremore essenziale. La SPECT del DAT ha quindi un’elevata sensibilità nell’identificare in vivo la presenza di disfunzione nigrostriatale (fig.).
Altri tipi di traccianti sono quelli specifici per i recettori che legano la dopamina (recettori D2), utilizzati sia nel monitoraggio della terapia farmacologica sia nello studio di alcuni aspetti fisiopatologici del morbo di Parkinson.