isotopi
Atomi che hanno numero atomico uguale e occupano perciò lo stesso posto nel sistema periodico degli elementi, ma hanno massa atomica diversa. I primi i. a essere scoperti furono gli i. radioattivi, allorché intorno al 1907, si constatò l’impossibilità di separare con mezzi chimici certi elementi radioattivi dai prodotti di disintegrazione: i primi tre i. individuati furono torio, radiotorio e ionio, di numero atomico 90. I. non radioattivi furono invece scoperti nel 1914 da O. Hönigschmid, che ne trovò due del piombo. Il termine i. fu introdotto nel 1913 da F. Soddy.
Caratteristiche
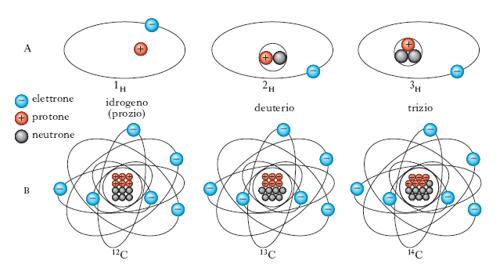
Gli i. possono essere stabili oppure instabili (o radioattivi), naturali, cioè esistenti in natura, oppure artificiali, cioè prodotti in conseguenza di reazioni nucleari provocate. La struttura elettronica è identica per tutti gli i. di uno stesso elemento; uguale è il numero di protoni che il nucleo di ciascun i. contiene e uguale quindi, come si è detto, è il numero atomico; diverso è invece il numero di neutroni (v. es. in fig.) e quindi il numero di massa. Usualmente un i. si indica facendo precedere il simbolo dell’elemento chimico da due numeri, dei quali uno, in basso, è il numero atomico, l’altro, in alto, è il numero di massa: così, per es., i due i. stabili del carbonio (numero atomico 6 e numero di massa 12 e 13) si indicano con i simboli 126C e 136C, rispettivamente.
Per quanto fisicamente diversi tra loro (diverse sono infatti la struttura e le proprietà nucleari), gli i. di un elemento sono identici per quanto riguarda le proprietà non dipendenti dalla struttura nucleare, e in particolare le proprietà chimiche, di modo che, come si usa dire, essi sono chimicamente indistinguibili. In realtà gli i. di un elemento si differenziano, sia pure lievemente, per certe proprietà chimico-fisiche, quali, per es., quelle attinenti alla diffusione, al comportamento nei processi elettrolitici e alle caratteristiche spettrali.
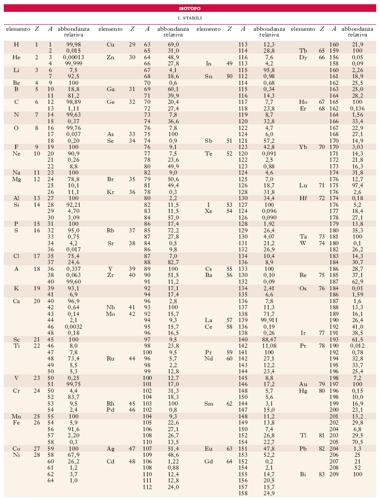
La maggior parte degli elementi chimici si presenta come una miscela di due o più i.: conviene allora, per precisare la costituzione isotopica di un elemento, introdurre la cosiddetta abbondanza isotopica relativa, definita, per ogni i., come la percentuale in massa con cui esso è presente nell’elemento; tale percentuale è costante per ogni i. stabile. Nella tabella sono appunto riportate le abbondanze relative degli i. stabili dei vari elementi, ordinati secondo valori crescenti del numero atomico, Z, e del numero di massa, A.
Gli i. hanno importanza grandissima sia per studi di strutturistica (nucleare, atomica, molecolare, cristallina) sia per la produzione e lo sfruttamento dell’energia nucleare, per la biologia, la medicina, l’industria.
Composizione isotopica e numero isotopico degli elementi
Dal punto di vista strettamente fisico, un problema particolarmente interessante è costituito dal fatto che la composizione isotopica degli elementi è estremamente varia: mentre alcuni elementi sono ricchi di i. stabili, altri ne sono poverissimi (per es., il fluoro non ha i. stabili) a causa della diversa stabilità dei vari nuclidi (➔ nucleo). Un quadro della situazione (determinata dalle forze nucleari) è fornito dalle seguenti regole empiriche: a) la prima regola di Mattauch dice che non esistono isobari stabili, esiste cioè un solo nuclide stabile, se il numero di massa A è dispari; b) la seconda regola di Mattauch dice che se A è pari ci sono parecchi isobari stabili; gli elementi che hanno un solo nuclide stabile, privi cioè di i. stabili, hanno numero di massa A e numero atomico Z (a eccezione del 34Be) dispari; se Z è pari ci sono numerosi i. (il numero dei nuclidi stabili è ≥3); c) la regola di Aston, infine, dice che se Z è dispari, l’elemento ha al massimo un i. stabile (cioè al massimo due nuclidi stabili). Sulla scorta di tali regole è possibile, almeno nelle grandi linee, prevedere la costituzione in i. stabili di un elemento qualunque.
Più complessa è invece la situazione per quanto concerne gli i. radioattivi, anche per la continua scoperta di nuovi i. del genere. A proposito di questi, è consuetudine indicarli brevemente premettendo il suffisso radio- al nome dell’elemento (per es., radiocarbonio, radioiodio).
Il numero isotopico (o eccesso neutronico) degli elementi è la differenza, I=N−Z, fra il numero N dei neutroni e il numero Z dei protoni presenti in un nucleo atomico.
Separazione isotopica
Per separare tra loro i. di uno stesso elemento si usano vari metodi, basati sulle lievi differenze di proprietà chimico-fisiche prima ricordate, oppure, ove gli i. vengano ridotti allo stato di ioni, basati sul differente comportamento elettrico e magnetico derivante dalla diversa carica specifica. Tra i metodi di separazione isotopica ricorderemo la diffusione in fase gassosa, la diffusione termica, la distillazione frazionata, la centrifugazione, metodi tutti in cui gli i. non sono ionizzati, nonché l’elettrolisi e la separazione elettromagnetica, in cui, invece, gli i. sono allo stato di ioni.
L’isotrone è un apparecchio per la separazione isotopica con metodi elettrici, basato sul fatto che ioni di uguale carica e di massa diversa accelerati da uno stesso campo elettrico acquistano velocità differenti. È costituito da una sorgente di ioni, in cui gli i. da separare vengono ionizzati, e da un acceleratore nel quale agisce un campo elettrico impulsivo; un elettrodo deflettore, il cui potenziale varia in opportuno sincronismo con il campo acceleratore, consente di estrarre ioni di determinata carica specifica, derivanti quindi da un determinato isotopo.
Spin isotopico (o isospin)
Grandezza introdotta in fisica nucleare e delle particelle elementari per contraddistinguere particelle che hanno identico comportamento per quanto riguarda le interazioni forti (➔ forti, interazioni), come, per es., neutrone e protone: queste due particelle hanno masse quasi uguali, stesso spin, e l’interazione forte (a parità di stato e trascurati gli effetti elettromagnetici) è la stessa in una coppia formata da due neutroni, da due protoni o da un protone e un neutrone. L’indipendenza (a parità di stato) del potenziale nucleare dalla carica elettrica, insieme alla piccola differenza fra le masse del neutrone e del protone, suggerisce l’idea che il protone e il neutrone non siano due oggetti indipendenti, ma piuttosto due stati diversi di un’unica particella: il nucleone. A questa particella si deve attribuire un grado di libertà interno descritto da una nuova variabile che può assumere due soli valori, uno dei quali individua lo stato protone, l’altro lo stato neutrone. Questo formalismo fu applicato per la prima volta, nel 1932, da W. Heisenberg per rappresentare i due stati del nucleone, introducendo un operatore t dotato delle stesse proprietà formali dello spin s, che fu in seguito chiamato spin isotopico; esso è definito in uno spazio rappresentativo, detto isospazio, che nulla ha a che fare con lo spazio ordinario (in cui è definito l’operatore s). Quando la componente t3, lungo il terzo asse dell’isospazio, vale +1/2 il nucleone è nello stato «protone», quando t3=−1/2 il nucleone è nello stato «neutrone». La carica elettrica del nucleone, q, misurata in unità e, è data dalla espressione q=1/2+t3, che, per t3=±1/2, assume i valori 1 e 0 competenti rispettivamente allo stato «protone» e allo stato «neutrone». Fino al 1936 le considerazioni sullo spin isotopico avevano un carattere puramente formale ma, a partire da quell’anno, ebbe inizio un esame critico dei risultati sperimentali relativi all’urto neutrone-protone; questo esame, esteso successivamente ad altre categorie di fenomeni, portò, verso il 1953, a riconoscere che la formulazione corretta della legge dell’indipendenza delle forze nucleari dalla carica elettrica richiede il concetto di spin isotopico opportunamente generalizzato anche ad altri corpuscoli diversi dal nucleone. Pertanto lo spin isotopico è oggi considerato come una vera e propria grandezza fisica.
Effetto (o spostamento) isotopico
In spettroscopia, a causa della dipendenza della frequenza della radiazione emessa da un atomo dalla massa dell’atomo stesso, due i. del medesimo elemento emettono nella stessa transizione due frequenze leggermente diverse (la differenza relativa delle due frequenze è: Δν/ν=(me/M2)ΔM, dove me è la massa elettronica, M la massa atomica di un i. e M+ΔM quella dell’altro).
Impiego degli isotopi
In biologia, i. sono usati soprattutto nelle indagini sulla localizzazione di alcuni composti chimici in dati organi o tessuti, o anche in particolari cellule o parti di esse, e nello studio del ricambio di alcuni costituenti chimici degli organismi. La tecnica consiste nell’introdurre nell’organismo, per via orale o per iniezione o in altro modo, sostanze contenenti una certa percentuale di uno o più i. radioattivi (elementi marcati); dopo un tempo determinato si può procedere alla ricerca ed eventualmente alla misurazione degli i. che si trovano in un dato organo o in una data sostanza estratta da un organo. Un’applicazione particolare, molto importante per vari problemi storici e geologici, è quella che si fa dell’i. 146C, che ha un periodo di dimezzamento di 5600 anni, per la datazione di reperti organici.
In medicina gli i. radioattivi sono usati in diagnostica e, come i raggi X e il radium, in terapia.
L’isotopoterapia a base di raggi β e γ (soprattutto i primi) si attua mediante la somministrazione di i. radioattivi, captati elettivamente dai tessuti malati (131I in alcune tireopatie, 32P in alcune emopatie; ➔ anche radioisotopo).
L’isotopoangiocardiografia è una metodica semeiologica che permette l’esplorazione radioisotopica del cuore e dei grossi vasi, utilizzando vari i. (tecnezio 99 ecc.) legati ad albumine umane e introdotti in vena o direttamente nelle cavità cardiache mediante cateterismo del cuore. Tale metodica, introdotta nel 1958 per la diagnosi differenziale tra versamento pericardico e cardiomegalia, si è rivelata utile nella diagnosi differenziale tra tumori mediastinici e aneurismi aortici e nello studio della dinamica del cuore e dei grossi vasi.
Isotopomeri
In chimica organica, si definisce isotopomero un composto avente la stessa composizione isotopica di un altro, ma diversa disposizione degli i. all’interno della struttura molecolare. Così, per es., l’acetaldeide (CH3CHO) monodeuterata può esistere in due diverse forme isotopomera, di formula CH2DCHO e CH3CDO. Il termine, che ha raggiunto una certa diffusione nel linguaggio della stereochimica organica, si può riferire sia a isomeri costituzionali sia a diastereoisomeri sia a isomeri ottici. I diversi isotopomeri di un composto si possono distinguere, per es., mediante la spettroscopia vibrazionale.