olefina
Idrocarburo alifatico insaturo della serie etilenica, di formula generale CnH2n, contenente un doppio legame; detto alchene nella nomenclatura chimica ufficiale. Meno propriamente e più genericamente, con il nome di o. si indicano gli idrocarburi alifatici non saturi contenenti doppi legami.
Generalità
Nomenclatura. - La nomenclatura IUPAC prescrive per questi idrocarburi l’uso del suffisso -ene: si ha così etene, propene, esene ecc. Il suffisso -ilene della nomenclatura tradizionale è ancora talvolta usato, specie per i termini inferiori come etilene, propilene ecc. La posizione del doppio legame tra due atomi di carbonio viene indicata con un numero che individua uno dei due atomi, per la precisione quello che porta la numerazione più bassa partendo dalla estremità della catena più vicina al doppio legame: per es., CH3CH=CHCH2CH2CH3 è chiamato 2-esene.
Caratteristiche. - Dal punto di vista configurazionale, il doppio legame ha struttura planare rigida, ovvero i 2 atomi di carbonio e i 4 sostituenti a essi legati giacciono su un medesimo piano; per tale motivo le o. possono dar luogo a isomeria geometrica; per es., il 2-butene esiste sia nella forma cis- che in quella trans-. I primi 3 termini della serie sono gassosi, i successivi fino a 16 atomi di carbonio sono liquidi, gli altri solidi. Le o. fino a 5 atomi di carbonio sono dette inferiori, le altre superiori. Le loro proprietà fisiche sono simili a quelle delle paraffine: per es., sono insolubili in acqua e solubili nei solventi organici apolari; bollono a temperature leggermente inferiori ai loro omologhi saturi, mentre la loro densità è di poco superiore.
Dal punto di vista chimico le o. sono più reattive dei corrispondenti idrocarburi saturi: il doppio legame è il centro reattivo e le reazioni più caratteristiche sono quelle di addizione, le quali trasformano le o. in prodotti di tipo saturo; alcune di queste reazioni (idrogenazione, alchilazione, ossosintesi, polimerizzazione) rivestono grande importanza industriale.
Le o. possono addizionare idrogeno, in presenza di catalizzatore metallico, per dare il corrispondente alcano; alogeni o acidi alogenidrici dando luogo ad alogenuri alchilici; acqua, acido solforico, acetato mercurico o diborano con formazione di alcoli; alcani con produzione di idrocarburi saturi superiori; una miscela di ossido di carbonio e idrogeno in presenza di catalizzatori al cobalto (reazione di ossosintesi) per dare composti carbonilici contenenti un atomo di carbonio in più. Molte di queste reazioni sono catalizzate da acidi e avvengono con formazione di intermedi ionici di tipo carbocationico ma non mancano addizioni di tipo radicalico come quella dell’acido bromidrico o del tetracloruro di carbonio, catalizzate da perossidi.
L’apertura del doppio legame è anche alla base del processo di polimerizzazione (di tipo radica;lico o ionico), di grande importanza in;dustriale per la preparazione di materie plastiche: così dall’etilene si ottiene il polietilene, dal cloruro di vinile il polivinilcloruro (o PVC) ecc. Il doppio legame è fonte di elettroni e può essere ossidato con una certa facilità: in presenza di permanganato di potassio le o. danno luogo ai corrispondenti glicoli mentre per ossidazione più energica con ozono si ha la scissione completa del doppio legame (ozonolisi) con formazione di prodotti carbonilici con più basso peso molecolare. Il doppio legame rende chimicamente più attivi i sostituenti in posizione α rispetto a esso, cosicché le o. possono dar luogo a reazioni di sostituzione allilica; per es., il propilene, in presenza di cloro e a elevata temperatura dà luogo alla formazione di cloruro di allile.
Le o. inferiori
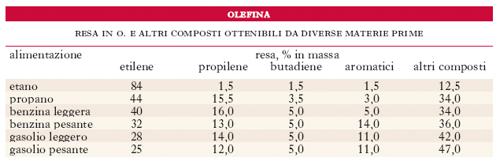
Le o. inferiori si ottengono prevalentemente per cracking di idrocarburi saturi gassosi (specie etano) o liquidi (da benzine a gasoli fino a grezzi petroliferi). La scelta dipende da diversi fattori: costo, disponibilità, possibilità di utilizzazione dei vari prodotti ecc. Negli USA la materia prima più usata per il cracking a etilene è costituita da etano (ottenuto dai gas naturali o dai gas di raffineria) o dai gas petroliferi liquefatti (GPL); però la diminuita disponibilità di gas naturali verificatasi a partire dagli anni 1980 ha portato a un incremento di consumo dei prodotti liquidi. In Europa invece, dove la disponibilità di gas naturali è minore e questi sono prevalentemente di tipo secco o comunque a più basso contenuto di etano, benzine leggere sono state inizialmente la materia prima più usata; poi le variate condizioni del mercato petrolifero e l’aumento del costo dei grezzi hanno portato all’utilizzazione di prodotti sempre più pesanti, meno pregiati e relativamente meno costosi (benzine pesanti, gasoli, oli combustibili e anche grezzi petroliferi). Questo cambiamento di materia prima richiede impianti più complessi e quindi più costosi, poiché al crescere del peso molecolare degli idrocarburi di partenza aumentano le difficoltà del cracking e il numero dei composti che si possono formare e che presentano maggiori difficoltà di separazione; inoltre, occorre tenere presente che per molte delle o. inferiori sono richiesti, nei loro impieghi, gradi di purezza elevati. Nella tabella sono riportate le rese in o. e in altri composti ottenibili da queste materie prime.
Il cracking di idrocarburi a o. è favorito da temperature elevate (850-1050 °C), che provocano preferenzialmente rottura della catena verso l’estremità con maggiore produzione di o. più leggere; da tempi di permanenza alle alte temperature molto brevi (frazioni di secondo), che incrementano la selettività; da pressioni, per quanto possibile basse, che di solito si realizzano addizionando alla carica una forte quantità di vapore surriscaldato. Oltre che per cracking di idrocarburi le o. inferiori si possono ottenere dalla sintesi Fischer-Tropsch o con sistemi particolari per le singole o. (l’etilene per disidratazione dell’alcol, per idrogenazione selettiva dell’acetilene ecc.; il propilene per deidrogenazione del n-propanolo e dell’isopropanolo).
Le o. superiori
Le o. superiori possono essere di diverso tipo: a catena lineare o ramificata, con il doppio legame situato all’estremità della catena o in un punto intermedio. Le o. superiori sono più difficili da ottenere allo stato puro perché all’aumentare del numero degli atomi di carbonio della catena aumenta il numero degli isomeri, per lo più aventi punti di ebollizione ravvicinati. Le o. superiori si possono ottenere con diversi sistemi: a) per oligomerizzazione di o. inferiori (etilene, propilene, buteni o loro miscele): l’operazione si può fare in fase sia omogenea sia eterogenea; si ottengono miscele di diversi isomeri fra i quali, di solito, prevalgono quelli a catena ramificata; l’oligomerizzazione può anche essere condotta in presenza di catalizzatori del tipo Ziegler-Natta (a 90-120 °C, a 100-200 bar, in presenza di alluminiotrietile si ottengono per il 95% o. lineari col doppio legame situate all’estremità della catena); b) per deidrogenazione catalitica di paraffine lineari (si ottengono prevalentemente o. con il doppio legame situate all’estremità della catena); c) per cracking termico di paraffine; d) per deidroclorurazione di cloroparaffine (si ottengono prevalentemente o. con doppio legame interno); e) per disproporzione di o. gassose.
Impiego
Le o. costituiscono la materia prima di maggiore importanza per la petrolchimica, sia dal punto di vista quantitativo sia per il numero di derivati che da esse prendono origine. Il sempre crescente impiego di o. nel campo dell’industria chimica organica è messo in evidenza dall’aumento della domanda di etilene negli USA, che negli ultimi anni ha avuto un incremento pari a quasi il 50% . La domanda di propilene è cresciuta addirittura del 75% , mentre più contenuto è il corrispondente valore del butadiene.
Sempre maggiore è la richiesta del mercato per le α-o. lineari (o. con il doppio legame posizionato tra i primi due atomi di carbonio della catena lineare) con numero di atomi di carbonio variabile fra 4 e oltre 20. Il tasso medio annuo di crescita è compreso fra il 5 e il 10%; più del 50% della domanda riguarda l’uso come comonomeri per la produzione di polimeri (per es., l’impiego di 1-esene e 1-ottene per ottenere polietilene a bassa densità). Gli altri usi delle α-o. lineari riguardano la produzione di plastificanti (C4-C8), detergenti (C12-C18) e, soprattutto, lubrificanti sintetici (C6-C20). Il crescere della domanda delle o. lineari ha stimolato lo sviluppo di sistemi catalitici di tipo innovativo, come i catalizzatori metallocenici (➔ metallorganici, composti).