fullereni
Aggregati (clusters) costituiti da un elevato numero (sempre pari) di atomi di carbonio (da 40 a 190 ca.) e caratterizzati da un’elevata stabilità. Sono stati chiamati f. per l’analogia della loro struttura con le forme architettoniche progettate.
Generalità
La scoperta del buckminsterfullerene C60, avvenuta nel 1985, aprì il campo di studio dei f., poi diventato un ramo di intensa attività di ricerca in chimica e in fisica. L’assegnazione del premio Nobel per la chimica nel 1996 a H.W. Kroto, R.F. Curl e R.E. Smalley, autori della scoperta, ha definitivamente sancito l’interesse per questi nuovi materiali. A partire dalla fine degli anni 1980 le ricerche si sono indirizzate principalmente lungo due strade: da un lato, lo studio teorico delle proprietà strutturali e fisiche dei vari membri della famiglia, associato al tentativo di identificarne e produrne di nuovi; dall’altro, l’approfondimento sistematico, per via sperimentale, della conoscenza delle proprietà fisiche e chimiche dei f. più stabili e quindi più facilmente ottenibili in quantità macroscopiche, quali soprattutto il C60 e, in misura minore, il C70.
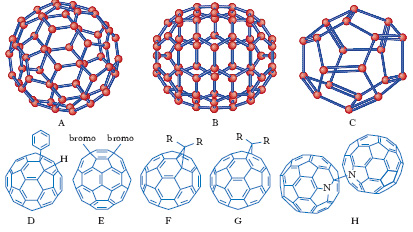
Tutti i membri della famiglia dei f. presentano tipiche strutture tridimensionali chiuse, cave all’interno, simili a gabbie sferiche. L’eccezionale stabilità del C60 fu spiegata, fin dalla sua scoperta, attribuendo a esso una struttura altamente simmetrica, costituita da 12 anelli pentatomici e 20 esatomici, corrispondente a un icosaedro tronco. Nel C60 (fig. A), ciascun anello pentagonale è circondato da 5 anelli esagonali, struttura confermata sperimentalmente. Il diametro della ‘gabbia’ è pari a circa 0,7 nm. In essa sono presenti due tipi di legame: quelli condivisi da 2 anelli esagonali, i cosiddetti legami 6-6 (più corti, con maggiori caratteristiche di doppio legame), e quelli condivisi da un anello esagonale e da uno pentagonale (legami 6-5).
Dal punto di vista topologico, requisito essenziale per la formazione di una struttura fullerenica è la presenza di 12 anelli pentatomici e di n anelli esatomici, dove n può essere, in teoria, un qualunque numero intero diverso da 1. A questi requisiti si aggiungono quelli di natura chimico-fisica, che regolano la stabilità relativa dei diversi f. e dei loro possibili isomeri. Oltre al C70 (fig. B), sono stati individuati in fase gassosa numerosi altri membri della classe dei f. (C36, C76, C86 ecc.), non tutti dotati di particolare stabilità. Il più piccolo f. possibile, il C20 (fig. C), formato esclusivamente da pentagoni (n=0), è stato ottenuto per la prima volta nel 2000 dal suo derivato completamente idrogenato (C20 H20) passando attraverso un intermedio bromurato. A causa della forte curvatura della sua superficie, il f. C20 non è dotato di grande stabilità e in molte condizioni tende a trasformarsi in isomeri di diversa forma (ad anello, a ‘scodella’), non fullerenici.
Metodi di produzione
Lo studio sperimentale sistematico delle proprietà dei f. è divenuto possibile dopo la messa a punto di metodiche atte a produrne quantità significative allo stato solido. Il primo di questi metodi fu introdotto nel 1990 per la preparazione del C60. Consiste nel vaporizzare un campione di grafite, riscaldandolo mediante passaggio di corrente sotto atmosfera di elio, e nel purificare il sublimato ottenuto (contenente C60, C70 e f. superiori) mediante dissoluzione e cristallizzazione in benzene. Il materiale che si ottiene è il C60 (leggermente impuro per il C70): è un solido cristallino, avente una colorazione che va dal marrone scuro al nero, solubile in solfuro di carbonio e tetracloruro di carbonio. Altri metodi impiegati per la preparazione dei f. si basano sulla combustione di idrocarburi in presenza di argo e sulla realizzazione di un arco elettrico tra elettrodi di grafite, sempre sotto un’atmosfera di gas inerte. Sono stati anche sviluppati metodi cromatografici per la separazione e la purificazione dei f., basati sull’utilizzo di colonne di gel di silice e carbone attivo. L’ottenimento di quantità significative di materiale allo stato solido e sufficientemente puro è stato limitato, per buona parte degli anni 1990, principalmente ai f. C60 e C70; il primo f. più piccolo del C60 prodotto su ‘larga scala’ è stato il C36, ottenuto nel 1998.
Composti fullerenici
Lo studio delle proprietà fisiche e chimiche dei f. ha evidenziato numerose caratteristiche speciali di questi materiali. Particolarmente interessanti dal punto di vista tecnologico sembrano i composti fullerenici noti come nanotubi (➔). Il C60 è un isolante elettrico ma, drogato con metalli alcalini o di transizione, diviene conduttore e, a bassa temperatura, superconduttore; le temperature a cui avviene la transizione a superconduttore vanno dai 19 K del C60 drogato con potassio ai 45 K di quello contenente tallio e rubidio. In tali composti, i metalli si trovano racchiusi nella cavità della molecola fullerenica. I composti di questo tipo sono detti endoedrici, mentre quelli in cui atomi o gruppi di atomi sono legati sulla superficie esterna del f. sono detti esoedrici.
Dal punto di vista chimico, il C60 è un composto difficilmente ossidabile, mentre viene facilmente ridotto per via chimica o elettrochimica, originando i sali denominati fulleruri. Reagisce facilmente con radicali, nucleofili di vario tipo e carbeni, formando composti di addizione in cui atomi o gruppi di atomi sono legati alla struttura fullerenica. L’addizione di queste specie avviene mediante rottura di un doppio legame. In genere i legami che si rompono sono quelli, più reattivi, condivisi da 2 anelli a 6 termini; a seconda dei casi, gli atomi o gruppi entranti si legano a 2 atomi di carbonio adiacenti (addizione 1,2; fig. D) o opposti (addizione 1,4, che avviene soprattutto nelle reazioni di alogenazione radicaliche o quando i sostituenti sono particolarmente voluminosi; fig. E).
Tra i più importanti prodotti di queste reazioni vi sono i metanofullereni, nei quali un atomo di carbonio è legato a 2 atomi fullerenici. Quando il doppio legame attaccato è di tipo 6-6 i 2 atomi di carbonio restano legati mediante un legame singolo (fig. F). Quando invece la reazione avviene in corrispondenza di un legame 6-5, tale legame viene completamente rotto (fig. G). Il C60 è inoltre facilmente idrogenato: per riduzione con litio in ammoniaca liquida si forma un solido bianco, di formula C60H36. Sono stati anche preparati numerosi complessi del C60 con metalli di transizione.
Gli eterofullereni rappresentano una categoria di derivati dei f. nei quali uno o più atomi di carbonio del f. sono sostituiti da atomi di tipo diverso. I più studiati sono quelli contenenti atomi di boro ( borafullereni) o di azoto ( azafullereni). Poiché questi atomi possiedono un elettrone di valenza in meno rispetto al carbonio, gli eterofullereni contenenti un numero dispari di sostituzioni (per es., i monoazafullereni, che sono i più comuni) hanno carattere radicalico e tendono a formare dimeri (fig. H). Gli eterofullereni possono a loro volta dare origine a interessanti derivati.