cristallizzazione
Fenomeno in virtù del quale le molecole o gli atomi di una sostanza si dispongono in modo regolare su una struttura fissa tridimensionale. Lo stato così raggiunto è detto stato cristallino. Il passaggio allo stato cristallino si ottiene con transizioni solido-solido (S→S), liquido-solido (L→S) e vapore (o gas)-solido (V→S). Il processo della c. viene utilizzato sia in operazioni di purificazione (c. frazionata, purificazione a zone) sia per la preparazione di cristalli artificiali. In questo caso si cerca o di ricreare in laboratorio le condizioni in cui i cristalli si sviluppano in natura (cristallogenesi), o di sviluppare tecniche per la crescita di grossi cristalli singoli (monocristalli), indispensabili per le applicazioni all’elettronica poiché i materiali monocristallini necessari per realizzare i moderni dispositivi elettronici non sono reperibili in natura ed è necessario sintetizzarli.
Nei processi di c. S→S la fase di partenza, amorfa o policristallina, viene condotta a una fase più ordinata. Alcune sostanze amorfe, come vetri o colloidi, possono essere cristallizzate mediante variazioni di temperatura e di pressione, non necessariamente concomitanti.
Per la c. dal liquido si possono distinguere due casi: la c. da una massa fusa, che ha luogo quando un materiale, la cui natura preferenziale è cristallina, viene raffreddato al di sotto del punto di fusione, e la c. da una soluzione. Quest’ultima può avvenire o per effetto di una variazione di temperatura (la solubilità del soluto decresce, in genere, al diminuire della temperatura) o per evaporazione del solvente o per adduzione di altri soluti che favoriscono il formarsi di una fase solida.
Esistono molte tecniche il cui scopo è di ottenere la sublimazione dalla fase vapore di uno o più monocristalli o di uno strato di materiale monocristallino su un opportuno substrato (c. epitassiale dalla fase vapore). I processi V→S possono avvenire in un ambiente di reazione chiuso o aperto. Nel primo caso (processi in tubo chiuso) il materiale da cristallizzare viene fatto evaporare da una sorgente che si trova nella zona calda del tubo, mentre la parte in cui è favorito il processo di sublimazione si trova in una zona più fredda.
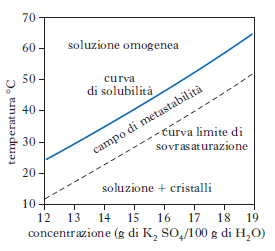
Nell’ingegneria chimica il processo di c. viene utilizzato per separare sostanze solide sfruttando la loro diversa solubilità nello stesso solvente. Se una soluzione concentrata viene gradualmente raffreddata è possibile superare i limiti di solubilità senza che abbia luogo la separazione del solido. Con elevati gradi di sovrasaturazione ha luogo la formazione spontanea di germi cristallini per cui si possono identificare le tre zone illustrate nel diagramma di solubilità illustrato nella fig. per il caso del solfato di potassio. Nella zona di solubilità non ha luogo la formazione di nuclei. In quella intermedia metastabile non ha luogo la formazione di nuclei ma la crescita di nuclei eventualmente introdotti dall’esterno, ed infine nella zona di supersaturazione avvengono entrambi i fenomeni di formazione e crescita dei nuclei. La formazione della nuova fase ha luogo spontaneamente ed è associata a una diminuzione dell’energia libera del sistema.