colorimetria
Branca della spettrofotometria che si occupa dell’assorbimento di luce da parte delle sostanze nel campo del visibile. I principi dell’analisi sono i medesimi e si basano sul fatto che ogni sostanza presenta caratteristici massimi di assorbimento della radiazione elettromagnetica a determinate lunghezze d’onda. Solitamente la c. è utilizzata nell’analisi quantitativa e consiste nella misura dell’assorbimento di una radiazione nel visibile. Tale assorbimento, fissata la lunghezza d’onda e per una data sostanza, è funzione della concentrazione. Dal punto di vista pratico gli strumenti della c. differiscono per alcune caratteristiche costruttive dagli spettrofotometri. Le sostanze che interessano la c. devono essere colorate o colorabili con l’aggiunta di additivi: la lunghezza d’onda più appropriata della radiazione incidente corrisponde al colore complementare a quello mostrato dalla sostanza in esame in modo tale da consentire il massimo assorbimento. Il colore della luce incidente è realizzato con l’impiego di filtri: la radiazione è quindi caratterizzata da un certo intervallo di lunghezza d’onda e non da un singolo valore di lunghezza d’onda; quest’ultima situazione si realizza invece nella spettrofotometria, dove è indispensabile lavorare in condizioni di monocromaticità.
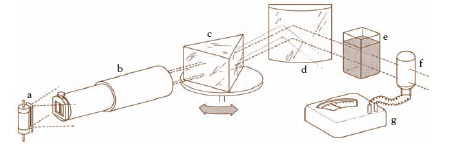
Per risalire dalla intensità del colore alla concentrazione esistono diversi metodi, a seconda della strumentazione disponibile. La più semplice è costituita dai comparatori ottici, nei quali si realizza un confronto di intensità di colorazione fra il campione incognito e uno standard. Di tali standard o si varia la concentrazione o si varia la lunghezza del cammino ottico: in tutti e due i casi lo scopo è quello di rendere l’intensità della colorazione, e quindi l’assorbimento della luce, uguale per la soluzione in esame e per lo standard. Partendo dalla legge di Lambert-Beer che correla l’assorbimento alla concentrazione attraverso una costante che deriva dal prodotto di una grandezza caratteristica della specie assorbente, responsabile della colorazione, per la lunghezza del cammino ottico, è pertanto possibile, conoscendo i due cammini ottici (nella soluzione in esame e nello standard) e la concentrazione dello standard, nelle condizioni di pari intensità, risalire alla concentrazione della soluzione in esame. I colorimetri fotoelettrici sono strumenti più affidabili e sicuri dei comparatori; in essi la misura dell’assorbimento della luce non avviene per confronto, ma è determinata mediante l’impiego di cellule fotoelettriche (v. fig.): l’intensità della luce incidente (Io) e della luce trasmessa (It) vengono trasformate in un segnale di corrente mediante l’impiego delle cellule fotoelettriche e l’assorbimento determinato come log (Io/It).
Esempi classici di determinazioni colorimetriche sono quella del ferro con il solfocianuro (colore rosso sangue), del fosforo con il reattivo molibdico (colorazione gialla che diviene blu per aggiunta di un riducente), della formaldeide con l’acido cromotropico (colore rosso porpora) e, soprattutto, quella del pH. L’importanza di quest’ultima è più storica e didattica che scientifica, ma il metodo costituisce ugualmente un approccio positivo alla tematica degli indicatori, del loro meccanismo di funzionamento e del loro metodo di impiego. Il principio di questa determinazione è il seguente: se un indicatore viene aggiunto più o meno nella stessa quantità a soluzioni differenti e assume in tutte le soluzioni il medesimo colore, intermedio fra i due caratteristici dell’indicatore agli estremi dell’intervallo di pH al quale è sensibile, si può affermare che le soluzioni hanno lo stesso pH. Per l’applicazione di questo principio risulta evidente che bisogna disporre di una soluzione standard a pH noto; l’accuratezza della determinazione è quindi anche funzione dell’accuratezza con cui si conosce il pH della soluzione di riferimento: comunque, il metodo colorimetrico di determinazione del pH non consente in genere un’accuratezza maggiore di 0,1 unità.