coagulazione
Chimica
Processo attraverso il quale una dispersione colloidale passa allo stato di gel con formazione di larghi aggregati. Deriva dalla destabilizzazione di un sistema colloidale conseguente al fatto che la repulsione elettrostatica fra le particelle, dovuta agli ioni adsorbiti sulla loro superficie, viene schermata dagli ioni presenti nella soluzione per cui prevalgono le forze dispersive attrattive. La coagulazione può essere provocata dal riscaldamento ma sopratutto dall’azione di agenti chimici, in particolare gli elettroliti, che alterano la forza ionica della soluzione (➔ colloidale, stato).
Medicina
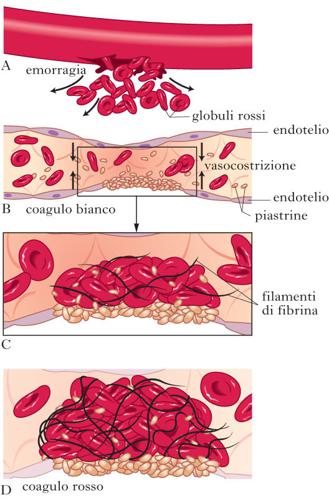
Fenomeno basato su complessi sistemi enzimatici attraverso i quali dal sangue liquido si costituisce il reticolo di fibrina e il coagulo solido (v. fig.).
Meccanismo
L’arresto dell’emorragia è reso possibile da una serie di eventi integrati che sono definiti con il termine di emostasi. I fattori che concorrono al processo emostatico e alla formazione del coagulo di fibrina, sono fondamentalmente quattro: i vasi, le piastrine, la coagulazione plasmatica e la fibrinolisi. Una lesione che determini delle modificazioni della parete vasale porta all’esposizione di molecole sottostanti il rivestimento vascolare (endotelio), all’attivazione piastrinica e successivamente alla formazione del reticolo di fibrina e alla stabilizzazione di esso. La coagulazione rappresenta dunque il contributo che la componente plasmatica del sangue porta alla formazione del coagulo, con la comparsa di un reticolo tridimensionale in cui rimangono imbrigliate le cellule ematiche e conseguente passaggio dallo stato liquido allo stato solido del sangue. Il meccanismo con cui si realizza è rappresentato da una serie di eventi concatenati che nel loro insieme costituiscono un processo a cascata, determinando la trasformazione del fibrinogeno, proteina solubile del plasma, in fibrina. In tale processo sono coinvolti numerosi fattori enzimatici (fattori della coagulazione) presenti in forma inattiva di proenzimi, che una volta convertiti nella loro forma attiva, determinano una serie di attivazioni successive ad attività serin-proteasica, attivando i proenzimi successivi. Alla maggior parte dei fattori plasmatici sono attribuiti numeri ordinali fino al XIII.
Fasi
La coagulazione si può suddividere in quattro momenti: formazione tromboplastinica, formazione di trombina, formazione di fibrina e stabilizzazione della fibrina.
La formazione tromboplastinica
Comprende la via intrinseca e la via estrinseca di attivazione. Con la prima (detta anche fase di contatto) vi è l’attivazione del fattore XII o di Hageman, come conseguenza dell’esposizione del plasma a una superficie estranea per la discontinuità della parete vasale. Nella cellula endoteliale vi è infatti un bilancio emostatico, con azioni anti-coagulanti (carica elettrica negativa, secrezione di prostaciclina e trombomodulina, esposizione di sostanze eparino-simili) e azioni pro-coagulanti (secrezione di fattore tessutale o tissue factor, sintesi di fattori della coagulazione, esposizione di proteine adesive come il fattore di von Willebrand, la fibronectina e la secrezione di inibitore naturale del plasminogeno). Tale attivazione si associa a un meccanismo per cui altre sostanze plasmatiche (fattori della coagulazione), presenti sotto forma di proenzimi (o zimogeni) entrano in azione: il chininogeno ad alto peso molecolare intensifica l’attivazione della pre-callicreina (o fattore di Fletcher) a callicreina, che a sua volta è in grado di favorire ulteriormente l’attivazione del fattore XII; il fattore XII attivato (FXIIa) così formato inizia il processo coagulativo, agendo sul fattore XI attivandolo (FXIa, o antiemofilico C o PTA, plasma throm;boplastin antecedent), in presenza di chi;ninogeno ad alto peso molecolare. L’attivazione del FXII costituisce una reazione centrale, non solo per il possibile innesco delle vie intrinseca ed estrinseca della coagulazione, ma anche tramite l’attivazione della callicreina, all’attivazione del sistema fibrinolitico, e tramite l’attivazione della prima frazione del complemento, alla chemotassi sui polimorfonucleati e alla liberazione delle chinine. La fase di contatto intrinseca completata dà l’avvio agli stadi successivi del processo a cascata: il fattore XIa, infatti, in presenza di ioni calcio, attiva il fattore IX (o antiemofilico B o fattore di Christmas), quindi il fattore IXa in unione al fattore VIII, a fosfolipidi e a ioni calcio forma un complesso che converte il fattore X (o fattore di Stuart) a fattore Xa. Il FVIII viene sintetizzato a livello epatico, ha un’azione potenziante sull’attivazione del FX e il suo inibitore specifico e la proteina C attivata (PCA). Il FXa si forma anche per attivazione del fattore X inattivato da parte del fattore VII, a sua volta attivato dai fattori tessutali in presenza di ioni calcio: tale via di attivazione, detta estrinseca, è formata dal fattore VII e dal fattore tessutale (TF) quale cofattore. Il FVII (o proconvertina) è l’unico fattore, il cui zimogeno plasmatico ha azione procoagulante, che viene attivato dalla maggior parte dei fattori plasmatici ad attività proteolitica e da numerose serin-proteasi, come plasmina e tripsina. Il fattore tessutale non è presente in circolo ed è costituito da una proteina presente nelle membrane cellulari, strettamente correlata ai fosfolipidi.
La formazione di trombina
Questo momento è rappresentato dalla formazione della trombina per attivazione del fattore II (o protrombina) da parte di un complesso formato dal fattore Xa, dal fattore Va e da fosfolipidi soprattutto di origine piastrinica in presenza di ioni calcio (complesso protrombinasico). Il FV viene sintetizzato a livello epatico, megacariocitario ed endoteliale; la sua funzione principale è quella di accelerare la conversione della protrombina e anche per esso l’inibitore naturale è la PCA.
La formazione e la stabilizzazione della fibrina
Il fibrinogeno (➔) è una proteina a elevato peso molecolare, la cui trasformazione segue tre fasi principali: a) nella fase della proteolisi, la trombina scinde alcuni legami trasformando il fibrinogeno in monomero di fibrina; b) i vari monomeri si associano tra di loro formando il polimero di fibrina (fibrina solubile); c) in questa fase avviene la stabilizzazione dei legami covalenti (fibrina cross-linked). Il fattore XIII o fattore stabilizzante la fibrina, circola nella sua forma inattiva, viene attivato dalla trombina e ha un’azione transamidasica con formazione di legami crociati nel reticolo di fibrina. È contenuto anche nei granuli piastrinici. Con il termine di fibrinolisi si intende il processo di dissoluzione enzimatica della fibrina. Tale sistema è però coinvolto anche in altri processi come l’infiammazione, la riparazione tessutale, l’ovulazione. Il plasminogeno, pro-enzima plasmatico sintetizzato a livello epatico, viene convertito in plasmina attraverso l’azione di specifici attivatori del plasminogeno ad azione serin-proteasica. L’effetto della plasmina sul fibrinogeno ha luogo progressivamente e i frammenti che si formano si chiamano fattori di degradazione del plasminogeno (FDP).
In condizioni fisiologiche esiste nel plasma un sistema antagonista di controllo che regola e modula la coagulazione secondo le necessità dell’organismo, prevenendo così un’abnorme deposizione di fibrina nella rete vasale: i sistemi specifici che presiedono alla inibizione della fibrino-formazione sono essenzialmente le antitrombine e il sistema proteina C/proteina S. Tra le prime, la più importante è l’antitrombina III, proteina di sintesi epatica, deputata alla distruzione progressiva e irreversibile della trombina e del fattore Xa, in presenza di eparina. Del sistema proteina C/proteina S fanno parte 4 proteine: la proteina C, che nella sua forma attiva (PCA) è un inibitore del FVa e VIIIa, la proteina S cofattore della proteina C, la trombomodulina e l’inibitore specifico della PCA.
Patologie
Le coagulopatie (condizioni morbose sostenute da patologia molecolare della coagulazione del sangue) si distinguono in ereditarie (per es., l’emofilia) e acquisite (fra le quali spiccano quelle da anticoagulanti).
La Coagulopatia intravascolare disseminata (CID) è una condizione patologica riferibile all’attivazione generalizzata del processo coagulativo, con consumo di fattori della coagulazione, delle piastrine e successiva risposta iperfibrinolitica. Può verificarsi in numerose evenienze cliniche (neoplasie disseminate, leucemie acute, ustioni, setticemie da germi gram-negativi, morsicature di serpenti velenosi, traumi muscolari estesi, patologia d’interesse ginecologico, come aborto settico, ritenzione di feto morto, embolia amniotica ecc.). Il meccanismo patogenetico principale è caratterizzato dall’innesco dei meccanismi emocoagulativi all’interno dei vasi sanguigni come conseguenza di esposizione o liberazione di fattori tromboplastino-simili tessutali. Da tale attivazione deriva la comparsa in circolo della trombina, con consumo dei fattori ‘labili’ (protrombina, fattore VIII, fattore V, fattore XIII, antitrombina III), del fibrinogeno e delle piastrine: le conseguenze sono rappresentate da diffuse microtrombosi e/o da gravi emorragie, che prevalgono in genere nelle forme acute o subacute di CID. Il trattamento mira alla risoluzione della condizione scatenante, alla terapia sostitutiva del concomitante difetto da iperconsumo (infusione di plasma e concentrati piastrinici) e alla prevenzione dell’azione trombinica (eventuale somministrazione di eparina).
Le prove di coagulazione (prove di screening della coagulazione) sono prove di laboratorio utilizzate per studiare la funzione del sistema emocoagulativo: tempo di emorragia, conteggio delle piastrine, tempo di tromboplastina parziale attivata e tempo di protrombina. Per la diagnosi più approfondita di determinate malattie della coagulazione sono necessarie prove di laboratorio più fini o specifiche, come il dosaggio dei singoli fattori e lo studio di alcune loro caratteristiche strutturali e funzionali.