carbonica, anidride
Gas incolore e inodore, CO2 (detto anche biossido o diossido di carbonio), più pesante dell’aria (densità 1,527 rispetto all’aria), facilmente liquefacibile, solubile in acqua, in alcol ecc. È il principale prodotto della combustione del carbone, degli idrocarburi e in generale delle sostanze organiche. Fu preparata per la prima volta da J. Black nel 1754 per decomposizione del carbonato di magnesio e fu da lui denominata aria fissa. Si trova libera in natura (emanazioni vulcaniche, Grotta del cane di Pozzuoli, aria atmosferica, di cui costituisce lo 0,03% in volume ecc.), disciolta nelle acque e combinata (carbonati di calcio, di magnesio ecc.). Si sviluppa nei processi di fermentazione delle sostanze organiche. Si prepara bruciando con eccesso d’aria una sostanza contenente carbonio o trattando un carbonato o un bicarbonato con un acido.
L’anidride c. ha particolare importanza nei processi biochimici e fisiologici. Viene fissata dalle piante mediante la fotosintesi clorofilliana e impiegata per la sintesi dei glicidi, e dagli organismi animali per formare vari composti organici (per es., basi puriniche e pirimidiniche). Negli animali si forma continuamente anidride c. dai processi catabolici che si svolgono nei tessuti; in parte è eliminata con la respirazione e in parte rimane disciolta o combinata nel sangue e nei liquidi organici e contribuisce a mantenere costante l’equilibrio acidobase.
L’anidride c. si usa nella preparazione di bevande gassate, per il riempimento di estintori d’incendio, come mezzo refrigerante, nella preparazione di carbonati ecc.; in condizioni supercritiche presenta proprietà estraenti di notevole interesse applicativo. Allo stato liquido si trova in commercio in bombole di acciaio. È un liquido mobile. Lasciando evaporare rapidamente l’anidride c. liquida, una parte di essa evapora producendo un raffreddamento così intenso che la rimanente parte solidifica sotto forma di masse fioccose bianche che, pressate, vengono poste in commercio sotto il nome di neve carbonica o ghiaccio secco; questa è usata per la conservazione di derrate alimentari e presenta rispetto al ghiaccio normale il vantaggio di non passare attraverso lo stato liquido ma direttamente allo stato gassoso (sublimazione), assorbendo anche una maggior quantità di calore. Questa anidride c. solida, miscelata con liquidi organici (etere, alcol, acetone ecc.) produce miscele frigorifere capaci di raggiungere temperature di 70-80 °C sotto zero.
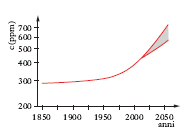
Nell’atmosfera terrestre l’anidride c. è presente a una concentrazione media di 370 ppm (parti per milione); dall’epoca preindustriale (1880 circa), quando aveva un valore di 280 ppm, la concentrazione è andata costantemente aumentando (v. fig.) a causa del consumo crescente dei combustibili fossili, ciò che ha portato a un aggravamento significativo dell’effetto serra (➔ clima). Per limitare tale effetto sono state intraprese ricerche (soprattutto negli Stati Uniti e in Giappone) sulla possibilità di effettuare lo stoccaggio di anidride c. proveniente da attività antropiche in grotte sotterranee o nei mari a profondità superiori ai 3000 m. Sempre nell’ambito delle misure da intraprendere per la riduzione delle emissioni di anidride c. nell’atmosfera, va crescendo l’interesse per il suo impiego nell’industria chimica di sintesi, dopo recupero dai gas di scarico provenienti da impianti industriali e da impianti di produzione dell’energia. All’inizio del Duemila già circa 100 milioni di tonnellate di anidride c. venivano utilizzate ogni anno nell’industria chimica per la sintesi dell’urea, per la produzione di carbonati organici e inorganici, per la preparazione di prodotti farmaceutici ecc. In prospettiva, l’impiego di anidride c. potrebbe essere esteso alle sintesi di numerosi altri prodotti o intermedi chimici (metanolo, dimetilcarbonato, acido formico, acido adipico, isocianati ecc.) fino a impegnare una quantità annuale di anidride c. presumibilmente intorno a un miliardo di tonnellate all’anno.