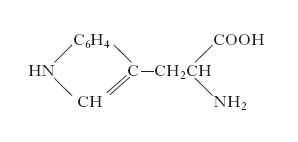
triptofano
triptofano Amminoacido aromatico, di
È uno degli elementi costitutivi della maggior parte delle molecole proteiche e ha notevole importanza nutrizionale. Il t. è un amminoacido essenziale e, insieme ai suoi precursori e ai suoi prodotti di degradazione, dà origine a vari prodotti biosintetici molto importanti, quali i coenzimi NAD e NADP, l’acido nicotinico, la serotonina, l’auxina, il gruppo prostetico dell’emoglobina e di altri pigmenti. Viene sintetizzato a partire dall’acido corismico, con una serie di passaggi che terminano con la reazione dell’indolo-3-glicerofosfato con un complesso piridossalfosfato-serina per formare t., trasformazione catalizzata dalla triptofanosintetasi, un tetramero bifunzionale α2β2, particolarmente interessante per la cooperazione operativa che esiste tra le sue subunità. Infatti, la subunità α (peso molecolare 29.000) taglia l’indolo-3-glicerofosfato generando indolo e gliceraldeide-3-fosfato, mentre quella β (peso molecolare 43.000) unisce l’indolo con la serina, formando t., in una reazione dipendente dal piridossalfosfato. La via di degradazione del t. è molto complessa e porta alla trasformazione di questo amminoacido in alanina e acetil-CoA.
La carenza di t. induce alterazioni del bilancio d’azoto correggibili solo con la somministrazione dello stesso t. e di un adeguato apporto degli altri amminoacidi essenziali. Principali fonti alimentari di t. sono il latte e i formaggi, l’avena, alcuni pesci, il cioccolato, le arachidi, le banane.
Si chiama triptofanasi l’enzima batterico che catalizza reversibilmente la scissione della catena laterale del t. con formazione di indolo, ammoniaca e acido piruvico. La triptofanasi di Escherichia coli è costituita da 4 subunità uguali (peso molecolare totale 220.000), ed è legata all’acido α-amminoacrilico, intermedio della reazione, tramite il piridossalfosfato, che agisce da coenzima.