transgenico
transgenico Si dice di organismo nel quale sono stati inseriti, per mezzo di tecniche di biologia molecolare, geni provenienti da un altro organismo di specie diversa, o eterologo. Il materiale genetico così modificato è definito DNA ricombinante. Si chiama invece transgene la sequenza nucleotidica di DNA esogeno introdotta ed espressa nelle cellule dell’organismo ospite, che diventa elemento permanente del patrimonio genetico ed è trasmessa alla progenie secondo le leggi di Mendel. Gli organismi t. possono essere sia procarioti sia eucarioti, appartenenti al regno animale e vegetale. Fanno parte degli OGM (➔), ossia piante, animali e microrganismi che possiedono una nuova combinazione di materiale genetico ottenuta artificialmente. Anche se molti autori usano le due espressioni come sinonimi, sono considerati OGM anche organismi in cui il materiale genetico endogeno è stato modificato per sottrazione o alterazione di alcuni elementi, oppure per inserzione di geni provenienti da organismi della stessa specie e che quindi non possono essere considerati transgenici.
Tecniche di trasferimento di geni
Prima dell’avvento delle tecnologie del DNA ricombinante (➔ biotecnologie), l’unica fonte di quantità cospicue di geni puri erano i virus; da quando sono stati disponibili i geni clonati è stato possibile microiniettarli nella linea germinale di animali per produrre organismi transgenici. I primi animali usati negli esperimenti sono stati Drosophila melanogaster e il topo. Per il topo la tecnica più comune consiste nella microiniezione di geni clonati nelle uova fecondate. Queste contengono due pronuclei, uno derivato dallo spermatozoo e l’altro dall’uovo, che si fondono per formare il nucleo dell’embrione allo stadio di singola cellula (zigote). Quando poche centinaia di copie del DNA estraneo sono iniettate in uno dei due pronuclei di un uovo fecondato, alcune di esse sono incorporate nei cromosomi dello zigote diploide; gli embrioni sono poi trasferiti nell’ovidotto di una madre adottiva, nel quale crescono e si differenziano. Circa il 10-30% della progenie murina conterrà il DNA estraneo in uguali quantità (fino a 100 copie per cellula) in tutti i tessuti, comprese le cellule germinali. Mediante l’immediato reincrocio (accoppiamento dei genitori con la loro prole), si riesce a produrre una certa quantità di organismi t. puri, omozigoti per il transgene. In Drosophila il DNA estraneo viene invece iniettato nella regione dell’embrione che darà origine alle cellule germinali, utilizzando come vettore l’elemento trasponibile P (➔ trasposone). La produzione di organismi t. mediante la microiniezione dei pronuclei fornisce utili informazioni, in quanto l’attività biologica del DNA iniettato può essere osservata in diversi tessuti; essa presenta tuttavia dei limiti, poiché i transgeni si inseriscono a caso nei cromosomi e non vi è alcun modo per controllare il sito della loro integrazione nel DNA.
Maggiore successo in questo campo si è ottenuto introducendo il DNA contenente parte di un gene, o un gene mutante, in una linea speciale di cellule staminali di topo derivate da un embrione, chiamate ES (embryonic stem), coltivate in vitro. Dopo un periodo di proliferazione cellulare, circa nell’1% delle colonie si verifica ricombinazione omologa; queste colonie, che conterranno sequenze di DNA ricombinante nelle quali il frammento inserito ha sostituito una copia del gene normale o una sua parte, vengono selezionate con vari metodi, identificate mediante PCR (➔) o southern blotting (➔ blotting) e iniettate in un embrione precoce di topo. Le cellule così trasformate vengono assimilate nella massa cellulare e prendono parte alla formazione di molti tessuti e dei gameti del nuovo individuo, il topo chimerico, che darà origine a figli con geni sostituiti (➔ knock out).
Applicazioni
Queste tecnologie di manipolazione genica sono importanti nella ricerca di base, per studi nei quali geni a funzione sconosciuta sono sostituiti nella linea germinale dai rispettivi mutanti; si può in tal modo conoscere la funzione del gene normale osservando i cambiamenti dovuti alla mutazione. Sono anche importanti per un loro potenziale impiego in terapie con le quali sarà possibile trattare non solo malattie ereditarie ma anche malattie acquisite, quali quelle cardiovascolari, i tumori e l’AIDS; la strategia è quella di fornire alle cellule geni che consentano loro di produrre sostanze di utilità terapeutica.
Fra le numerose utilizzazioni, si può citare l’impiego di topi t. in oncologia sperimentale. In essi, come nell’uomo, il processo di oncogenesi insorge mediante passaggi durante i quali il genoma di una o di poche cellule subisce una serie di mutazioni che comportano come risultato finale l’invasione dei tessuti circostanti e la metastatizzazione a distanza. In alcuni laboratori sono utilizzati topi t. per l’oncogene neu. L’oncogene neu, anche noto come oncogene c-erbB2, sembra coinvolto nella patogenesi del tumore umano alla mammella e la sua amplificazione porta a una maggiore malignità della neoplasia e alla tendenza alla formazione di metastasi. Tutte le femmine dei topi t. per neu presentano tumori nelle ghiandole mammarie con elevata riproducibilità: questi tumori crescono nel loro microambiente naturale a cui devono adattarsi per superare l’inibizione costituita dalle cellule dello stesso e di altri tessuti e dalle cellule del sistema immunitario, così come si verifica nel caso di un tumore umano. Anche nel topo si formano metastasi a distanza e pertanto è possibile valutare l’effetto delle terapie, oltre che sul tumore primario, anche sulle metastasi.
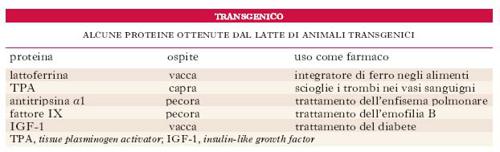
Le tecniche per ottenere topi t. sono state estese ad altri animali quali ratti, pecore, maiali, mucche e, dal 2001, anche alle scimmie. Un campo in grande sviluppo è specialmente quello che riguarda gli animali da allevamento. La capacità di modificare i caratteri degli animali da allevamento mediante introduzione di geni clonati potrebbe risultare molto utile per la zootecnia; un nuovo filone di ricerca si occupa infatti di ottenere proteine importanti sotto l’aspetto farmacologico nelle ghiandole mammarie di caprini, bovini e ovini. Questo approccio, chiamato molecular farming, può portare alla produzione di farmaci senza bisogno di sacrificare l’animale. Si è osservato che alcune proteine tendono a funzionare più correttamente quando sono espresse nei Mammiferi rispetto a quelle prodotte dai geni clonati nei batteri. Nella tab. sono indicate alcune proteine umane di interesse terapeutico prodotte da Mammiferi transgenici. La strategia sperimentale usata consiste nell’introdurre un gene umano in un animale in modo che la proteina codificata sia secreta nel suo latte. Nei Mammiferi alcuni geni, detti galattospecifici, sono espressi solo nella ghiandola mammaria: sono i geni che codificano i prodotti proteici secreti nel latte quali la β-galattoglobulina, la caseina, la proteina acida del siero del latte. Per ottenere l’espressione di una proteina umana nel latte di un animale da allevamento, il gene umano clonato viene legato al promotore e alle sequenze regolative di un gene galattospecifico. Il DNA così organizzato viene inserito per microiniezione in cellule uovo che sono poi impiantate nell’utero di madri vicarie. La progenie t. viene identificata mediante amplificazione del DNA cromosomico tramite la PCR. In questo modo la proteina codificata dal gene umano verrà espressa all’interno della ghiandola mammaria e secreta nel latte, dal quale può venire isolata (v. fig.).
Il primo passo per la formazione di un primate non umano t. è stato effettuato nel 2001, trasferendo negli ovociti della scimmia Rhesus un gene marcatore che codifica la proteina fluorescente naturale (GFP, green fluorescent protein) della medusa (➔ proteine).
Trasferimento di geni nelle piante
Le piante t. hanno trovato un’ampia diffusione; in America Settentrionale milioni di ettari sono coltivati a soia, mais, cotone e patate geneticamente modificati. I transgeni sono inseriti nelle piante con il metodo del DNA T (➔ Agrobacterium). Per es., i semi di soia t. contengono un transgene batterico che conferisce alla soia la resistenza contro un erbicida, il glifosato. Questo permette la più facile eliminazione delle erbe infestanti. La critica fondamentale rivolta a queste tecnologie di coltivazione riguarda gli effetti sulla salute umana; tra i rischi paventati vi sono le reazioni allergiche contro la proteina prodotta dal transgene; si teme inoltre che, data la resistenza della soia al glifosato, gli erbicidi possano essere usati in dosi molto alte, oppure che le piante t. possano sfuggire ai lotti confinati e introdurre il transgene nelle specie naturali affini creando una diffusa resistenza. Altre piante come il mais, il cotone e le patate contengono invece un transgene che le rende resistenti agli insetti nocivi. Sono stati identificati in un batterio (Bacillus thuringiensis) 96 geni codificanti proteine, chiamate tossine Bt, che provocano profonde lesioni all’intestino delle larve degli insetti. I geni che codificano le tossine Bt, introdotti nel genoma delle piante, conferiscono loro resistenza contro specifici insetti. Per es., uno di questi geni rende il mais resistente alla piralide, un parassita particolarmente devastante. La resistenza è specifica e non sembra avere effetti negativi sull’uomo e sugli altri Mammiferi e neppure sugli insetti non nocivi.
Un’area molto promettente riguarda l’agricoltura molecolare, equivalente al molecular farming precedentemente citato, che consiste nella coltivazione di piante t. contenenti prodotti importanti in campo sanitario, quali sostanze farmacologiche e vaccini. Le piante che producono vaccini potrebbero essere particolarmente rilevanti per i paesi in via di sviluppo, dato il loro costo ridotto e la facilità di somministrazione e di trasporto in aree remote senza bisogno di refrigerazione.