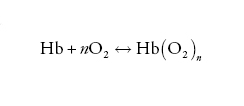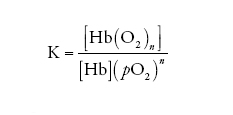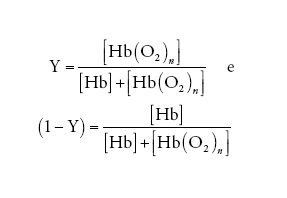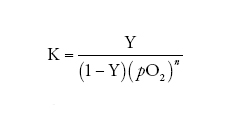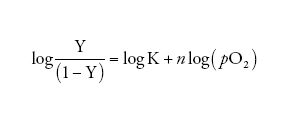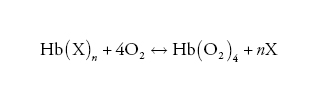Emoglobina
Emoglobina
L'emoglobina è una proteina che va incontro a una combinazione reversibile con l'ossigeno molecolare (O2): vale a dire che, in presenza di un'elevata pressione di questo gas, essa lega l'O2 presente nell'ambiente circostante, mentre in condizioni in cui questo gas è poco concentrato ‒ quali sono quelle che si incontrano nei capillari sanguigni dei tessuti periferici ‒ libera l'O2 che ha immagazzinato nei polmoni. Questa reazione chimica interessa direttamente una zona ristretta dell'intera molecola dell'emoglobina, detta 'eme': si tratta di una piccola compagine molecolare a sé stante (il cosiddetto 'gruppo prostetico'), costituita da uno ione ferroso, Fe(II), posto nel mezzo di una complessa struttura ciclica aromatica (la protoporfirina IX) che ha una configurazione planare ed è localizzata in una tasca nella porzione proteica dell'emoglobina. Il rapporto tra la massa dell'eme e quella della porzione proteica che lo avvolge è di circa 1 a 25.
Da un punto di vista strettamente semantico, 'emoglobina' è il termine generico che raggruppa una famiglia di emoproteine ampiamente diffuse in tutto il regno animale e in quello vegetale. La grande diffusione tassonomica testimonia l'estrema antichità del gene ancestrale di questa famiglia di proteine e fornisce inoltre una spiegazione semplice per le altre funzioni osservate, oltre a quelle del trasporto e dell'immagazzinamento dell'O2.
Nel linguaggio scientifico corrente, però, i vari membri di questa famiglia sono raccolti in classi più o meno ampie con un loro nome specifico. Così, per emoglobina s'intendono per lo più i trasportatori di O2 presenti nel sangue dei Vertebrati e degli invertebrati. Le emoproteine che trasportano e immagazzinano O2 nei muscoli striati e lisci vengono designate col nome di 'mioglobine'; in certe zone del cervello e del pancreas ci si imbatte poi nelle neuroglobine, mentre sono dette 'citoglobine' quelle emoproteine che ‒ uniche fra tutte ‒ trovano la loro localizzazione nel nucleo, invece che nel citoplasma, di gran parte delle cellule animali. Si ricordano infine le 'emoglobine troncate' (identificate negli eubatteri, nei cianobatteri e nelle piante superiori, ma non negli animali), un nome questo che si riferisce alla loro minore grandezza (ridotta del 20-30%) rispetto a quella delle emoglobine dei Vertebrati: a tale classe appartiene pure l'emoglobina presente nel Mycobacterium tubercolosis, che si cita per l'importanza che questa proteina riveste nell'espressione della patogenicità.
L'articolo è centrato principalmente sull'emoglobina umana, che circola nel sangue all'interno degli eritrociti, dove si trova a una concentrazione molto elevata (340 g/L ovvero 5,2 mM). Ogni eritrocita accoglie nel suo interno circa 300 milioni di molecole di emoglobina, ciascuna delle quali ha forma sferoidale con dimensioni assiali pari a 6,5×5,5×5 nm ed è separata dalle sue più strette vicine da una distanza media di circa 2 nm: è questa una situazione fisica che permette a ciascuna unità strutturale di ruotare sul proprio asse e di traslare lungo ogni direzione spaziale senza intralci. I concetti originatisi nelle ricerche sull'emoglobina umana sono stati trasferiti con successo alle altre emoglobine sia di Vertebrati che di invertebrati.
Caratteristiche strutturali
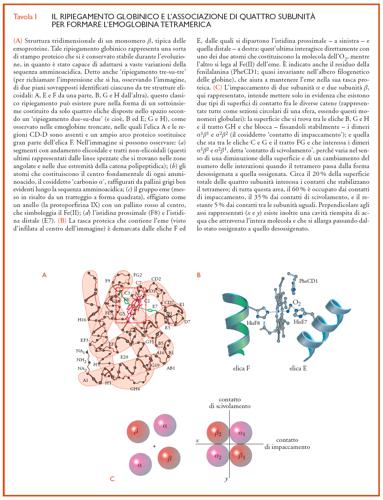
Costituita da quattro catene polipeptidiche (dette 'globine'), l'emoglobina umana ‒ come quella di tutti i Vertebrati ‒ è dunque una proteina tetramerica. Ogni tetramero, che ha una massa pari a 64.500 g/mole, consiste di due catene α (ciascuna di 141 amminoacidi) e due β (ciascuna di 146 amminoacidi); per tal motivo la molecola dell'emoglobina è spesso indicata con la sigla α2β2. Le catene α e β presentano differenti sequenze di amminoacidi, ma hanno un'architettura tridimensionale molto simile: infatti, sono ambedue costituite quasi esclusivamente da brevi avvolgimenti elicoidali che, ripiegandosi in varie direzioni, vengono ad assumere una configurazione spaziale del tutto caratteristica, individuata col nome di ripiegamento globinico (Tav. I). In particolare, ogni catena β è costituita da otto segmenti elicoidali (indicati per convenzione con lettere maiuscole dell'alfabeto da A ad H) e collegati da brevi tratti non-elicoidali denominati con le lettere dei due segmenti che da essi vengono uniti (per es., AB, CD e così via); inoltre, le porzioni non elicoidali presenti alle estremità dell'intera catena polipeptidica sono rappresentate con la sigla NA (nel caso del gruppo amminico-terminale) e HC (se si tratta dell'altra estremità, quella carbossilico-terminale). Le catene α possiedono una struttura spaziale molto simile a quella delle β, ma sono costituite solo da sette segmenti elicoidali, mancando dell'elica D. I singoli residui di amminoacidi sono spesso individuati anche entro ciascun segmento (sia elicoidale che non elicoidale) mediante numeri interi a partire dall'estremità della catena polipeptidica che ha il gruppo amminico libero (per es., A1, A2, CD1, EF7 ecc.). Pertanto, un residuo amminoacidico (generalmente rappresentato con il codice a tre lettere) presente in una globina viene identificato, per convenzione, in modo univoco in termini (a) della sua collocazione topologica nel segmento elicoidale o nel tratto non elicoidale in cui si trova, (b) della sua posizione (in genere indicata fra parentesi) lungo l'intera sequenza amminoacidica e (c) della catena a cui appartiene: così la sigla HisF8(87)α specifica l'amminoacido istidina (His) che, ottantasettesimo nella sequenza dei residui della catena α, si trova come ottavo residuo lungo l'elica F.
Ciascuna catena presenta sulla sua superficie esterna una stretta cavità posta fra le eliche E ed F ‒ la cosiddetta 'tasca dell'eme' ‒, dove è accolto appunto il gruppo prostetico (fig. I.A e fig. I.B) che conferisce al sangue il suo colore rosso. Lo ione ferroso Fe(II) dell'eme libero ‒ vale a dire non avviluppato in una globina ‒ reagisce con l'O2 in modo irreversibile, essendo rapidamente ossidato a Fe(III) in presenza di acqua; rimane invece nello stato ferroso quando la catena polipeptidica dell'emoglobina racchiude l'eme nella sua cavità idrofobica, proteggendolo dall'ambiente acquoso cosicché la sua reazione con l'O2 diventa reversibile. L'eme è unito alla globina mediante una ventina di interazioni deboli con le catene laterali degli amminoacidi più vicini e da un legame covalente fra il Fe(II) e l'atomo di azoto (Nε) del gruppo imidazolico dell'istidina F8, nota come 'istidina prossimale'; è proprio questo atomo di azoto che, donando una carica negativa, permette al metallo di formare un'interazione relativamente instabile con l'O2. La gran parte delle globine ‒ anche se non tutte ‒ hanno un altro residuo di istidina (HisE7, detta 'distale') dal lato dell'eme che si combina con i leganti; in genere, l'atomo Nε dell'istidina distale stabilisce un'interazione con l'O2 coniugato con l'eme(fig. I.B). L'insieme di una catena polipeptidica e un eme costituisce quel che è detto 'subunità' o 'monomero' o semplicemente 'catena dell'emoglobina tetramerica'. Sia le subunità α che quelle β hanno sulla superficie esterna alcune limitate zone idrofobiche, che favoriscono la loro associazione (fig. I.C) a formare il tetramero α2β2 (per la medesima legge che impone alle gocce d'olio in acqua di fondersi tra loro). Ciascuna delle due catene uguali è per convenzione distinta dall'altra da un esponente (α1 e α2, β1 e β2), che permette di precisare la sua localizzazione relativa nel tetramero. Le superfici di contatto tra le subunità diverse (cioè, tra le α e le β) sono ampie, mentre tra catene uguali (vale a dire, tra le sole α o tra le sole β) le connessioni sono in numero piuttosto limitato.
Componenti dell'emoglobina negli eritrociti
Oltre al tipo predominante di emoglobina (quello cioè indicato con la sigla α2β2 o, molto spesso, con il simbolo HbA, dove Hb vale come emoglobina e la A sta per adulto), gli eritrociti umani contengono quasi di regola altri componenti emoglobinici, sia come prodotto di geni specifici sia come risultato di modificazioni strutturali dovute a legami forti con costituenti chimici presenti nell'ambiente intraeritrocitario. Fra i componenti minori che hanno un'origine genetica si citano l'HbA2 e l'HbF (emoglobina fetale), ambedue costituiti da subunità α normali associate a catene che hanno una sequenza amminoacidica significativamente differente da quella delle subunità β e perciò indicate con simboli differenti: queste catene, diverse dalle α, sono designate come δ (nel caso dell'HbA2, un'emoglobina spesso indicata con la sigla α2δ2) e come γ (l'HbF, o anche α2γ2). Nel primo periodo della vita intrauterina, poi, si trovano negli eritrociti umani emoglobine embrionali che utilizzano catene ζ (che sono di tipo α) e catene ε (che ricordano da vicino le subunità β), e precisamente: l'Hb Gower-1, di composizione ζ2ε2; l'Hb Gower-2, ovvero α2ε2; e l'Hb Portland o ζ2γ2.
Molte piccole molecole sono in grado di formare addotti covalenti con ognuno di questi tipi di emoglobina: qualche addotto (per es., quello dell'HbA con il glucosio o con alcuni suoi derivati) può anche riflettere perturbazioni del metabolismo oppure rendere manifesta l'introduzione di farmaci nell'organismo (l'addotto dell'emoglobina con la penicillina ne è un esempio). L'HbAIc, vale a dire l'emoglobina dell'adulto con alcune molecole di glucosio legate in modo covalente, è tra i componenti emoglobinici minori quello più abbondante (4% del totale nei soggetti normali, valore che può raggiungere anche il 15-20% in diabetici non trattati). Nei pazienti con insufficienza renale infine si osserva una notevole percentuale di gruppi amminico-terminali delle catene α e β bloccati con il cianato (che si libera dall'urea, scarsamente eliminata a causa del danno renale).
Derivati con leganti sul gruppo eme
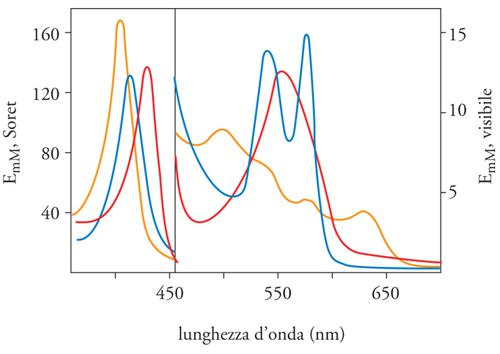
Quando l'emoglobina non ha alcun legante sull'eme è detta 'desossiemoglobina' (Hb). Numerosi sono i leganti che possono combinarsi reversibilmente con il Fe(II) dell'eme (tra cui l'O2, il monossido di carbonio CO e l'NO) in un rapporto stechiometrico di 1 a 1; ogni volta che si forma uno di questi legami si ha una riorganizzazione della distribuzione spaziale degli elettroni dell'eme, accompagnata da un'ampia modificazione delle proprietà spettrali (fig. 2) dell'emoglobina. Così, il colore rosso violetto della desossiemoglobina diventa rosso scarlatto in presenza di O2 (HbO2 è convenzionalmente il simbolo del derivato ossigenato) e l'intensità di quest'ultima tonalità di colore si modifica in proporzione alla quantità di O2 combinato con gli emi. E dunque, facendo uso delle proprietà spettrali si può misurare sia in vitro sia in vivo la percentuale di emoglobina legata all'O2.
Il Fe(II) degli emi, in vitro, va gradualmente incontro a un processo spontaneo di ossidazione divenendo Fe(III): nel derivato che si viene così a formare, noto come metaemoglobina (o emoglobina ferrica), una molecola di H2O rimpiazza l'O2 come legante dell'eme; tant'è che la metaemoglobina è del tutto incapace di trasportare O2. L'accumulo della forma meta, in vivo, è per lo più impedito da un sistema enzimatico intraeritrocitario che riporta gli emi ossidati al loro stato ferroso; si possono tuttavia verificare situazioni patologiche in cui la quantità di metaemoglobina è nettamente superiore a quella normale (〈3%). La molecola di H2O associata al Fe(III) può essere sostituita da vari leganti specialmente anionici, tra cui il cianuro (CN−) ed il fluoruro (F−).
Proprietà funzionali all'equilibrio
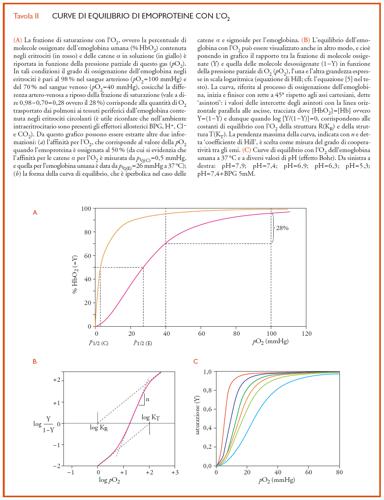
La capacità di trasportare O2 in modo ciclico, tra i polmoni e i tessuti periferici, trova una precisa rappresentazione grafica nella curva di equilibrio dell'emoglobina con l'O2, in cui la percentuale di emi che sono coordinati con questo gas (la cosiddetta 'frazione di saturazione') è misurata in funzione della pressione parziale di O2 (pO2). Curve tipiche di questo processo sono riportate nella Tav. II, dove è possibile osservare ‒ tra l'altro ‒ la differenza di forma tra quella propria dell'emoglobina e quella caratteristica delle emoproteine monomeriche (quali, per es., le subunità α o la mioglobina). La curva di queste ultime è iperbolica, come ci si aspetta per la combinazione di un singolo eme (avviluppato da una singola catena polipeptidica) con una sola molecola di O2: nella parte iniziale ‒ quando tutte le molecole proteiche sono nello stato desossigenato ‒ la curva è molto ripida (in quanto tantissime subunità competono tra loro per poche molecole di O2, che vengono perciò subito tutte legate), ma si appiattisce sempre più verso la fine del processo, quando le emoproteine monomeriche presenti nello stato desossigenato sono così poche che solo un'alta pressione di O2 le può portare a saturazione.
Nel caso dell'emoglobina (e dunque di un tetramero che ha quattro emi per molecola) la forma della curva di equilibrio è molto più complessa: essa sale lentamente nello stadio iniziale ‒ indicando che le molecole di desossiemoglobina mostrano una sorta di inerzia a legare la prima molecola di O2 ‒ ma poi il comportamento è simile a quello delle subunità isolate, diventando la curva dapprima molto ripida e infine appiattendosi. Questa forma sigmoide sta a significare che, man mano che aumenta il numero di molecole di O2 legate a un tetramero, s'innalza anche l'affinità per l'O2 dei rimanenti emi (fino a diventare simile a quella delle catene isolate) e dunque che esiste una sorta di comunicazione tra i gruppi prostetici presenti in ciascun tetramero: un tal fenomeno, che è chiamato 'cooperatività' o 'interazione tra gli emi', riflette una serie complicata di eventi per cui ‒ subito dopo essersi combinato con due molecole di O2 ‒ un tetramero tende a saturarsi legandone subito altre due (come avviene nei polmoni) mentre, da una prospettiva opposta, il tetramero che perde un paio di molecole di O2 libera senza intralci anche le altre che trasporta (come succede a livello dei tessuti periferici).
Un modo utile per analizzare i dati sperimentali è basato sul seguente schema:
[1] formula
la cui costante di equilibrio K assume la forma:
[2] formula
dove le parentesi quadre indicano la concentrazione della specie chimica simboleggiata nel loro interno e pO2 è la pressione parziale dell'O2. Se la percentuale di emi ossigenati e quella di emi desossigenati vengono così definite:
[3] formula
allora, dalla [2] e dalla [3] si ottiene:
[4] formula
ovvero, in termini logaritmici (la cosiddetta 'equazione di Hill'):
[5] formula.
La relazione [5] non ha un significato fisico diretto ma, con una scelta adatta dei valori di n e di K, è possibile descrivere accuratamente i risultati sperimentali con due soli parametri: (a) il coefficiente di Hill n (che corrisponde alla pendenza della curva nel grafico di Hill, quando Y=0,5, e che normalmente vale ∼3; fig. II.B), che dà espressione quantitativa alla forma della curva di equilibrio con l'O2 e dunque misura la cooperatività tra gli emi, e (b) il valore di pO2 richiesto per ossigenare la metà degli emi presenti nella soluzione di una emoproteina (ovvero p1/2, cioè il valore di pO2 quando Y=0,5). A tal proposito, si osservino le due curve riportate nella fig. II.A che differiscono tra loro non solo per la forma, ma anche per la posizione lungo l'asse delle ascisse, ovverosia per il valore del p1/2: tanto più la curva è spostata verso destra e dunque tanto maggiore è il valore di p1/2, tanto più bassa è l'affinità per l'O2 misurata da K (equazione [4]).
L'affinità per l'O2 e il coefficiente di Hill dell'emoglobina sono modulati dalla concentrazione di vari fattori che si trovano negli eritrociti: gli ioni idrogeno (H+, il cui livello è per lo più misurato in termini di pH), l'anidride carbonica (CO2), gli ioni cloruro (Cl−) e il 2,3-bisfosfoglicerato (o BPG, un intermedio del catabolismo del glucosio particolarmente concentrato negli eritrociti). Tutte queste specie chimiche sono note collettivamente come leganti eterotropici (in quanto si vanno a legare a siti diversi dall'eme, ma influenzano pur sempre la sua reattività) o anche come effettori allosterici (cioè, molecole capaci di modulare la conformazione dell'emoglobina e, tramite questa, la reattività degli emi). Aumentando la concentrazione di uno qualsiasi di questi leganti non-emici, si ha uno spostamento della curva di equilibrio con l'O2 verso destra, vale a dire verso una minore affinità per l'O2, rendendo allo stesso tempo la forma della curva più sigmoide (fig. II.C). Se gli H+ (come tutti gli altri leganti eterotropici sopra ricordati) abbassano l'affinità dell'emoglobina per l'O2, di necessità la presenza di questo gas sulla proteina deve far diminuire l'affinità dell'emoglobina per gli H+ (e in genere per tutti i leganti eterotropici): per cui, la cessione di O2 nei capillari venosi fa sì che l'emoglobina leghi a livello dei tessuti periferici H+, CO2, Cl− e BPG (il processo inverso, cioè il caricamento di O2 e la sincrona cessione all'ambiente circostante degli effettori allosterici, avviene nei capillari polmonari). Al valore fisiologico del pH, all'incirca due H+ sono legati dall'emoglobina per ogni quattro molecole di O2 cedute ai tessuti, e due H+ sono invece liberati dalla proteina a livello dei polmoni per ogni quattro molecole di O2 che vengono caricate: in quest'azione reciproca consiste l'effetto Bohr, cioè la modulazione dell'affinità per l' O2 da parte del pH.
Una tale relazione di accoppiamento tra emoglobina e leganti eterotropici (X) ha validità generale e può essere espressa in modo schematico come segue:
[6] formula.
Meccanismo della cooperatività
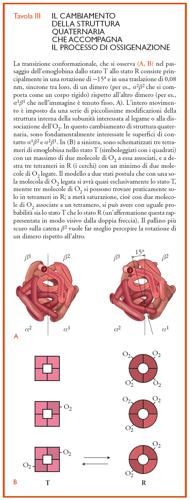
Numerosi modelli sono stati proposti per spiegare le basi strutturali della cooperatività. Tra questi, il modello a due stati ‒ detto anche modello MWC, dalle iniziali dei cognomi di coloro che lo hanno proposto nel 1965 (Jacques Monod, Jeffries Wyman e Jean-Pierre Changeux) ‒ ha avuto e ha tuttora un'ampia diffusione anche per la semplicità della sua formulazione. L'idea centrale è che l'affinità per l'O2 sia determinata dalla disposizione spaziale delle subunità nel tetramero (detta 'struttura quaternaria'; Tav. III), piuttosto che dal numero di molecole di questo gas già presenti sull'emoglobina. Il modello a due stati assume un equilibrio fra due sole strutture quaternarie alternative: una, con legami più deboli e in numero minore fra le quattro subunità, che viene indicata con R (per ricordare una certa rilassatezza delle tensioni all'interno della matrice proteica); e un'altra, con interazioni molto più numerose e più energetiche tra le unità monomeriche, detta T (perché caratterizzata da maggiori tensioni). Nello stato R (o stato con alta attrazione per i leganti dell'eme), l'emoglobina mostra un'elevata affinità per l'O2 che viene legato strettamente da ognuno dei quattro gruppi prostetici; tale proprietà è invece molto smorzata, sebbene non del tutto annullata, nello stato T (o stato a bassa affinità per i leganti dell'eme). Lo stato T tuttavia interagisce molto più fortemente dello stato R con gli effettori allosterici (H+, Cl−, BPG, CO2).
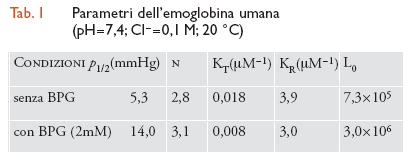
La transizione tra le due forme quaternarie, R┤T, consiste in un processo di tipo 'tutto o nulla', ovverosia: (a) da un punto di vista strutturale, la simmetria del tetramero è sempre conservata ed è o R o T (vale a dire, che non possono esistere stati ibridi come RT; Tav. III); e (b) da un punto di vista funzionale, l'affinità per l'O2 rimane costante e uguale per tutte e quattro le subunità in un dato tetramero (ugualmente alta nel caso di R e ugualmente bassa per T). Piccole modificazioni della conformazione delle singole subunità (cioè, cambiamenti della struttura terziaria) sono accoppiate con il processo di ossigenazione di ogni catena entro una data struttura quaternaria, cosicché stati intermedi di ossigenazione (quali, lo stato T con una o due molecole di O2 legato o lo stato R con meno di quattro molecole di O2 associate) avranno conformazioni localmente differenti da quelle, rispettivamente, dello stato T totalmente privo di leganti sugli emi e dello stato R completamente ossigenato. Il modello a due stati però afferma che queste piccole differenze della struttura terziaria di una singola catena non sono trasmesse alle subunità contigue, per cui non viene affatto alterata la loro affinità intrinseca per l'O2, ma viene influenzata solamente la stabilità relativa dei due stati quaternari. Sebbene il processo di combinazione dell'O2 con i quattro emi di un tetramero ‒ che si trova nello stato T o nello stato R ‒ non sia cooperativo, la transizione dalla struttura T (a bassa affinità) alla struttura R (ad alta affinità) impone un brusco aumento dell'affinità per l'O2 (di qualche centinaio di volte; tab. 1) per cui la curva di equilibrio s'impenna diventando sigmoidea: questa trasformazione avviene quando una seconda o una terza molecola di O2 si combina con l'emoglobina nello stato T (Tav. III).
Il modello MWC permette di descrivere l'insieme di tutti questi eventi con tre soli parametri indipendenti: le due costanti di associazione dell'O2 con la proteina nello stato a bassa affinità (KT) e in quello ad alta affinità (KR) (alcune volte espresse in termini del loro rapporto c=(KT/KR), e il rapporto delle concentrazioni dei due stati quaternari in totale assenza di leganti (un'assunzione espressa dal suffisso zero dei vari simboli), L0=[T]0/[R]0, il cui valore finito (∼106) sta a indicare che anche in queste condizioni lo stato R è presente (seppure in quantità bassissime). Aggiungendo BPG in un rapporto equimolare con l'emoglobina tetramerica (cioè, imitando in vitro la condizione che si ritrova normalmente dentro gli eritrociti), viene spostato l'equilibrio in favore della struttura T (in quanto essa ha una maggiore affinità per gli effettori allosterici rispetto a R), con il conseguente aumento del valore di L0 (tab. 1); il medesimo effetto può essere ottenuto abbassando il pH o aumentando la concentrazione di CO2 o di Cl−. Inoltre, il valore di KT diminuisce incrementando le attività di H+, Cl−, CO2 e/o BPG, tutte specie chimiche che hanno scarso effetto su KR. In condizioni che ricordano quelle fisiologiche (pH 7,4; Cl− 0,1 M; BPG 2 mM), solo un tetramero su 3 milioni possiede la struttura R in assenza di O2, e solo 1 ogni 15.000 ha la struttura T a completa saturazione con questo legante dell'eme. La tab. 1 elenca i valori dei parametri che illustrano l'interpretazione degli effetti cooperativi in termini del modello MWC (fig. II.C).
Aspetti strutturali della cooperatività
In ognuna delle quattro subunità che formano un tetramero nello stato R, il Fe(II) giace sul piano della porfirina, se è combinato con l'O2; è invece spostato in modo apprezzabile verso l'istidina prossimale, a cui è legato covalentemente, se il tetramero si trova nello stato desossigenato. Il movimento del Fe(II) verso l'istidina prossimale, che accompagna la cessione dell'O2, si trascina appresso gli appigli atomici che il metallo possiede con l'anello del gruppo prostetico, il quale per tal motivo assume una configurazione a cupola. In seguito all'ossigenazione di una sola subunità entro lo stato T, il Fe(II) si muove verso la porfirina senza però riuscire a disperdere le molteplici tensioni presenti nella matrice proteica; e anzi, la traslazione del metallo ‒ non accompagnata dal rilassamento del gruppo prostetico che continua a rimanere arcuato ‒ sfocia nella produzione di ulteriori tensioni all'interno della proteina, in quanto l'eme ‒ a causa dei numerosi vincoli che lo fissano al suo intorno proteico ‒ non riesce ad adottare completamente la geometria ottimale (vale a dire, planare) che assume quando tiene legato l'O2 nello stato R. Per accogliere facilmente nella conformazione quaternaria dell'emoglobina tutte le modificazioni locali (cioè della struttura terziaria) che sopraggiungono come conseguenza dell'ossigenazione di due o tre subunità in uno stesso tetramero (compreso il movimento traslazionale dell'istidina prossimale che trascina l'elica F, a cui è ancorata), deve cambiare l'orientamento relativo delle due coppie di dimeri α1β1 e α2β2: e dunque deve avvenire la transizione T→R (Tav. III).
Com'è noto, gli effettori allosterici abbassano l'affinità per l'O2 dell'emoglobina: da un punto di vista meccanicistico, questo avviene per la formazione di ulteriori interazioni, anche nella matrice proteica, che stabilizzano la struttura T. In particolare, il BPG (che trasporta cariche negative sulla sua molecola) si lega mediante una forte attrazione elettrostatica con gli otto gruppi caricati positivamente, che delimitano la cavità centrale del tetramero dove si trovano le catene β.
Varianti genetiche e basi strutturali delle malattie molecolari dell'emoglobina
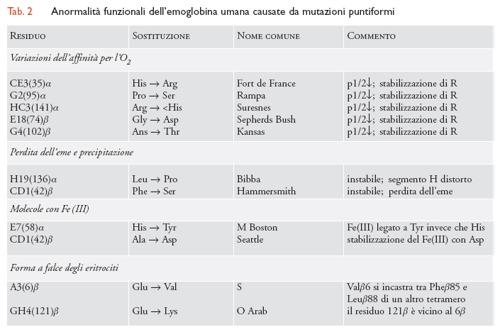
Parecchie centinaia di mutanti dell'emoglobina umana (927 al 2005) sono state isolate e caratterizzate da un punto di vista biochimico: le varianti delle subunità α rispetto a quelle delle subunità β sono all'incirca in un rapporto di 1 a 2. Nella maggior parte dei casi, l'anormalità strutturale consiste nella sostituzione di un solo residuo amminoacidico per dimero αβ (le cosiddette 'mutazioni puntiformi'), un fatto questo che trova spiegazione nella sostituzione di una singola base in uno dei geni delle globine, presenti nel DNA. Inoltre, alcune emoglobine anormali hanno inserzioni o delezioni all'interno della catena polipeptidica di una subunità (193 varianti); in altri casi, le subunità hanno le estremità più corte o più lunghe delle normali (12 varianti); è stata inoltre descritta la fusione di segmenti di due diverse subunità a costituire una catena del tutto nuova (9 varianti); e infine sono state identificate subunità caratterizzate dalla presenza di più di una mutazione puntiforme in una medesima catena polipeptidica (15 varianti). Alcune basi di dati delle varianti dell'emoglobina sono continuamente aggiornate in rete .
Di tutti i mutanti noti dell'emoglobina umana, una significativa frazione presenta effetti dannosi per la salute (tab. 2). I sintomi più frequenti sono stati associati a: (a) alterazioni dell'affinità per l'O2 (che produce policitemia quando aumenta, o cianosi se diminuisce); (b) una ridotta stabilità della proteina (che, precipitando dentro gli eritrociti, determina aggregati di emoglobina denaturata detti 'corpi di Heinz' e favorisce l'emolisi); (c) un'aumentata tendenza a produrre metaemoglobina (che si manifesta clinicamente con cianosi); (d) una polimerizzazione intraeritrocitaria (che modifica la forma a disco degli eritrociti, rendendoli in prevalenza simili a una falce e rigidi; quest'ultima proprietà tende a impedire il loro normale passaggio nella rete capillare, per cui possono prodursi blocchi transitori o permanenti della circolazione sanguigna locale; tab. 2). Dal punto di vista dell'associazione tra i sintomi clinici e la localizzazione della mutazione nella struttura proteica, si osserva che la massima parte delle emoglobine mutanti presentano anormalità che interessano amminoacidi interni alla matrice proteica e in particolare: (a) nelle vicinanze della tasca dell'eme, cosicché il gruppo prostetico è legato meno fortemente e di conseguenza si distacca dalla globina che diventa instabile e precipita; (b) a livello dell'interfaccia α1β2, che è quella importante nelle transizioni quaternarie che governano l'affinità per l'O2 e la cooperatività tra gli emi. Pochissime varianti patologiche, tra cui la più diffusa ‒ l'HbS ‒ e che determina l'anemia falciforme, presentano la sostituzione amminoacidica sulla superficie proteica (nel caso dell'HbS, il residuo di glutammato in posizione A3(6) β è rimpiazzato da un amminoacido idrofobico, una valina; tab. 2).
Cenni sull'evoluzione molecolare
In quella che si ritiene la forma più antica di vita, gli Archaea (archei), sono state trovate emoproteine (costituite da 195 amminoacidi e dunque più lunghe delle subunità delle emoglobine dei Vertebrati) che possono essere considerate dirette discendenti di un unico progenitore globinico ‒ un'ipotetica protoglobina ‒ e allo stesso tempo i primi antenati delle attuali globine. Capaci di legare numerosi gas ‒ anche tossici ‒ presenti nell'atmosfera primitiva (come NO, CO, H2S e O2; la comparsa di quest'ultimo nell'aria si fa risalire a 1000-2000 milioni di anni fa), si ritiene che le emoproteine isolate dagli Archaea abbiano inizialmente svolto solo la funzione di sensori e/o di detossificanti di questi gas. Infatti, almeno per quanto riguarda l'O2, è molto dubbio che queste emoproteine ‒ che possiedono elevate velocità di autossidazione (3-4 min) e lunghissimi tempi di riduzione ‒ possano aver operato in ambienti con elevata concentrazione di O2. Perciò, quando il contenuto di O2 nell'atmosfera aumentò fino a raggiungere gli attuali livelli, le emoproteine contenute negli Archaea dovettero duplicarsi e mutare per divenire capaci di trasportare e immagazzinare in modo reversibile ed efficiente questo gas in un mondo immerso nell'O2. Alcune stime suggeriscono che la prima duplicazione del gene della globina degli Archaea si possa far risalire a 800 milioni di anni fa, quando si svilupparono due differenti tipi di globina: la neuroglobina (un antico tipo di globina correlato alle globine presenti nei nervi degli invertebrati) e la cosiddetta 'globina cellulare' (un termine un po' ingannevole per riferirsi all'antenato comune a tutte le emoglobine, mioglobine e citoglobine). È dal gene di quest'ultima globina che si ebbe infatti la divergenza fra il gene originario dell'emoglobina da una parte, e quello della mioglobina e della citoglobina dall'altra (un evento che, nel pensiero evoluzionistico, è da correlarsi all'aumento della massa corporea e allo sviluppo di un efficiente apparato circolatorio). Successivamente, dal gene originario dell'emoglobina si duplicarono quelli delle globine α e β (un accadimento che fu parallelo alla loro separazione in differenti cromosomi ‒ cromosoma 11 per le catene β, e cromosoma 16 per le α ‒, come si può osservare negli Uccelli e Mammiferi); 50-100 milioni di anni fa, poi, l'originario gene α si duplicò in α1, α2 e ζ, con la comparsa dei Rettili; a sua volta, l'originario gene β si differenziò in β, γ, δ ed ε.
L'analisi delle sequenze note (>300) dimostra che la divergenza è stata fondamentalmente vincolata dalla necessità di conservare quasi del tutto l'idrofobicità dei residui presenti dentro la matrice globinica e necessari a proteggere l'eme dal contatto con l'acqua e dunque a stabilizzare la forma ossigenata. I cambiamenti sulla superficie, invece, sono stati frequenti e si mostrano con una molteplicità di strutture quaternarie, come alcune di quelle caratteristiche delle emoglobine degli invertebrati e che tuttavia mantengono perfettamente la capacità di legare l'O2 in modo cooperativo. Se poi si paragonano i membri della famiglia delle globine limitandosi a quelle dei Vertebrati, il numero dei residui che risultano invarianti è relativamente alto. Per la precisione, sono 27 questi amminoacidi nelle subunità α e 18 nelle β (un calcolo questo basato su 32 specie diverse), la massima parte dei quali localizzati in posizioni fondamentali per un efficiente trasporto dell'O2: 14 si trovano nell'intorno degli emi; 16 nelle superfici di contatto che governano il meccanismo allosterico (α1β2 e α2β1); 8 all'interno della matrice proteica o nelle interfacce α1β1 e α2β2.
È stato stimato infine che i cambiamenti del gene originario dell'emoglobina si siano accumulati a una velocità media di un residuo per subunità α o β ogni 2-3 milioni di anni. Tale affermazione è perfettamente congrua con l'osservazione che nelle catene β vi sono 8 differenze tra Homo sapiens e Macaca, 24 tra uomo e mucca, 45 tra uomo e gallina, 91 tra uomo e squalo e che le catene α umane sono identiche a quelle dello scimpanzé, ma presentano 18 differenti amminoacidi su 141 nel cavallo, 35 nella gallina, 62 nel tritone (un anfibio), 68 in un pesce con lische (la carpa) e 79 nello squalo.
Bibliografia
Amiconi, Brunori 2005: Amiconi, Gino - Brunori, Maurizio, Hemoglobin, in: Encyclopedia of molecular cell biology and molecular medicine, edited by Robert A. Meyers, 2. ed., Weinheim, Wiley-VCH, 2004-2005, 16 v.; v. VI, 2005.
Burmester 2004: Burmester, Thorsten e altri, Neuroglobin and cytoglobin: genes, proteins and evolution, "IUBMB life", 56, 2004, pp. 703-707.
Eaton 1999: Eaton, William A. e altri, Is cooperative oxygen binding by hemoglobin really understood?, "Nature structural biology", 6, 1999, pp. 351-358.
Perutz 1998: Perutz, Max F. e altri, The stereochemical mechanism of the cooperative effects in hemoglobin revisited, "Annual review of biophysics and biomolecular structure", 27, 1998, pp. 1-34.