autoimmunità
autoimmunità Reazione immunitaria dell’organismo verso propri componenti a causa della perdita della tolleranza immunitaria naturale; ciò può accadere a causa della cessazione della repressione che impedisce alle cellule immunocompetenti di reagire contro componenti dello stesso organismo o a causa di alterazioni di cellule che l’organismo non riconosce più come proprie. Con fenomeni autoimmunitari viene oggi interpretata la patogenesi di numerose malattie autoimmuni: malattie del sistema emopoietico (anemia emolitica, granulocitopenia, porpora trombocitopenica), del connettivo (lupus eritematoso sistemico, artrite reumatoide, sindrome di Sjögren), del sistema endocrino (tiroidite di Hashimoto, ipocorticosurrenalismo idiopatico, azoospermia), del canale digerente (gastrite cronica atrofica, colite ulcerosa), del fegato (epatite cronica attiva, cirrosi biliare primitiva), del rene (glomerulonefriti e glomerulonefrosi), del sistema nervoso (encefalopatie demielinizzanti, myasthenia gravis) e dell’occhio (uveite facoanafilattica).
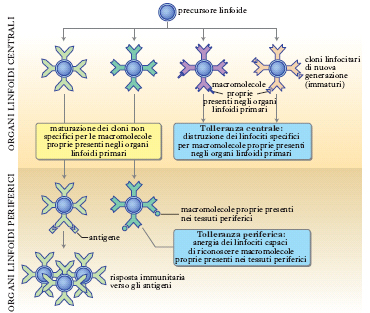
La funzione del sistema immunitario è quella di individuare le molecole estranee all’organismo (antigeni) e di attivare le difese idonee a eliminare sia queste, sia i microrganismi invasori che le producono. Le fondamenta della risposta immunitaria specifica, realizzata dai linfociti T e B, richiedono che il sistema immunitario sia in grado di distinguere le macromolecole proprie da quelle estranee. Durante lo sviluppo e la maturazione dei linfociti viene elaborato un vero e proprio iter conoscitivo, secondo il quale il sistema immunitario impara, riconoscendole, a convivere con le macromolecole presenti nell’organismo al quale appartiene (tolleranza), conservando e ampliando la capacità di reagire contro le molecole estranee. Malgrado l’esistenza di malattie organospecifiche che hanno diversa espressione clinica, oggi si tende a stabilire un’interpretazione patogenetica del danno su base unitaria. Il primo passo consiste nell’attivazione di linfociti T potenzialmente auto-reattivi. Questi sono ‘naturalmente’ presenti nell’organismo in quantità esigue; in fase quiescente all’interno del sistema linfatico non provocano danno in condizioni fisiologiche. Se particolari cellule note come APC, antigen presenting cells, si combinano con un auto-antigene, lo possono esporre ai cloni T autoreattivi. In tal modo i linfociti T, grazie anche all’intervento di citochine (➔), possono proliferare e volgere l’espansione clonale in senso Th1. Sembra che una forte espansione dei linfociti Th1 sia all’origine del salto di qualità che consente a una ‘normale’ reazione autoimmunitaria di trasformarsi in evento patologico istolesivo. Ne consegue un insieme di fenomeni che comporta un’azione citotossica da parte di linfociti T CD81 che esplicano autoreattività citotossica sulle cellule dell’organo bersaglio. D’altro canto una funzione helper che stimoli cloni B autoreattivi ad andare incontro a proliferazione comporta un meccanismo parallelo di differenziazione cellulare con genesi di autoanticorpi potenzialmente patogeni.
Poiché la tolleranza esercitata da organi centrali può difficilmente operare l’eliminazione di cloni T autoreattivi nei confronti di antigeni di differenziazione espressi da cellule di organi periferici, i cloni potenzialmente reattivi, che lasciano il timo e raggiungono la periferia, devono essere controllati dalla tolleranza periferica. Quest’ultima differisce comunque da quella centrale per il meccanismo della sua genesi: i cloni T autoreattivi non sono distrutti dai meccanismi della tolleranza periferica ma sono sostanzialmente inattivati. Il meccanismo di inattivazione (anergia) permette la sopravvivenza di cloni di linfociti T potenzialmente a rischio ma li rende incapaci di reagire nei confronti degli antigeni. La comprensione dei meccani;smi che conducono alla tolleranza periferica (fig.) è di straordinaria importanza; infatti la loro identificazione potrebbe spiegare non solo la genesi di numerose malattie autoimmuni (rottura della tolleranza e sopravvento di cloni autoreattivi), ma anche il motivo per cui il sistema immunitario sembra ignorare la presenza di cellule neoplastiche nelle quali, a causa della trasformazione maligna, sono verosimilmente presenti proteine mutate e quindi peptidi diversi dal self.
Si dà il nome generico di autoimmunoemopatie alle emopatie dovute a un processo autoimmunitario: autoimmunoeritropatie (provocate dalla comparsa di autoanticorpi attivi contro i globuli rossi), autoimmunoleucopatie (da autoanticorpi attivi contro i leucociti), autoimmunotrombocitopatie (da autoanticorpi attivi contro le piastrine).