proteosoma
In biologia, particella citoplasmatica multiproteica a forma di cilindro, all’interno della quale avviene la degradazione sia delle proteine anormali, non correttamente assemblate o contenenti amminoacidi ossidati, sia di quelle normali la cui concentrazione deve essere accuratamente regolata per potere cambiare rapidamente in seguito ai cambiamenti dello stato della cellula. Con la modificazione della situazione ambientale, infatti, l’espressione del gene può diventare inutile o controproducente e pertanto la cellula ne disattiva la trascrizione o la traduzione; tuttavia è anche necessario eliminare, in modo selettivo e rapido, il prodotto del gene (la proteina) già presente nella cellula. Questo si attua attraverso una via di degradazione mediante i p., strutture di grandi dimensioni disperse in molte copie in tutta la cellula, le cui componenti proteiche costituiscono circa l’1% di tutte le proteine cellulari.
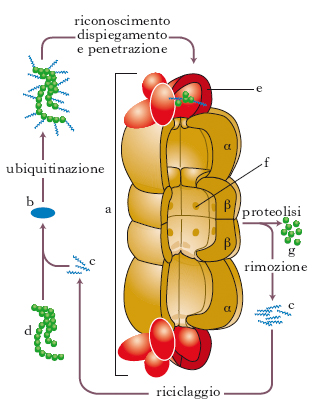
Il p. (v. .) è costituito da 4 dischi proteici sovrapposti, ciascuno formato da 7 subunità, differenti ma omologhe nei p. eucariotici e identiche fra loro in quelli procariotici. I 4 dischi formano un cilindro cavo nel quale le subunità periferiche (tipo α) delimitano un foro centrale ristretto, mentre quelle centrali (tipo β) delimitano un foro centrale di dimensioni maggiori, così che la cavità all’interno del cilindro comunica con l’esterno mediante due aperture molto più strette rispetto al resto della cavità. Altre 2 strutture a forma di anello, composte da un numero variabile di proteine diverse tra loro, si trovano giustapposte al nucleo centrale. Le subunità del nucleo centrale sono dotate di attività proteolitica, quelle periferiche hanno attività ATPasica, che fornisce energia al sistema. Il processo di degradazione deve essere specifico: devono entrare nel p. per essere degradate solo le proteine giuste, al momento giusto. Questa specificità di azione si basa su un meccanismo di modificazione dei bersagli, in modo che il p. possa riconoscerli e degradarli. Oltre all’attività ATPasica, infatti, i 2 anelli periferici hanno siti di legame specifici per l’ubiquitina, piccola molecola stabile che gioca un ruolo essenziale nella specificità di azione del proteosoma. La proteina da degradare viene riconosciuta da un enzima, detto enzima ubiquitinante, che lega l’estremità carbossilica di varie molecole di ubiquitina a residui di lisina in modo che il bersaglio assuma un aspetto ramificato. La proteina modificata viene riconosciuta dalla parte periferica del p., che si ritiene determini anche il dispiegamento delle catene amminoacidiche da degradare, in modo che esse possano penetrare all’interno del nucleo centrale dove avviene la proteolisi. Contemporaneamente l’ubiquitina viene rimossa per etichettare altre proteine che devono essere eliminate.