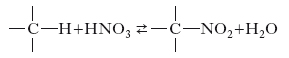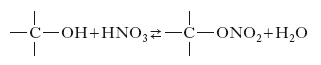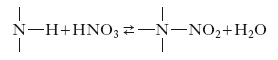nitrazione
Processo fra i più importanti nell’ambito dell’industria chimica che consiste nell’introduzione in un composto organico di uno o più nitrogruppi −NO2. Si distinguono tre diversi tipi di n.: a) n. di composti aromatici e di paraffine, in cui il nitrogruppo si lega a un atomo di carbonio, dando luogo a un nitroderivato secondo la reazione:
b) n. di alcoli alifatici polivalenti e di carboidrati. Nel corso di questo processo il nitrogruppo si lega all’atomo di ossigeno di un ossidrile, dando luogo a un estere nitrico (nitrato) secondo la reazione di esterificazione:
c) n. di ammine organiche, in cui il nitrogruppo si lega a un atomo di azoto, dando luogo a una nitrammina, secondo la reazione:
In queste reazioni il nitrogruppo sostituisce un atomo di idrogeno (sostituzione diretta); talvolta è più conveniente la sostituzione indiretta che consiste nella n. del derivato solfonico o acetilico precedentemente preparato. L’agente nitrante più impiegato è l’acido nitrico, talvolta in miscela con sostanze acide disidratanti (oleum, acido solforico, acido acetico, anidride acetica), che, combinandosi con l’acqua prodotta, spostano l’equilibrio verso la n.; come agenti nitranti al posto dell’acido nitrico s’impiegano, in taluni casi, nitrati organici, nitrati metallici insieme ad acido acetico, biossido di azoto.
La n. deve operare in condizioni tanto più severe (maggiore temperatura, concentrazione più elevata dell’agente nitrante) quanto maggiore è il numero di nitrogruppi da introdurre in un composto organico. La scelta delle condizioni operative dipende dalla natura della sostanza organica da nitrare e dal numero e dalla posizione dei nitrogruppi da introdurre. Il meccanismo di reazione dipende essenzialmente dalla natura dei reagenti. Le n. di tipo ionico avvengono in genere quando si opera su composti aromatici, su alcoli alifatici polivalenti, su carboidrati, su ammine; la n. delle paraffine coinvolge in genere un meccanismo di reazione del tipo a radicali liberi.
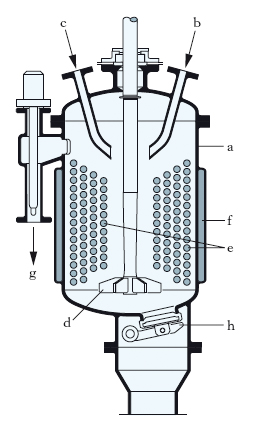
Le n. vengono condotte in un apparecchio detto nitratore (o reattore di n.), costituito da un recipiente (a in fig.) costruito con materiali inattaccabili all’azione corrosiva della miscela nitrante introdotta da b insieme al materiale da nitrare introdotto da c. La n. viene effettuata con l’ausilio dell’agitatore d, mentre la temperatura della soluzione viene controllata per mezzo di un fluido refrigerante che percorre le serpentine e e la camicia f. Il materiale nitrato esce da g; è inoltre presente la valvola di sicurezza h che, in caso di pericolo, consente lo svuotamento rapido del nitratore in una sottostante vasca contenente una opportuna soluzione di neutralizzazione. Solo raramente le n. richiedono l’impiego di catalizzatori.