crioscopia
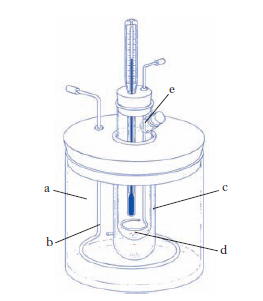
Parte della chimica fisica che studia i fenomeni relativi al congelamento delle soluzioni. Il punto di congelamento di una soluzione è in generale più basso di quello del solvente (nelle soluzioni solide, per es. antimonio nello stagno, è invece più alto). L’abbassamento provocato da quantità equimolecolari di sostanze diverse disciolte in una medesima quantità di solvente, purché la soluzione sia abbastanza diluita, ha in generale un valore pressoché costante (legge di F.M. Raoult). Eccezioni (per es., gli acidi organici) sono dovute alla dissociazione in ioni delle sostanze disciolte, o alla combinazione di queste col solvente, o al formarsi di soluzioni solide: si parla in tal caso di anomalie crioscopiche. Se queste non si verificano, dalla conoscenza dell’abbassamento del punto di congelamento è possibile risalire al peso molecolare M del soluto: M=1000 L∙w/(Δ∙W), dove L è la costante crioscopica, pari a 0,0198 T2/K (con T temperatura termodinamica di congelamento del solvente, K calore latente, in cal/g, del solvente stesso), il cui significato fisico è quello di abbassamento del punto di congelamento provocato da una mole di un qualsiasi soluto non volatile e non dissociato disciolta in 1000 g di solvente, Δ è l’abbassamento del punto di congelamento prodotto da w g di sostanza disciolta in W g di solvente. Nel caso in cui si verifichi la dissociazione del soluto nel solvente, la formula precedente deve essere corretta per mezzo di opportuni coefficienti che tengano conto del numero di specie ioniche in soluzione e del grado di dissociazione. Per la determinazione crioscopica dei pesi molecolari si usano appositi strumenti detti crioscopi (v. fig.). Le costanti crioscopiche hanno valori caratteristici per ogni solvente e non dipendono dal soluto.
Applicazioni importanti della c. si hanno, oltre che nella determinazione dei pesi molecolari, nella tecnica delle miscele frigorifere. In medicina, è stata impiegata nello studio della funzionalità renale.