Clonazione
Clonazione
Definizione e principi generali
Il termine clonazione si riferisce a due ambiti molto differenti, il primo dei quali è la produzione asessuale di copie geneticamente identiche di un organismo vivente. Questa procedura ha implicazioni in importanti settori come, per es., la zootecnia, l'industria farmaceutica e la biomedicina. Il termine è però anche utilizzato per descrivere procedure tipiche dell'ingegneria genetica e, in particolare, la fase sperimentale che porta alla produzione di cloni di organismi unicellulari geneticamente modificati (in questo caso è meglio parlare di c. cellulare e/o di c. molecolare); un esempio classico è quello di cloni batterici che abbiano incorporato, attraverso tecniche di trasferimento genetico, il DNA ricombinante. Il clone è rappresentato da una popolazione cellulare in espansione, derivante però da una singola cellula progenitrice contenente un particolare tipo di DNA ricombinante. La produzione di cloni cellulari batterici è notevolmente più semplice di quella di organismi pluricellulari geneticamente identici. Si premette che gli organismi complessi (come i mammiferi) sono costituiti da cellule somatiche (per es., cellule cardiache, cellule nervose, cellule ematopoietiche ecc.) aventi una dotazione di cromosomi doppia (cellule diploidi) e da cellule riproduttive (spermatozoi e oociti), o gameti, aventi una dotazione singola di cromosomi (cellule aploidi). Durante il processo di fecondazione, uno spermatozoo aploide penetra all'interno di un oocita aploide per generare uno zigote diploide che, attraverso successivi cicli di divisione cellulare, darà origine a una morula, a una blastula, a un embrione e a un feto, fino alla nascita. È questo un processo genetico finemente regolato attraverso l'attivazione di numerosi geni, tra gli oltre 25.000-30.000 presenti nel genoma, e alla contemporanea disattivazione di altri geni. Questo processo è associato al differenziamento cellulare; mentre infatti lo zigote e le cellule delle prime fasi di segmentazione sono totipotenti, durante lo sviluppo embrionale perdono progressivamente questa caratteristica, e il loro patrimonio genetico attiva un processo differenziativo, che prevede una specializzazione dell'espressione genica che, nell'uomo, si concretizzerà nello sviluppo dei circa 200 tessuti diversi. Se la procedura di fecondazione dell'oocita è stata eseguita in vitro (come nel caso della FIVET, fecondazione in vitro e trasferimento dell'embrione in utero), lo zigote si dividerà fino a raggiungere lo stadio di blastocisti e, per arrivare al completamento dello sviluppo, occorrerà impiantare la blastocisti in utero. Le tecnologie per la c. degli animali superiori (o dell'uomo) si basano su piccole ma significative modificazioni di queste fasi. Queste tecniche hanno permesso di iniziare a rispondere ad alcune domande che i ricercatori si sono da sempre posti: qual è la natura dei cambiamenti del genoma di cellule differenziate rispetto allo zigote? Può essere il genoma di cellule differenziate riprogrammato per originare cellule totipotenti? Un dato emerge con assoluta certezza dalle ricerche sulla c.: il nucleo di cellule isolate da organismi adulti può essere riprogrammato (andrà accuratamente valutato se completamente o solo parzialmente). Infatti, trapiantando nuclei somatici in oociti e impiantando i pre-embrioni nell'utero di madri portatrici, essi andranno incontro al normale sviluppo embrionale e alla produzione di organismi vitali completi.
Metodiche di clonazione
Le metodiche di c. di animali sono essenzialmente due: la suddivisione programmata di embrioni (embryo splitting) e la sostituzione del materiale genetico di oociti con un nucleo diploide di cellule somatiche isolate da embrioni, da feti o da individui adulti (fig. 1).
Suddivisione di embrioni. - È una procedura molto semplice, che ha un'analogia in natura con la generazione di gemelli monozigoti. Questo fenomeno non è raro. Nella specie umana si ha, in media, un parto gemellare ogni trecento parti, derivante dalla fecondazione di un unico ovulo da parte di un unico spermatozoo e della successiva suddivisione dell'embrione risultante in due unità capaci di svilupparsi indipendentemente (gemelli monozigoti, cioè derivanti da un unico zigote). Nel caso della c. per suddivisione degli embrioni, da un singolo embrione allo stadio di 8-16 cellule si procede per scissione delle cellule totipotenti in più sub-embrioni, utilizzando tecniche microchirurgiche. Questa tecnologia prevede di produrre un numero limitato di sub-embrioni (da due a quattro), in quanto si è notato che spingendo oltre la scissione dell'embrione si va incontro a una ridotta capacità delle gravidanze multiple di arrivare a termine.
Trasferimento del nucleo di cellule somatiche (Somatic Cell Nuclear Transfer, SCNT). - La procedura SCNT prevede di ottenere, con tecniche ormonali, un elevato numero di oociti, dai quali viene rimosso il materiale genetico, sostituito con nuclei provenienti da cellule di un donatore. Tale tecnologia può prevedere l'utilizzo di nuclei non solo da cellule embrionali e fetali, ma anche da cellule adulte. L'oocita, così manipolato, conterrà l'assetto genetico diploide conferitogli dal nucleo trapiantato. Nel caso in cui l'embrione così prodotto sia trasferito in utero e la gestazione condotta a termine, i neonati saranno una copia genetica del donatore del nucleo trasferito all'oocita.
Finalità della clonazione: riproduzione e terapia
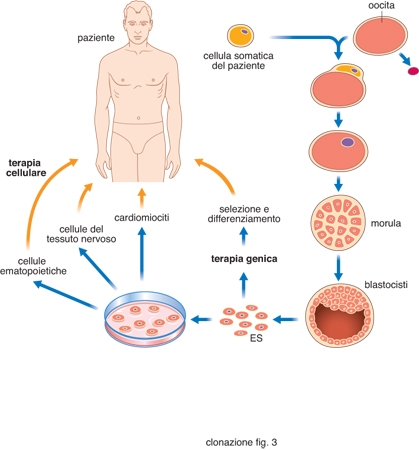
Utilizzando come strategia quella del trapianto di nuclei, possiamo avere essenzialmente due finalità legate al processo di clonazione. Nel primo caso (fig. 1, a sinistra) si procede alla produzione di un embrione clonato perché esso sia trasferito nell'utero di una madre portatrice. Nel secondo caso (fig. 1, a destra) lo scopo della c. è produrre una blastocisti, che sarà utilizzata solo per isolare le cellule staminali embrionali (cellule ES) dalla massa cellulare interna (ICM). Va sottolineato che, negli animali, la possibilità delle cellule ES di differenziare in vitro per dar luogo a cellule specializzate, in grado di colonizzare e riparare in vivo tessuti danneggiati, è stata dimostrata ripetutamente. Per es., cellule ES possono differenziare a cardiomiociti ed essere utilizzate per la terapia cellulare di ischemie cardiache. Questa capacità delle cellule ES (fig. 2) può essere molto utile per la terapia cellulare di patologie molto gravi, quali diabete, morbo di Alzheimer, morbo di Parkinson. Poiché la terapia cellulare, per avere successo, deve prevedere un trapianto a individuo immunologicamente compatibile, la produzione di linee ES da embrioni clonati utilizzando nuclei da cellule somatiche di pazienti potrebbe permettere un trapianto autologo, senza alcun rischio di rigetto.
Clonazione a fini riproduttivi. - La c. a fini riproduttivi riguarda essenzialmente la produzione di animali geneticamente identici all'individuo dal quale è stata isolata la cellula somatica da utilizzare nella procedura SCNT. Un progresso importante in questa strategia era stato compiuto nel 1995, quando sono stati prodotti due agnelli, Megan e Morag, mediante SCNT, utilizzando nuclei di cellule embrionali coltivate in vitro. Questo esperimento dimostrava che la tecnica SCNT poteva essere applicata ai mammiferi utilizzando nuclei da linee cellulari in coltura. Tuttavia, il caso certamente più famoso è quello di Dolly, la prima pecora clonata utilizzando come donatrici di nuclei cellule somatiche primarie adulte. A questa ricerca, pubblicata nel 1997 su Nature dal gruppo di I. Wilmut del Roslin Institute di Edimburgo, ne sono seguite molte altre riguardanti la produzione per c. di topi, ratti, cavalli, vacche, capre, maiali, conigli, gatti, muli e, più recentemente, cani. Un dato che ha trovato conferma negli studi effettuati è che la procedura, pur migliorata negli anni, è poco efficiente. Per es., per ottenere Dolly è stato necessario utilizzare un numero assai elevato di oociti, a ognuno dei quali era stato tolto il materiale genetico. In questo caso, la sostituzione del materiale genetico dell'oocita con il nucleo somatico è avvenuta per fusione con una cellula donatrice, ottenuta con una leggera scarica elettrica una volta che oocita e cellula donatrice erano stati posti a contatto. Di 434 tentativi di fusione, solo 276 sono riusciti, e di questi 247 hanno generato morule o blastule. I 29 embrioni più promettenti sono stati trasferiti nell'utero di 13 pecore, ottenendo 8 agnelli, uno solo dei quali (Dolly) era stato generato in seguito a c. utilizzando cellule somatiche (Wilmut, Schnieke, McWhir et al. 1997). Il problema della c. per trasferimento nucleare a fini riproduttivi non è solo limitato all'efficienza, in quanto è ormai confermato che gli animali prodotti per c. manifestano in genere difetti notevoli, tra i quali anomalie nei processi respiratori e metabolici e invecchiamento precoce. Va ricordato che, per sostenere uno sviluppo embrionale normale, il nucleo utilizzato per il trasferimento deve essere in qualche modo 'riprogrammato' per attivare geni importanti per le fasi precoci dello sviluppo embrionale, contemporaneamente alla disattivazione di geni associati con il differenziamento proprio della cellula donatrice utilizzata. Analisi dell'espressione genica hanno dimostrato che il 4-5% del genoma non viene correttamente espresso in topi clonati, indicando che queste procedure possono comportare serie anomalie nell'espressione genica. Coerentemente con queste ipotesi, la pecora Dolly, che era apparsa in salute in età giovanile, è morta prematuramente con numerose anomalie patologiche. L'analisi dei terminali dei cromosomi (telomeri) avrebbe indicato una lunghezza leggermente ridotta rispetto ai controlli, confermando, dal punto di vista citogenetico, l'osservazione di un precoce invecchiamento. Il principale problema riguardante la produzione di animali normali attraverso procedure di c. basate su SCNT risiede essenzialmente nelle differenze molecolari tra i nuclei utilizzati delle cellule somatiche e il nucleo degli oociti e degli spermatozoi. In breve, la 'riprogrammazione' dei nuclei delle cellule somatiche è un processo complesso e non risolto.
Alcune differenze molecolari sono la struttura della cromatina e il livello di metilazione del DNA genomico. Queste differenze molecolari sono causa dei problemi e delle difficoltà di produrre embrioni clonati, delle difficoltà di ottenere una gestazione normale e del fatto che la totalità degli organismi prodotti, apparentemente normali in età giovanile, sviluppa ben presto anomalie anche molto gravi. Va infine ricordato che Dolly, e i cloni animali prodotti con la stessa tecnica, non possono essere considerati una copia geneticamente identica all'individuo dal quale sono state isolate le cellule somatiche donatrici di nucleo, in quanto alla componente mitocondriale partecipa anche l'oocita enucleato al quale il nucleo è stato trasferito. La c. a fini riproduttivi, comunque, mantiene un suo ben preciso interesse. Tanto per citare un esempio, le tecnologie di ingegneria genetica hanno permesso di produrre animali transgenici molto utili per produrre farmaci, con tecniche che hanno previsto la combinazione tra metodologie di trasferimento genico e di clonazione. Per es., fibroblasti fetali di ovini sono stati co-trasfettati con un gene marcatore per la resistenza alla neomicina (neo) e con un costrutto genomico per il fattore ix della coagulazione progettato con tecniche di ingegneria genetica per produrre la proteina codificata nel latte della pecora (Schnieke, Kind, Ritchie et al. 1997). Cellule contenenti il costrutto di interesse sono state utilizzate per la procedura di trasferimento nucleare a oociti enucleati. Gli agnelli prodotti contenevano nel loro genoma il trasgene per il fattore ix della coagulazione, dimostrando che le cellule somatiche possono essere oggetto di manipolazione genetica in vitro e in grado di produrre animali transgenici vitali in seguito a c. per SCNT, con una efficienza almeno doppia rispetto alle tecniche classiche. Una delle pecore così prodotte (Polly) era in grado di produrre la proteina ricombinante nel proprio latte ed essere utilizzata, in pratica, come un bioreattore. La c., in questo caso, permette di rendere molto efficiente la produzione di questi animali, identici rispetto all'unica caratteristica di interesse, e cioè la capacità di produrre molecole utilizzabili in ambito farmaceutico. Va rilevato che numerosi animali transgenici sono stati prodotti per ottenere proteine di interesse farmaceutico e biomedico in fluidi biologici (latte, siero, urine, sperma). Tra le proteine prodotte ricordiamo l'attivatore del plasminogeno tissutale, l'urochinasi, l'ormone della crescita, il fibrinogeno, il fattore della crescita neurale, l'eritropietina, l'α1-antitripsina, anticorpi ricombinanti di varia natura. Questo settore, noto con i termini pharming o biopharming (derivanti dalla fusione dei termini pharmaceutical o biopharmaceutical e farming) è uno dei più rilevanti settori delle biotecnologie innovative, in quanto si è notato che alcune proteine di interesse farmaceutico prodotte da organismi semplici (per es., dai batteri) ricombinanti non sono farmacologicamente attive perché il citoplasma batterico, a differenza di quello dei mammiferi, non è in grado di modificare correttamente le proteine dopo la loro sintesi. Al contrario, si è notato che le proteine ricombinanti prodotte dagli animali transgenici sono funzionali e attive in protocolli terapeutici. La c. di animali non ha solo come finalità prioritaria la produzione di proteine di interesse farmaceutico. Il gruppo di Woo Suk Hwang della Seul National University (Corea del Sud) ha pubblicato su Nature (Lee, Kim, Jang et al. 2005) la c. di due levrieri afgani, tra i quali Snuppy (acronimo di Seul National University Puppy). Questa è la prima c. di cani riportata e discussa in dettaglio. La difficoltà di questa ricerca è dimostrata dal fatto che per ottenere Snuppy sono stati sottoposti a SCNT ben 1095 oociti e i pre-embrioni originati sono stati impiantati in 123 madri adottive. Delle tre gravidanze ottenute, una è stata abortita, le altre due hanno invece portato alla nascita di due cloni canini. Uno dei due cloni è successivamente morto per una patologia polmonare dopo 22 giorni (Lee, Kim, Jang et al. 2005). Per quanto riguarda le possibili applicazioni di questa tecnologia, oltre alla scontata e molto discutibile possibilità di clonare il proprio cane (pet-cloning), forse la più importante è produrre cloni geneticamente identici di cani modello di patologie umane, allo scopo di produrre sistemi sperimentali di grande utilità nella ricerca biomedica.
La c. di cavalli ha invece una ragione molto pratica. Infatti, cavalli di grande successo nel mondo dello sport equino, essendo stati castrati nel periodo giovanile, non possono essere utilizzati come stalloni. In questo caso, la c. di cavalli di successo potrebbe permettere, senza ovviamente nessuna garanzia delle prestazioni sportive della prole, un loro utilizzo a fini riproduttivi (Galli, Lagutina, Crotti et al. 2003). Non va infine sottovalutata la possibilità di utilizzare strategie di c. di animali nell'ambito di progetti finalizzati alla difesa di specie a forte rischio di estinzione. Questa tematica è sicuramente affascinante e ha avuto un sostegno sperimentale dalla pubblicazione da parte di un gruppo di ricercatori dell'Audubon Center for Research of Endangered Species della produzione di cloni del gatto selvatico africano (Felis silvestris lybica), una specie a rischio di estinzione (Gomez, Pope, Giraldo et al. 2004). In questo caso due gatti (Nancy, di sesso femminile, e Jazz, di sesso maschile) sono stati donatori di cellule per la procedura SCNT. I pre-embrioni ottenuti sono stati trasferiti a madri portatrici, generando, nel caso di SCNT con cellule di Nancy, i cloni Caty, Madge, Emily, Evangeline e Tilly. Accoppiando tra loro i cloni ottenuti (le due femmine, Madge e Caty, con il maschio Ditteux, clone di Jazz) sono stati ottenuti numerosi gattini, a dimostrazione che i prodotti della c. degli esemplari di Felis silvestris lybica Nancy e Jazz erano fertili e utilizzabili per il mantenimento della specie (Gomez, Pope, Giraldo et al. 2004).
Clonazione con finalità terapeutiche. - È questo un campo della ricerca applicata che ha visto successi importanti, che permettono di ipotizzare come fattibili interventi di terapia cellulare e terapia genica (fig. 3). Le prime fasi della c. a fini terapeutici sono in tutto simili alla c. a fini riproduttivi. Tuttavia, in questo caso, l'obiettivo non è quello di generare un organismo completo, ma quello di bloccare il processo in vitro allo stadio di blastocisti (dopo 5-6 giorni di coltura in vitro). L'interesse in questa struttura embrionale è dovuto al fatto che le cellule che costituiscono la massa cellulare interna sono di fatto cellule staminali pluripotenti, in grado di generare in vitro cellule di svariati tessuti, tra i quali il muscolo cardiaco, il midollo osseo, il tessuto adiposo, il tessuto nervoso e altri (Wakayama, Tabar, Rodriguez et al. 2001). Pertanto, la produzione di embrioni clonati permetterebbe di produrre cellule staminali embrionali utilizzabili in terapia cellulare attraverso trapianto autologo. Si ritiene che, a differenza delle cellule staminali dell'adulto (già specializzate), le cellule staminali embrionali abbiano maggiore potenzialità applicativa. Le pubblicazioni a supporto di questa strategia sono numerose. Per es., utilizzando cellule ES prodotte per SCNT, è già stato possibile generare neuroni capaci di produrre dopamina e serotonina, applicati con successo nel trattamento di un topo modello di morbo di Parkinson. Per quanto riguarda l'uomo, cellule staminali embrionali sono state utilizzate per dimostrare la possibilità di generare cardiomiociti, neuroni, cellule produttrici di insulina, cellule ematopoietiche. Oltre alla cosiddetta terapia cellulare, la produzione di cellule ES attraverso SCNT permetterà, in linea di principio, di correggere in vitro difetti genetici molto importanti, di caratterizzare le cellule ingegnerizzate in vitro, e di trapiantarle con finalità terapeutiche. Questo intervento di terapia genica potrebbe essere applicato a patologie genetiche gravi, come la fibrosi cistica e la talassemia. A sostegno di questa possibilità esistono evidenze sperimentali in animali modello. L'esempio più rilevante è forse quello pubblicato sulla rivista Cell dal gruppo di R. Jaenisch, che ha utilizzato un ceppo di topo con un ben definito difetto genico allo scopo di combinare SCNT, terapia genica e terapia cellulare. Il topo utilizzato, Rag2-/- non possiede i geni Rag2 (che codificano per la ricombinasi Rag2, necessaria all'assemblaggio dei geni delle immunoglobuline nel corso dello sviluppo) e manifestano un grave difetto, in quanto non presentano linfociti B e T nei tessuti linfoidi e immunoglobuline nel siero. Tale difetto ricorda la sindrome di Omenn. Questi topi sopravvivono solo se allevati in ambiente sterile. La strategia sperimentale dei ricercatori è stata la seguente: a) trasferimento di nuclei di cellule somatiche del topo Rag2-/- in oociti enucleati; b) isolamento di cellule ES dalle blastocisti prodotte; c) correzione in vitro del difetto genetico attraverso ricombinazione omologa utilizzando opportuni vettori contenenti il gene Rag2; d) sviluppo in vitro di cellule staminali ematopoietiche (HSC) dalle cellule ES corrette attraverso terapia genica; e) trapianto delle HSC nel topo Rag2-/-. Dopo 3-4 settimane il topo trattato era in grado di produrre linfociti B, linfociti T e immunoglobuline (Rideout, Hochedlinger, Kyba et al. 2002). Questa ricerca dimostra la fattibilità di un utilizzo del trapianto omologo di cellule staminali embrionali ottenute partendo da embrioni clonati e sottoposte a terapia genica in vitro prima di differenziarle e utilizzarle per il trapianto.
Produzione di embrioni umani clonati
Il progresso nelle ricerche sulle cellule staminali embrionali per la terapia cellulare e la dimostrata possibilità di correggere gravi difetti genici su cellule staminali, attraverso esperimenti di terapia genica, hanno prodotto una grande aspettativa nei confronti di gruppi di ricerca impegnati nello sviluppo di metodiche efficienti e riproducibili per produrre embrioni umani clonati e sviluppati, fino allo stadio di blastocisti, e derivare dalle ICM linee ES da utilizzare allo scopo di produrre cellule differenziate per trapianti autologhi. Queste strategie sperimentali sono state ostacolate da posizioni tendenti a impedire qualunque tipo di sperimentazione su pre-embrioni umani. Perciò, pochi laboratori al mondo si sono impegnati su questa tematica. Per contro, la comunità scientifica ha potuto constatare come l'interesse elevato per risultati innovativi in questo settore, unitamente alle pressioni e alla fretta di ottenerli, può portare a clamorosi errori di percorso, e a mettere in atto modalità nell'ottenere e presentare i dati che nulla hanno a che vedere con indagini scientifiche serie e riproducibili. Lo stesso gruppo di ricerca coordinato da Woo Suk Hwang, che con successo aveva riportato la c. di Snuppy, è stato al centro del caso più clamoroso di forzatura scientifica di dati ottenuti in modo criticabile e alla fine dimostratisi essere in gran parte artificiosamente prodotti e presentati.
In una prima ricerca, il gruppo di Woo Suk Hwang aveva affermato di essere in grado di ottenere embrioni umani clonati in seguito a procedura SCNT e di aver derivato dall'ICM di uno di essi una linea cellulare embrionale (2001). In un secondo lavoro, pubblicato dallo stesso gruppo di ricerca su Science nel giugno del 2005, sono stati riportati risultati che, se fossero stati confermati, avrebbero definitivamente dimostrato che linee ES potevano essere derivate con efficienza accettabile da embrioni umani clonati. I dati riportati nel lavoro erano i seguenti: i pazienti donatori di cellule somatiche per SCNT erano stati 11, gli oociti sottoposti a SCNT 129 (prelevati da 18 donatrici), le blastocisti ottenute 31, le linee ES prodotte 11. Per ognuna di esse era riportata l'analisi del DNA attraverso consolidate metodiche molecolari. In tutti i casi era sottolineato dagli autori che la riscontrata identità genetica del DNA delle linee cellulari ES con il DNA dei donatori di nucleo escludeva che le linee cellulari prodotte potessero essere derivate da imperfetta enucleazione degli oociti impiegati e successiva attivazione partenogenetica. La scelta dei donatori di nucleo reclutati per la procedura SCNT era stata effettuata pensando già alle eventuali applicazioni terapeutiche. Infatti, i donatori del nucleo erano affetti da diabete giovanile (JD), da danni alla spina dorsale (SCI) e da malattie genetiche dovute a immunodeficienza (ipogammaglobulinemia congenita, CGH); JD, SCI e CGH sono tutte patologie considerate trattabili attraverso terapie cellulari basate, rispettivamente, su cellule staminali ematopoietiche, neuroprogenitori e progenitori delle cellule β delle isole pancreatiche.
Questo lavoro, che aveva sollevato da un lato entusiasmi, dall'altro perplessità (l'efficienza della procedura era tanto alta da essere sospetta), si è rivelato in gran parte prodotto con dati manipolati artificiosamente. Inoltre, le procedure per ottenere gli oociti utilizzati si sono dimostrate non in regola con le precise direttive in questo settore della ricerca. I risultati dei lavori del gruppo di Woo Suk Hwang sono stati, sulla base di queste motivazioni, ritrattati.
È importante, dopo avere accennato a questa vicenda, fare il punto sulla tematica di ricerca applicata allo sviluppo di linee cellulari ES da ICM di embrioni umani clonati. I risultati del gruppo coreano non sottoposti a critica confermano che la c. umana è fattibile. Questa conclusione è stata confermata dal lavoro di un altro gruppo di ricerca, appartenente al Center for Stem Cell Biology and Development dell'Università di Newcastle, coordinato da A. Murdoch (M. Stojkovic, P. Stojkovic, Leary et al. 2005), che ha descritto la c. di un embrione umano a partire da 36 oociti prelevati da 11 donatrici, e il suo sviluppo fino allo stadio di blastocisti. Al contrario, non possiamo affermare che linee ES possono essere con riproducibilità ottenute a partire da un numero ragionevole di blastocisti prodotte per SCNT utilizzando nuclei da cellule somatiche di pazienti. Tuttavia, in base ai dati che sono ormai consolidati, i quali dimostrano che linee cellulari ES possono essere con riproducibilità derivate dall'ICM di blastocisti umane, e che linee ES sono state ripetutamente ottenute da embrioni clonati in sistemi modello animali, è prevedibile che, in un futuro ormai prossimo, anche linee ES saranno prodotte da embrioni umani clonati. Se questo sarà ottenuto con riproducibilità, l'unica problematica che potrebbe ritardare l'applicazione clinica di queste tecnologie sarebbe il giudizio bioetico sulle ricerche che prevedono la c. dell'embrione umano per la produzione di cellule staminali da utilizzare a fini terapeutici.
Clonazione umana e bioetica
La possibilità dimostrata di poter clonare embrioni umani ha reso importante il dibattito sui molteplici aspetti bioetici e giuridici che questa tecnologia comporta. È parere unanime degli scienziati che la c. umana a fini riproduttivi non debba essere attuata. Da un punto di vista prettamente scientifico, l'esperienza con la c. di animali ha dimostrato che gli animali clonati sono spesso risultati affetti da importanti anomalie; da un punto di vista bioetico e giuridico, il parere contrario alla c. umana è ancora più netto. Più articolate sono invece le posizioni sulla c. umana a fini terapeutici. Dal punto di vista scientifico è indiscutibile che i risultati, utilizzando cellule staminali embrionali, siano molto incoraggianti in modelli animali; invece, i risultati, utilizzando ES isolate dell'ICM di embrioni umani, sono ancora modesti, soprattutto in relazione ai pochi dati a disposizione e alle numerose difficoltà legislative che questo settore della ricerca ha dovuto sopportare e superare. Tuttavia, non si può escludere a priori che si potranno ottenere risultati positivi utilizzando ES umane nella terapia. Nonostante queste indicazioni, numerose perplessità sono state avanzate, principalmente riguardanti il destino del pre-embrione dal quale le cellule dell'ICM sono state isolate. Il destino di questi pre-embrioni è, ovviamente, la morte. Questa è la motivazione principale alla base del parere negativo espresso nei confronti delle tecniche della c. umana a fini terapeutici. Tale posizione non è condivisa da numerosi scienziati. Limitare o impedire la ricerca sulle cellule staminali umane, ottenute anche attraverso metodiche di c., toglierebbe infatti alla ricerca biomedica una possibile strategia per attuare terapie innovative per la cura di patologie estremamente rilevanti, quali Parkinson, Alzheimer e diabete.
bibliografia
A.E. Schnieke, A.J. Kind, W.A. Ritchie et al., Human factor ix transgenic sheep produced by transfer of nuclei from transfected fetal fibroblasts, in Science, 1997, 278, pp. 2130-33.
I. Wilmut, A.E. Schnieke, J. McWhir et al., Viable offspring derived from fetal and adult mammalian cells, in Nature, 1997, 385, pp. 810-13.
T. Wakayama, V. Tabar, I. Rodriguez et al., Differentiation of embryonic stem cell lines generated from adult somatic cells by nuclear transfer, in Science, 2001, 292, pp. 740-43.
W.M. Rideout, K. Hochedlinger, M. Kyba et al., Correction of a genetic defect by nuclear transplantation and combined cell and gene therapy, in Cell, 2002, 109, 1, pp. 17-27.
C. Galli, I. Lagutina, G. Crotti et al., Pregnancy: a cloned horse born to its dam twin, in Nature, 2003, 424, p. 635.
M.C. Gomez, C.E. Pope, A. Giraldo et al., Birth of African wildcat cloned kittens born from domestic cats, in Cloning and stem cells, 2004, 6, 3, pp. 247-58.
R. Jaenisch, Human cloning - The science and ethics of nuclear transplantation, in The New England journal of medicine, 2004, 351, pp. 2787-91.
W.S. Hwang, S.I. Roh, B.C. Lee et al., Patient-specific embryonic stem cells derived from human SCNT blastocysts, in Science, 2005, 308, pp. 1777-83.
B.C. Lee, M.K. Kim, G. Jang et al., Dogs cloned from adult somatic cells, in Nature, 2005, 436, p. 641.
M. Stojkovic, P. Stojkovic, C. Leary et al., Derivation of a humon blastocyst after heterologous nuclear transfer to donated oocytes, in Reproductive biomed online, 2005, 11, 2, pp. 226-31.