Zeoliti
Zeoliti
Nel 1756 il mineralogista svedese Alex F. Cronstedt, noto per aver scoperto il nichel, descriveva le particolari proprietà di un minerale proveniente dalla miniera di rame di Svappavari (Lapponia): se il minerale veniva posto su un letto di borace riscaldato ad alcune centinaia di gradi centigradi, questo sembrava bollire. Per questa particolare proprietà, non rilevata in altri minerali allora conosciuti, Cronstedt coniò il termine zeolite (dal greco zein=bollire e lithos=pietra). Bisogna attendere il 1772 per ritrovare questo termine nella descrizione di cristalli cubici rinvenuti in Islanda da parte di Ignaz von Born (Zeolithus crystallisatus cubicus Islandiae), in seguito definiti zéolite en cube da Jean-Baptiste Romé de l'Isle (1783) e chabasie da Louis-Augustin Bosc d'Antic (1792), oggi noti come cabasite.
Durante tutto l'Ottocento si succedono i ritrovamenti di nuovi minerali classificabili come zeoliti, anche se si deve attendere che si sviluppino tecniche di indagine chimico-fisica più sofisticate ‒ con particolare riguardo a quelle basate sulla diffrazione di raggi X da parte di materiali monocristallini o policristallini ‒ per giungere a una definizione delle loro caratteristiche strutturali. Risale al 1930 la prima risoluzione della struttura cristallina di una zeolite, l'analcime, a cui fa seguito quella di altri minerali zeolitici; ciò ha dato un notevole impulso allo studio di questi minerali e alla loro conseguente definizione. Le loro caratteristiche principali sono: (a) la presenza di canali e/o gabbie regolari (anche detti micropori) con dimensioni che variano da zeolite a zeolite, ma che comunque risultano comprese nell'intervallo 3÷12 Å (3∙10−10÷1,2∙10−9 m); (b) la carica negativa della struttura dovuta alla presenza di tetraedri [AlO4]5− nell'impalcatura di tetraedri [SiO4]4−, normalmente compensata da cationi alcalini (per es., Li+, Na+, K+) e/o alcalino-terrosi (Mg2+, Ca2+, Sr2+, Ba2+) localizzati nei micropori, debolmente legati all'impalcatura alluminosilicatica e, quindi, facilmente scambiabili; (c) la presenza nei pori di acqua che può essere desorbita reversibilmente a seguito di blando riscaldamento (si tratta del fenomeno di 'ebollizione' osservato da Cronstedt); (d) una composizione chimica riassumibile come:
(Li,Na,K)a(Mg,Ca,Sr,Ba)b[Al(a+2b)Sin−(a+2b)O2n]∙mH2O
da cui si rileva un rapporto O:(Si+Al)=2 che è tipico della classe dei tettosilicati, a cui le zeoliti appartengono. In accordo con la regola di Lowenstein, il rapporto atomico Si/Al è maggiore o uguale a 1.
Sono diverse le definizioni che si succedono negli anni; sicuramente, però, quella proposta da Joseph V. Smith nel 1963, per molto tempo è stata ritenuta la più adeguata; essa definisce una zeolite come "un alluminosilicato con impalcatura (framework) tetraedrica tridimensionale aperta, le cui cavità possono ospitare cationi extra-impalcatura e molecole d'acqua, dotati di elevata mobilità che ne determina le caratteristiche proprietà di scambio ionico e di disidratazione reversibile".
È però una definizione che, col passar del tempo, si è dimostrata troppo restrittiva, e che pertanto nel 1997 è stata ampliata dalla IMA-CNMMN (International mineralogical association-commission on new minerals and mineral names) nella forma: "Una zeolite è una sostanza cristallina con struttura caratterizzata da un'impalcatura di tetraedri uniti tra loro, dove ciascun tetraedro è formato da quattro ossigeni disposti attorno a un catione. Il framework comprende cavità aperte sotto forma di gabbie e canali. Queste cavità sono solitamente occupate da molecole di acqua e da cationi extra-framework scambiabili. I canali sono sufficientemente grandi da permettere il passaggio di specie ospiti. Nelle fasi idrate, la disidratazione interviene a temperature normalmente inferiori ai 400° C ed è un processo reversibile. Il framework può essere interrotto da gruppi (OH, F); questi occupano un vertice di un tetraedro del framework che non è condiviso con i tetraedri adiacenti".
In questo modo, si è estesa la definizione anche a minerali con chimismo dell'impalcatura diverso da quella alluminosilicatica (per es., metallo-fosfati) e/o con interruzione della struttura tridimensionale, ma che possiedono caratteristiche e proprietà riconducibili a quelle delle zeoliti precedentemente definite. Come si vedrà nel prosieguo, questa definizione include anche tutti i materiali microporosi ottenuti per via sintetica.
Rappresentazione e struttura
Prima di descrivere la struttura, è utile soffermarsi sui metodi principali di rappresentazione delle zeoliti. Se si vogliono evidenziare le proprietà strutturali, sono molto utili, oltre alle classiche rappresentazioni mediante segmenti e sfere, quelle poliedriche e di connettività tra atomi tetraedrici T (figg. 1A, 1B, 1C) (in cui le connessioni riguardano atomi tetraedrici, per es. Si e Al) adiacenti e in cui vengono trascurati gli atomi di ossigeno. Se, viceversa, si vuole evidenziare il volume poroso accessibile e/o occupabile da altre specie chimiche, risulta particolarmente vantaggiosa la rappresentazione degli atomi dell'impalcatura con sfere di raggio equivalente a quello di van der Waals (fig. 1D).
Come si evince dalle definizioni sopra riportate, le zeoliti sono caratterizzate da un'impalcatura di tipo tettosilicatico, la cui unità base ‒ detta anche unità primaria di costruzione o PBU (Periodic building unit) ‒ è il tetraedro [TO4]n− dove n dipende dalla carica del catione T (per es., n=4 per T=Si o n=5 per T=Al). In linea teorica, i modi possibili di combinazione di tetraedri sono infiniti; nella pratica, però, vincoli di natura energetica limitano a un numero discreto di possibili combinazioni.
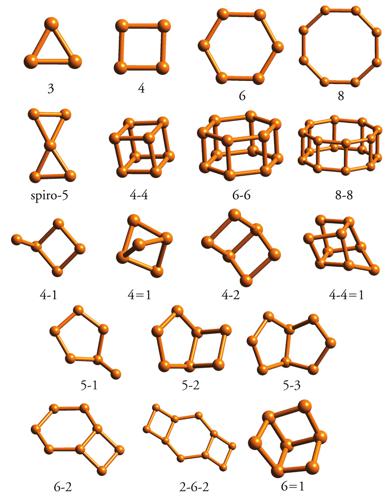
In generale, un'impalcatura zeolitica può essere descritta attraverso l'utilizzazione di unità finite o infinite, che si ripetono attraverso semplici operazioni di traslazione, rotazione o riflessione. Unità finite sono le unità secondarie di costruzione o SBU (Secondary building units) e le sub-unità strutturali o SSU (Structural sub-units). Le SBU sono definibili come le unità più semplici in cui è scomponibile una singola struttura zeolitica. Ne sono note 18, costituite da un minimo di 3 (anello a 3 tetraedri) a un massimo di 16 tetraedri (prisma ottagonale) (fig. 2). Le SSU, viceversa, sono unità strutturali più complesse delle SBU (per es., gabbie poliedriche come la α, fig. 3A, e la β o gabbia sodalitica, fig. 3B), utili per descrivere una struttura zeolitica. Le SBU e, in taluni casi, le SSU possono a loro volta formare unità infinite mono- (catene) o bidimensionali (strati) che, attraverso opportune operazioni di simmetria (traslazione, inversione, riflessione), permettono la costruzione dell'impalcatura.
Tra i diversi modi di classificazione delle zeoliti, quello più semplice ‒ ma anche più funzionale per chi opera in settori applicativi quali la catalisi eterogenea, l'assorbimento e le separazioni ‒ tiene conto del numero di tetraedri che definiscono le aperture dei pori. In questo modo si definiscono (fig. 4): (a) zeoliti a pori piccoli, con aperture a 8 tetraedri (per es., gismondina); (b) zeoliti a pori medi, con aperture a 10 tetraedri (per es., ferrierite); (c) zeoliti a pori larghi, con aperture a 12 tetraedri (per es., mordenite); (d) zeoliti a pori extra-larghi, con aperture a 14 o più tetraedri (per es., cloverite). Esistono poi zeoliti con sistema poroso costituito esclusivamente da gabbie con aperture dei pori definite da anelli a 6 tetraedri, non accessibili ad alcuna specie chimica (per es., sodalite).
Va rilevato che, a novembre 2005, erano noti 165 diversi tipi di impalcatura zeolitica, raccolti in modo sistematico nell'Atlas of zeolite framework types, una pubblicazione periodica a cura della IZA-SC (Structure Commission of International Zeolite Association). In accordo con le raccomandazioni della IUPAC (International Union of Pure and Applied Chemistry), ciascun tipo di impalcatura è identificato da un codice a tre lettere che definisce in modo univoco le caratteristiche strutturali indipendentemente dal chimismo dell'impalcatura stessa e delle specie chimiche presenti nel sistema poroso. Per esempio, il codice MOR definisce l'impalcatura della zeolite naturale mordenite (MORdenite), FAU della zeolite naturale faujasite (FAUjasite), LTA (Linde type A) e LTL (Linde type L) delle zeoliti sintetiche A e L. Il codice a tre lettere è eventualmente preceduto da un trattino (-) nel caso di interruzione del network tridimensionale (per es., il codice -CLO definisce l'impalcatura del galliofosfato cloverite: CLOverite). Nel succitato Atlas per ogni tipo di impalcatura sono riportate le principali informazioni a essa relative tra cui la (o le) SBU in cui è scomponibile l'impalcatura stessa, i principali dati cristallografici e composizionali, la densità dell'impalcatura (definita come numero di atomi tetraedrici per 1000 Å3) e le caratteristiche dei canali. Le informazioni sono riportate in modo tale da essere di facile lettura anche per i non esperti in materia.
Sintesi
Fino alla prima metà del XX sec., le zeoliti erano materia di studio quasi esclusiva dei mineralogisti, interessati più allo studio degli ambienti e delle condizioni di cristallizzazione di queste fasi che a una loro utilizzazione pratica. La prima sintesi di zeolite di cui si ha notizia è quella della levynite, riportata da Charles Sainte-Claire Deville nel 1862. Bisogna attendere però gli inizi degli anni Quaranta del Novecento per osservare la nascita della sintesi di zeoliti come scienza, fondata da Richard M. Barrer, dell'Imperial College di Londra. Studiando la conversione di minerali noti per azione di soluzioni a elevata salinità e a temperature relativamente elevate (170÷270°C), nel 1948 Barrer ha sintetizzato, in due varianti denominate fasi P e Q, la prima fase zeolitica senza controparte naturale, attualmente nota per avere un'impalcatura tipo KFI. Contemporaneamente, sono state avviate le ricerche nel settore della sintesi e delle applicazioni di zeoliti da parte della Union Carbide, guidate da un altro fondatore di questa scienza, Robert Milton. Utilizzando reagenti più puri e controllati e condizioni di sintesi più blande, i risultati non si sono fatti attendere. Nel corso del 1949 sono state ottenute le zeoliti A, B (oggi nota come Na-P1) e C (idrossi-sodalite). L'anno seguente è la volta della zeolite X (isostrutturale con la zeolite naturale faujasite) e della cabasite. Nel 1953, erano già 20 le fasi sintetiche a struttura zeolitica sintetizzate dal gruppo di ricerca di Milton e, tra queste, 14 non avevano controparte naturale. Quello che attualmente è considerato un successo, a quei tempi ha incontrato molti problemi prima di essere accettato; basti considerare che i brevetti delle zeoliti A e X e la loro utilizzazione come adsorbenti, depositati nel 1950, sono stati accettati solo nel 1959, dopo la pubblicazione della struttura cristallina di questi materiali.
Tutte queste zeoliti sono state sintetizzate in condizioni idrotermali, riscaldando in un pallone di vetro o in un'autoclave una miscela reagente contenente una fonte di silice, una di allumina, l'idrossido di sodio e l'acqua, in proporzioni diverse. Il riscaldamento può essere protratto per tempi che vanno dalle poche ore ai giorni; al termine del trattamento, il solido cristallizzato sotto forma di polvere bianca viene separato per filtrazione, lavato e infine essiccato.
Tutte queste zeoliti sono state ottenute da sistemi completamente inorganici, che cercano di riprodurre le condizioni in cui cristallizzano le fasi naturali. Questi sistemi non offrono, tuttavia, una grande flessibilità nel senso che le preparazioni si limitano all'utilizzazione di ioni alcalini (principalmente Na+, K+, di rado Li+, Rb+ e Cs+) o alcalino-terrosi (in prevalenza Mg2+ e Ca2+, meno frequentemente Sr2+ e Ba2+) e a bassi rapporti Si/Al che si riflettono, a loro volta, sulla composizione dei prodotti.
Nei riguardi della sintesi di nuove strutture zeolitiche e, soprattutto, nello svincolare il rapporto Si/Al dai bassi valori tipicamente ottenibili dai sistemi inorganici, decisiva è stata l'utilizzazione di additivi organici. Nel 1961, Barrer e Patrick J. Denny furono i primi a impiegare ammine e ioni tetraalchilammonio nelle sintesi idrotermali delle zeoliti, intuendo (senza però dimostrarla) la possibilità di aumentare significativamente il rapporto Si/Al nella struttura. Infatti, rispetto al sistema inorganico, in cui i compensatori della carica negativa dell'impalcatura sono i piccoli cationi alcalini o alcalino-terrosi, nelle zeoliti cristallizzate in presenza di additivi organici i compensatori di carica sono gli ingombranti ioni tetraalchilammonio che, intrappolati nei pori zeolitici, sono in grado di compensare un numero di cariche negative necessariamente inferiore. Nel 1967, quindi, si giunse alla sintesi della zeolite β, la prima zeolite ad alto contenuto di silice (rapporto molare Si/Al compreso fra 15 e 100), preparata in presenza di ioni tetraetilammonio [(C2H5)4N+] come additivo organico. È stata una scoperta estremamente importante, non solo per aver avviato un filone di ricerca tuttora aperto, ma anche perché questa è una delle poche zeoliti di interesse commerciale. Questo tipo di sintesi non differisce in maniera significativa da quelle dei sistemi inorganici. La cristallizzazione avviene mediante trattamento idrotermale in autoclave di una miscela di sintesi (soluzione, gel o sospensione a seconda dei reagenti utilizzati) contenente le fonti di silice e allumina, l'ammina o lo ione ammonico quaternario, acqua e, opzionalmente, ioni alcalini (come idrossidi), agenti mineralizzanti (per es., acido solforico). La miscela reagente è posta a cristallizzare sotto pressione autogena per un tempo variabile dalle poche ore ai mesi e a una temperatura in genere compresa tra 100 e 250 °C. Una volta terminato il trattamento idrotermale, la zeolite viene separata dalle acque madri, lavata ripetutamente, essiccata e calcinata a 500-600 °C per eliminare l'additivo organico intrappolato nei pori e rendere questi ultimi liberi per gli usi cui è destinata la zeolite.
Anche nel caso degli additivi organici, i primi successi hanno stimolato un numero sempre crescente di gruppi di ricerca accademici e, soprattutto, industriali verso la preparazione di nuove strutture zeolitiche per applicazioni nei settori più svariati. Sono le industrie chimiche, petrolchimiche e del petrolio a investire maggiormente in questo settore. La Mobil Oil Corporation e la Chevron negli USA, la Ici e la Unilever in Gran Bretagna, la Basf e la Bayer in Germania, l'Eni in Italia sono alcuni degli attori principali, con risultati che, di anno in anno, diventano sempre più frequenti e interessanti. Per esempio, nel 1972 si assiste alla pubblicazione del brevetto della zeolite ZSM-5(codice MFI) da parte della Mobil Oil Corporation, ottenuta con ioni tetrapropilammonio [(C3H7)4N+] come additivo organico. La facile preparazione e le caratteristiche porose uniche (sistema di canali lineari con aperture a 10 tetraedri che si intersecano con un sistema di canali sinusoidali, sempre con aperture a 10 tetraedri) hanno reso questa zeolite la più studiata in assoluto e non solo da un punto di vista applicativo. Molti sono i lavori e le informazioni ottenute sui meccanismi di cristallizzazione di questa zeolite, in funzione dei diversi reagenti utilizzati. Fondamentali sono anche i numerosi lavori finalizzati alla comprensione del ruolo dello ione tetrapropilammonio nella cristallizzazione della ZSM-5. È interessante la sintesi della fase puramente silicea della ZSM-5 (Silicalite-1), riportata nel 1978 su "Nature", il primo esempio di polimorfo microporoso della silice.
Col passar degli anni, mentre diminuivano progressivamente le scoperte di minerali a struttura zeolitica, aumentavano significativamente le nuove strutture (intese come nuovi framework) ottenute per sintesi. Il dato aggiornato a novembre 2005 indica 165 framework noti, cioè di cui è nota la struttura cristallina. A questi vanno aggiunti quelli sicuramente nuovi, ma di cui non è ancora nota tale struttura. Inclusi in questi 165 vi sono anche quelli ottenuti nei sistemi diversi da quello alluminosilicatico. Il più comune è certamente quello dei fosfati di alluminio (AlPO) il cui framework tetraedrico neutro è isoelettronico con quello della SiO2 ([SiO4]4−+[SiO4]4−)=([PO4]3−+[AlO4]5−). Framework carichi sono ottenuti quando si sostituisce parte del P con Si (SAPO, silicoalluminofosfati), o con Ti (TAPO, titanoalluminofosfati) o l'Al con metalli bivalenti (Mg, Co, Mn, ecc., noti come MeAPO, metalloalluminofosfati). Dal punto di vista strutturale, esistono AlPO (e corrispondenti varianti composizionali) di cui sono noti gli analoghi alluminosilicatici, assieme ad altri di cui non è noto il corrispondente. Quel che è vero ‒ e che limita alquanto la ricerca sui fosfati di alluminio ‒ è che questi hanno proprietà nettamente inferiori rispetto agli alluminosilicati in termini, soprattutto, di stabilità termica e idrotermale (riscaldamento in presenza di vapore). I framework alluminosilicatici, infatti, resistono fino a temperature di 800÷900 °C, in funzione della densità dell'impalcatura e del rapporto Si/Al; al contrario, in genere gli AlPO collassano per riscaldamento a 400÷600 °C.
Oltre a questi casi, molte strutture alluminosilicatiche sono note per la loro capacità di cristallizzare anche in sistemi diversi, in cui l'Al e/o parte del Si sono sostituiti da altri ioni trivalenti (B, Ga, Fe, ecc.) o tetravalenti (Ge, Ti, ecc.). Questo processo, noto come sostituzione isomorfa, modifica le proprietà chimico-fisiche del sistema e ha portato a risultati di rilevanza anche industriale quali, per esempio, la sintesi di un catalizzatore di ossidazione con acqua ossigenata di substrati idrocarburici in condizioni blande, denominato Titanio-silicalite-1 (TS-1), preparato alla fine degli anni Settanta nei laboratori di ricerca dell'Eni.
Applicazioni
Le zeoliti, per le loro peculiari caratteristiche strutturali e composizionali, trovano applicazione in numerosi settori tecnologici, che esamineremo in funzione della definizione di questi materiali soffermandoci, principalmente, sulle fasi alluminosilicatiche. Sono fasi idrate, la cui disidratazione è reversibile e, pertanto, trovano applicazione come agenti disidratanti di buona capacità, ma di non elevatissima efficienza.
Il framework zeolitico è aperto: infatti sono presenti canali e/o cavità con aperture libere nell'intervallo 3-8 Å. Sono dimensioni dell'ordine di quelle delle molecole organiche più semplici; pertanto, questa caratteristica può essere sfruttata per processi di adsorbimento e di separazione di molecole dalle loro miscele. In questo caso, la zeolite agisce da setaccio molecolare, poiché, in presenza di una miscela di composti organici, solo le molecole stericamente compatibili con le dimensioni delle aperture dei pori sono adsorbite nel sistema poroso mentre quelle con dimensioni superiori attraversano inalterate il letto di adsorbimento. Per esempio, la zeolite A è impiegata nella separazione degli alcheni lineari a catena lunga dai loro isomeri ramificati, processo alla base della preparazione degli alchilbenzeni solfonati lineari, utilizzati nella detergenza.
La presenza di Al nel framework zeolitico impartisce una carica negativa, compensata da cationi extra-framework dotati, in genere, di elevata mobilità e, quindi, scambiabili con altri cationi. Da questa proprietà deriva l'impiego delle zeoliti come scambiatori ionici. Importante è, per esempio, il loro impiego (in particolare della zeolite A) in processi di addolcimento dell'acqua, tipicamente nella detergenza, dove la zeolite scambia gli ioni sodio in essa contenuti con ioni Mg2+ e Ca2+. Sullo stesso principio è basato l'uso di zeoliti naturali per la sequestrazione di radionuclidi dalle acque. È noto, per esempio, a seguito all'incidente nucleare di Chernobyl nel 1986, l'impiego in grandi quantità (ca. 500.000 tonnellate) di rocce zeolitiche contenenti prevalentemente clinoptilolite per la depurazione delle acque inquinate da 137Cs e da 90Sr, con un'efficienza dell'ordine, rispettivamente, del 95 e del 50÷60%.
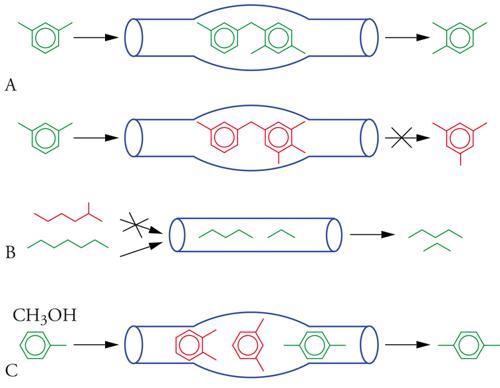
Se i cationi sono scambiati con protoni (H+), cosa che, in genere, prevede lo scambio dei cationi presen-ti con ioni ammonio (NH4+) e la successiva elimi-nazione dell'ammoniaca per via termica, la zeolite assume proprietà acide e, come tale, può essere utilizzata come catalizzatore di numerose reazioni acido-catalizzate (alchilazioni, transalchilazioni, cracking, ecc.). Rispetto ai catalizzatori rappresentati da acidi classici operanti in fase omogenea (per es., H2SO4, AlCl3, HF), le zeoliti offrono numerosi vantaggi quali la facile separazione dal mezzo di reazione, l'assenza di problemi di corrosione, la rigenerabilità (cioè la possibilità di ripristinare più volte le proprietà catalitiche del catalizzatore esausto). Ma l'aspetto fondamentale, che fa preferire i catalizzatori zeolitici anche a quelli eterogenei non microporosi, è la selettività impartita dalla forma e dalle dimensioni del sistema poroso (shape selectivity) (fig. 6). I siti attivi, infatti, per la maggior parte sono localizzati all'interno dei pori per cui il percorso di reazione viene spesso determinato dalle dimensioni libere del poro in prossimità del sito attivo stesso (restricted transition state shape selectivity, fig. 6A). Vale a dire che, tra i diversi percorsi di reazione possibili, sono permessi solo quelli che coinvolgono stati di transizione stericamente compatibili con le dimensioni dei pori, mentre i rimanenti sono impediti. Non solo, va sottolineato che le dimensioni dei pori possono determinare anche quali molecole presenti in una miscela possono essere adsorbite (azione della zeolite come setaccio molecolare) prima di dar luogo alla reazione (reactant shape selectivity, fig. 6B). Inoltre, tra i diversi prodotti che si possono formare all'interno dei pori, solo quello stericamente compatibile con le dimensioni delle aperture dei pori è eluito (product shape selectivity, fig. 6C), mentre i rimanenti, più ingombranti, subiscono reazioni successive a dare specie di minori dimensioni, quindi eluibili, o di dimensioni sempre maggiori che portano, in questo caso, all'ostruzione dei pori e, quindi, alla disattivazione del catalizzatore.
Le zeoliti trovano sempre maggiori applicazioni in campo industriale. Attualmente sono ampiamente utilizzate nell'industria petrolifera come catalizzatori in molti processi di raffineria come nell'FCC (Fluid catalytic cracking), e anche nella petrolchimica, come nel caso della sintesi dell'etilbenzene e dell'isopropilbenzene per alchilazione diretta del benzene, rispettivamente con etilene e propilene.
Bibliografia
Bärlocher 2001: Bärlocher, Christian - Meier, Walter M. - Olson, David H., Atlas of zeolite framework types, 5 ed., Amsterdam-London, Elsevier, 2001.
Barrer 1978: Barrer, Richard M., Zeolites and clay minerals as sorbents and molecular sieves, London, Academic Press, 1978.
Barrer 1982: Barrer, Richard M., Hydrothermal chemistry of zeolites, London, Academic Press, 1982.
Breck 1974: Breck, Donald W., Zeolite molecular sieves: structure, chemistry and use, London-New York, Wiley-Interscience, 1974.
Gottardi, Galli 1985: Gottardi, Glauco - Galli, Ermanno, Natural zeolites, Berlin-New York, Springer, 1985.
Karge, Weitkamp 1998-2004: Molecular sieves. Science and technology, edited by Hellmut G. Karge, Jens Weitkamp, Berlin-London, Springer, 1998-2004, 4 v.
Szostak 1989: Szostak, Rosemarie, Molecular sieves. Principles of synthesis and identification, New York, Van Nostrand-Reinhold, 1989.