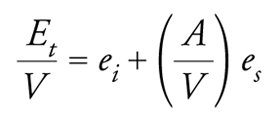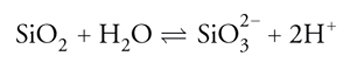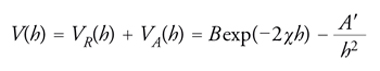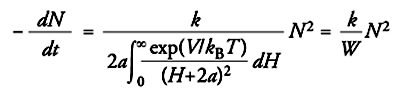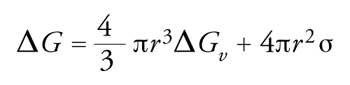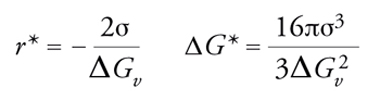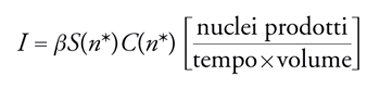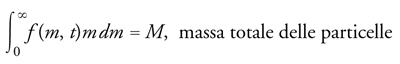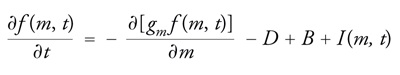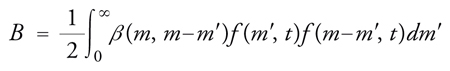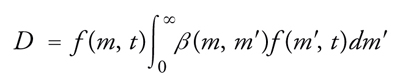Sistemi dispersi
Sistemi dispersi
I sistemi dispersi sono costituiti da una moltitudine di particelle condensate presenti all'interno di un fluido. La conoscenza delle loro caratteristiche ha un ruolo importante nella descrizione di diversi fenomeni naturali e nello sviluppo di particolari tecnologie volte alla preparazione di prodotti di largo consumo.
Si immagini di mettere in atto un processo di suddivisione mediante il quale viene aumentata progressivamente la superficie di un materiale massivo sezionandolo in strutture laminari, quindi fibrillari, e infine corpuscolari. Gli atomi prossimi alla superficie si trovano in uno stato energetico diverso da quelli presenti all'interno del solido, poiché le forze di interazione reciproca non risultano del tutto bilanciate. Essi presentano quindi una parziale saturazione dei legami, che si completa con molecole del fluido che vengono a contatto con il solido. Risulta allora opportuno esprimere l'energia totale Et di un solido ‒ data dalla somma dell'energia cinetica vibrazionale degli atomi e di quella potenziale dovuta alle loro interazioni ‒ come somma di due contributi, dovuti rispettivamente all'energia interna Ei e all'energia superficiale Es:
Et = Ei + Es = eiV + esA
dove ei indica l'energia interna per unità di volume ed es l'energia superficiale per unità di superficie, mentre V e A sono rispettivamente il volume e l'area della superficie del solido. Ne consegue che
formula.
I sistemi che verranno presi in considerazione sono costituiti da insiemi di particelle per le quali il rapporto (A/V) è dell'ordine di 106÷107 cm−1, disperse in un mezzo fluido, e classificabili come aerosol, emulsioni e colloidi. Poiché il secondo termine del secondo membro della precedente equazione è molto più elevato del primo, esso assume un ruolo preponderante, conferendo particolare importanza all'energia superficiale delle particelle stesse. Le ricerche nel campo della chimica fisica dei sistemi dispersi sono quindi rivolte sia allo studio delle caratteristiche delle superfici interfasiche di contatto delle particelle con l'ambiente circostante, sia alla stabilità delle dispersioni stesse, sulla quale giocano un ruolo determinante le forze che agiscono fra le particelle limitando i processi di coagulazione o di flocculazione.
In generale è opportuno distinguere le dispersioni delle sostanze inorganiche dalle soluzioni di polimeri e di composti organici. In questo ultimo caso risultano di particolare interesse quei sistemi nei quali le molecole, in virtù della loro particolare struttura in parte idrofila e in parte idrofoba, tendono a organizzarsi formando degli aggregati micellari. Fra le molecole coinvolte, dette anfifiliche, rientrano per esempio i sali alcalini degli acidi grassi, gli alchilsolfonati e altre che agiscono come tensioattivi perché diminuiscono la tensione superficiale dell'acqua e vengono quindi impiegate nei detersivi. L'importanza del loro studio è costituita anche dal fatto che, essendo sistemi molecolari che si autorganizzano, dànno origine a una varietà di strutture che comprendono le micelle sferiche, quelle cilindriche e lamellari, e costituiscono pertanto interessanti modelli delle strutture presenti nei sistemi viventi, quali le membrane lipidiche.
Un ulteriore aspetto che riguarda i sistemi dispersi, deriva dalla tendenza delle superfici inorganiche a caricarsi elettricamente formando un doppio strato elettrico superficiale che, oltre a contribuire alla loro stabilità, dà anche luogo a particolari fenomeni chiamati elettrocinetici, fra i quali meritano una particolare menzione l'elettrosmosi e l'elettroforesi che si possono considerare complementari. La prima si manifesta con il trasporto di liquido in seguito all'applicazione di una differenza di potenziale fra gli estremi di un mezzo poroso imbevuto d'acqua. Se una differenza di potenziale viene invece applicata a una dispersione di particelle solide in acqua esse si muovono verso il polo positivo. Questo fenomeno di trasporto di una fase dispersa per effetto di un campo elettrico, detto quindi trasporto elettroforetico, ha importanti applicazioni nella separazione selettiva dei diversi componenti presenti in una dispersione colloidale, e trova un utile impiego nella separazione di macromolecole quali le proteine. Esso riveste pertanto un particolare interesse nelle tecnologie biochimiche.
Tipologia dei sistemi dispersi
I sistemi dispersi sono costituiti da particelle di piccole dimensioni (comprese fra 10−8 e 10−3 m), separate fra loro da un mezzo fluido. La loro classificazione è pertanto basata sia sulla natura e sulle proprietà dei liquidi o dei solidi che costituiscono la fase dispersa, sia sulle caratteristiche del mezzo disperdente. La situazione più comune è quella degli aerosol, nei quali particelle solide o liquide sono disperse in un gas. I fumi sono esempi del primo tipo, mentre le nebbie lo sono del secondo. Le dispersioni di gas in liquidi con elevata tensione superficiale danno origine anche alle schiume, mentre quelle di goccioline liquide, aventi dimensioni comprese fra un nanometro (nm) e un micron (μm), in un altro liquido vengono chiamate emulsioni. In generale, i sistemi costituiti da piccole particelle o da macromolecole di dimensioni comprese nell'intervallo ora menzionato e disciolte in un liquido vengono chiamati colloidi. Questo termine è stato impiegato per la prima volta da Thomas Graham nel 1861 per classificare le sostanze sulla base della loro velocità di diffusione nelle soluzioni e, soprattutto, della loro capacità di passare attraverso le membrane semipermeabili. Le sostanze che diffondono rapidamente e che passano facilmente attraverso tali membrane sono definite cristalloidi, perché possono essere facilmente ottenute allo stato cristallino; viceversa le altre sostanze, quali le gelatine, che diffondono lentamente in soluzione e che non passano attraverso le membrane, sono definite colloidi per il loro aspetto che richiama quello dei comuni adesivi liquidi. Peraltro molti di questi materiali non possono essere cristallizzati.
Per distinguere i colloidi dalle sospensioni macroscopiche, essi vengono chiamati sol, anche se si tratta di una distinzione non sempre soddisfacente. In particolari condizioni i sistemi colloidali possono manifestare le caratteristiche dello stato solido, poiché le molecole del solvente vengono intrappolate e, almeno parzialmente, immobilizzate in un reticolo in seguito alla formazione di legami chimici e fisici fra le molecole della fase dispersa. In questo stato vengono chiamati gel. La transizione da sol a gel può essere reversibile o irreversibile e dipende dalle sollecitazioni chimiche e fisiche cui viene sottoposta la dispersione. Gli aerosol sono però sempre irreversibili. Dal punto di vista metodologico, le ricerche che vengono condotte sui sistemi dispersi richiedono l'impiego di tecniche sofisticate, per lo più ottiche, per determinare le dimensioni, la distribuzione, la forma e la flessibilità delle particelle. L'analisi delle loro caratteristiche superficiali viene eseguita impiegando, oltre alla microscopia, l'adsorbimento di gas e la misura di campi elettrici superficiali. Lo studio delle interazioni fra le particelle e le molecole del solvente permette di individuare i fattori che determinano la stabilità delle dispersioni che, dal punto di vista termodinamico, tenderebbero a coagulare a causa dell'elevato valore della loro energia libera superficiale. La stabilità è dovuta a fattori cinetici, perché la repulsione fra le particelle limita in modo significativo la velocità dei processi di coagulazione.
L'applicazione di tali principî e metodologie trova ampio spazio nello studio di sistemi naturali quali le proteine, nella preparazione di prodotti di largo uso e nello sviluppo di moderne tecnologie industriali. Fra i prodotti rientrano i materiali polimerici, le gomme, le vernici, i detersivi, la carta, alcuni prodotti farmaceutici, alcuni materiali solidi impiegati in elettronica, alcuni prodotti alimentari e altri ancora. Fra i processi industriali la cui progettazione e gestione richiedono ampie conoscenze sui sistemi dispersi rientrano alcune tecnologie di separazione, la sintesi dei materiali polimerici, la separazione dei minerali per flottazione e altre tecniche. Infine, la scienza dei sistemi dispersi interviene nelle ricerche sul comportamento dell'atmosfera, nella quale sono presenti diverse particelle solide o liquide che provengono da sorgenti naturali o da attività di origine antropica.
Struttura e dimensioni delle particelle
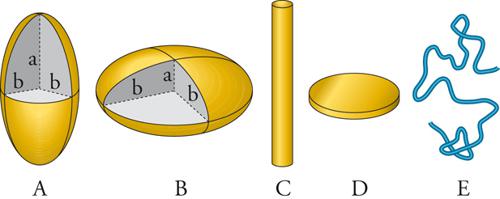
La forma più semplice che si può attribuire alle particelle di un sistema disperso è ovviamente quella sferica. Infatti molti sistemi colloidali, quali le emulsioni e gli aerosol liquidi, sono costituiti da particelle quasi sferiche. Anche le particelle cristalline sono spesso sufficientemente simmetriche da poter essere assimilate a sfere. Le molecole polimeriche e alcune proteine, a loro volta, si avvolgono su se stesse comportandosi talora come sfere. In realtà, le asimmetrie rispetto alla forma sferica costituiscono un fattore importante nel determinare le proprietà delle dispersioni, in particolare quelle meccaniche. La forma delle particelle è molto varia, ma in prima approssimazione esse possono essere classificate sulla base di semplici modelli geometrici, come quelli illustrati nella fig. 2. Molte proteine hanno una forma che si approssima a quella di un ellissoide di rotazione, il quale, a seconda del rapporto esistente fra i semiassi a e b, viene detto oblato (a/b〈1) o prolato (a/b>1). Le particelle di ossidi metallici e di argilla hanno una configurazione piatta a disco. In generale, la caratterizzazione della morfologia delle particelle non è banale. Solitamente le loro dimensioni vengono determinate usando tecniche di classificazione meccanica mediante setacci, tecniche di sedimentazione, l'analisi microscopica, misure del campo elettrico superficiale e di dispersione della luce. Quest'ultimo approccio è quello che ha avuto maggiore sviluppo attraverso il trattamento delle immagini computerizzate.
I materiali polimerici dànno luogo a colloidi macromolecolari nei quali le lunghe molecole filiformi, con eventuali ramificazioni, sono disperse in un opportuno solvente. Ciò rende possibili le interazioni fra i diversi segmenti delle catene attraverso le forze di non legame, dette di van der Waals, o anche attraverso i legami a idrogeno o legami chimici covalenti veri e propri, che nell'insieme contribuiscono a modificare le proprietà meccaniche delle dispersioni. Tali molecole manifestano fra l'altro una notevole flessibilità dovuta alla rotazione attorno ai legami singoli, in particolare quelli fra due atomi di carbonio. Ne consegue che la loro forma è soggetta a un continuo cambiamento: pertanto gli studi teorici vengono spesso condotti assimilandole a corde avvolte su se stesse in modo casuale. I sistemi nei quali tutte le particelle hanno la stessa dimensione vengono detti monodispersi; essi possono essere ottenuti solo con particolari accorgimenti. Solitamente si ha però a che fare con sistemi polidispersi, nei quali le dimensioni delle diverse particelle differiscono e presentano una distribuzione il cui andamento dipende dal modo in cui è stata preparata la dispersione stessa.
Stabilità dei sistemi dispersi
Per descrivere il comportamento di una dispersione è opportuno assimilare le particelle in essa presenti alle molecole di un fluido. Più propriamente, essa viene assimilata a un fluido sopramolecolare le cui particelle sono soggette a moti browniani. Infatti le particelle con diametri inferiori a 5 μm, sospese in un liquido, manifestano caratteristici movimenti irregolari a zig-zag, dovuti agli urti non bilanciati con le molecole del mezzo disperdente. Questi movimenti, che possono essere osservati all'ultramicroscopio, sono stati individuati per la prima volta dal botanico Robert Brown nel 1827. L'interpretazione del fenomeno è stata data da William Ramsay nel 1876, mentre la sua descrizione quantitativa è stata formulata successivamente da Marian Smoluchowski e Albert Einstein agli inizi del secolo scorso. In tale quadro le proprietà della dispersione si possono valutare applicando i metodi della termodinamica statistica e della teoria cinetica, attraverso la conoscenza delle leggi che esprimono l'interazione fra le particelle. Per approfondire l'argomento della stabilità delle dispersioni, in particolare dei sistemi colloidali, è opportuno evidenziare che essa è essenzialmente dovuta all'adsorbimento di cationi o anioni provenienti dalla soluzione, che conferiscono una carica elettrica alla superficie delle particelle disperse. Un esempio è offerto dalle particelle di silice disperse in acqua che dànno origine superficialmente ad acido silicico, il quale subisce a sua volta un'ulteriore dissociazione ionica:
[3] formula.
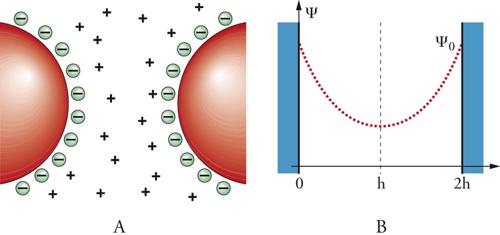
Sulla superficie delle particelle vengono così segregate delle cariche negative che, a loro volta, esercitano un'azione attrattiva sugli idrogenioni presenti nella soluzione, con conseguente formazione di un doppio strato elettrico avente le caratteristiche illustrate nella fig. 3. Esso è costituito da due regioni: quella interna, che include gli ioni adsorbiti sulla superficie, e quella diffusa, nella quale gli ioni presenti nella soluzione sono distribuiti secondo l'influenza delle interazioni elettrostatiche e dei movimenti termici casuali. In generale, quindi, l'adsorbimento di ioni inorganici od organici produce una barriera di energia elettrostatica che impedisce alle particelle di coagulare, con formazione di una fase precipitata, termodinamicamente più stabile. Il modello per descriverne il comportamento è stato sviluppato da Evert J. Verwey e Theo Overbeek e, indipendentemente, da Boris Derjagin e Lev Davidovič Landau, per cui viene contraddistinto con l'acronimo DLVO. Se le particelle sono sufficientemente grandi, l'interazione fra esse può essere espressa in funzione della distanza 2h fra due superfici parallele. Le particelle si respingono per effetto delle loro cariche elettrostatiche schermate dagli ioni presenti nella soluzione attraverso un potenziale VR(h), e si attraggono per effetto di un potenziale VA(h) dovuto alle interazioni di non legame determinate dalle forze di van der Waals, che si manifestano fra i diversi atomi presenti nelle particelle stesse. Tali interazioni, dette anche dispersive, risultano, secondo una classica trattazione sviluppata da Fritz Wolfgang London, inversamente proporzionali alla sesta potenza della distanza fra i due atomi considerati e devono essere sommate su tutti gli atomi appartenenti a due particelle.
Globalmente il potenziale di interazione fra due particelle risulta allora descritto da una funzione data dalla somma di entrambi i contributi, attrattivo e repulsivo:
[4] formula.
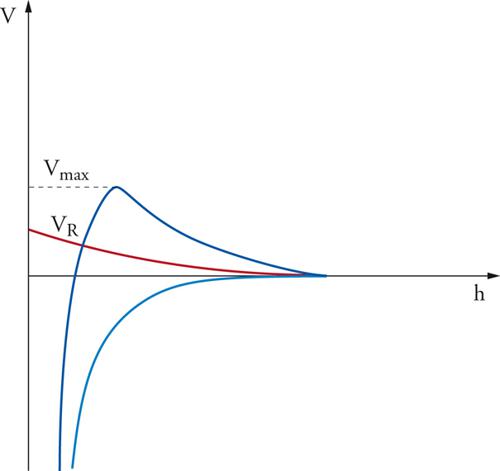
La costante A′, detta di Hamaker, dipende dalla natura del materiale presente nelle particelle e ha un valore che si aggira intorno a 10−20÷10−19 J. In realtà, la presenza di un mezzo disperdente, invece del vuoto, abbassa il valore dell'energia attrattiva e se ne può tener conto modificandola opportunamente. L'andamento dell'equazione precedente è rappresentato nella fig. 4. L'energia presenta un massimo e quindi scende verso valori negativi che portano alla formazione di un agglomerato fra due particelle. Perché ciò avvenga è necessario superare una barriera di energia potenziale, la cui entità dipende dal valore dei diversi parametri che compaiono nella relazione precedente e che sinteticamente sono stati compendiati nel parametro B per quanto concerne la parte repulsiva. Di particolare interesse è il ruolo del parametro χ‚ che dipende dal prodotto fra la concentrazione degli ioni in soluzione e il quadrato della loro carica. Come illustrato nella fig. 5, all'aumentare di χ diminuisce l'altezza della barriera di potenziale e pertanto risulta agevolato il passaggio verso la configurazione più stabile che porta alla coagulazione delle particelle.
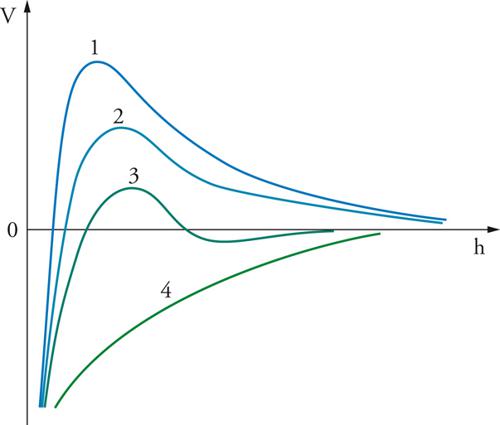
Sono stati effettuati anche calcoli volti a determinare la distribuzione spaziale delle particelle mediante il metodo Monte Carlo ed è interessante osservare che, quando la concentrazione volumetrica raggiunge valori relativamente elevati, si ottengono configurazioni periodiche, confermate sperimentalmente. Esse si riscontrano in sedimenti di gel metallici, nella deposizione elettroforetica di sospensioni, in dispersioni di lattici polimerici e in altre situazioni analoghe. Un'analisi della condizione di stabilità della dispersione può essere eseguita per via cinetica, valutando la velocità con la quale le particelle coagulano dopo aver subito una collisione. Sulla base della teoria formulata nel 1916 da Smoluchowski per interpretare l'evoluzione di una dispersione di particelle soggette a moti browniani, la velocità di coagulazione si scrive come segue:
[5] formula
dove N è la concentrazione delle particelle stesse e H=2h, a è il raggio della particella mentre k=(8kBT/3μ). Essa esprime la probabilità di avvicinamento di due particelle assimilate a sfere rigide che si muovono in un fluido continuo avente viscosità μ. La coagulazione viene descritta attraverso un processo bimolecolare e tiene conto della presenza della barriera di energia potenziale rappresentata nella fig. 6, che rallenta il processo di coagulazione. Se V=0, l'espressione al denominatore risulta uguale a 1 e la coagulazione viene detta rapida. In presenza di una barriera energetica, V è positivo e pertanto il valore del parametro W risulta superiore all'unità. Di conseguenza la velocità di coagulazione diminuisce. In pratica il valore di W per molti sistemi colloidali è dell'ordine di 107. In queste condizioni la coagulazione risulta trascurabile e il sistema appare stabile.
L'analisi precedente evidenzia che l'andamento della curva di energia potenziale e, soprattutto, l'altezza del suo massimo condizionano in modo significativo la probabilità di transizione verso la coagulazione del sistema disperso. Un altro punto importante è il ruolo esercitato dagli elettroliti che influenzano, attraverso il parametro χ‚ l'andamento della curva di energia potenziale. Si può dimostrare che l'inizio dell'instabilità si verifica in corrispondenza di un valore critico della concentrazione dell'elettrolita, Ccrit, che dà luogo alla coagulazione, la quale approssimativamente è inversamente proporzionale alla sesta potenza della valenza degli ioni. Ne consegue che la concentrazione di elettrolita richiesta per la coagulazione nel caso di ioni mono-, bi- e trivalenti sta nei rapporti 1:(1/2)6:(1/3)6=100:1,6:0,13. Questo risultato è in accordo con una regola empirica introdotta da Schulz e Hardy, basata sui risultati di una serie di esperimenti di coagulazione.
Formazione dei sistemi dispersi
Se si vogliono ottenere elevati gradi di dispersione, è opportuno procedere attraverso l'aggregazione di soluzioni molecolari soprasature che vengono fatte precipitare. Esistono diversi accorgimenti per conseguire tale risultato, quali la sostituzione di un buon solvente con uno meno buono, il raffreddamento o un'opportuna reazione chimica. Un esempio di queste reazioni è l'idrolisi del cloruro ferrico con acqua calda per formare il corrispondente ossido idrato:
[6] FeCl3 + H2O (calda) → Fe2O3 (idrato) .
In generale, la formazione di una nuova fase coinvolge due stadi distinti, chiamati rispettivamente di nucleazione e di crescita cristallina. Le dimensioni e la distribuzione della dispersione così ottenuta sono essenzialmente condizionate dalla velocità relativa dei due processi: se la velocità di nucleazione è alta, in senso relativo, si ottiene un elevato grado di dispersione.
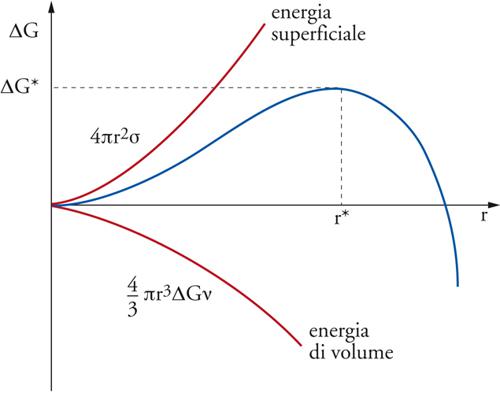
L'approccio più semplice alla descrizione dei processi di nucleazione, volto in particolare a stimare la velocità dei processi stessi e le dimensioni delle particelle che da essi si ottengono, è basato sulla cosiddetta approssimazione capillare, nella quale si valuta l'energia libera di formazione dei nuclei di cristallizzazione fruendo delle proprietà termodinamiche macroscopiche delle sostanze in esame. In particolare, la funzione energia libera di formazione di una particella ‒ o goccia sferica di raggio r ‒ da un vapore o da una soluzione soprasatura viene espressa come segue:
[7] formula
dove ΔGv è la variazione di energia libera per unità di volume nel passaggio dalla fase gassosa a quella condensata o da una fase liquida a una fase solida, mentre σ è una grandezza caratteristica del solido preso in considerazione, che esprime la sua energia per unità di superficie. L'andamento dell'espressione [7] è illustrato nella fig. 7, dove compare un massimo in corrispondenza di r*. La ricerca del valore del raggio corrispondente al massimo si effettua eguagliando a zero la derivata rispetto a r, e si ottiene
[8] formula
essendo ΔG* la barriera di energia libera necessaria per la formazione dei nuclei critici che preludono alla formazione di particelle stabili. In base alle relazioni precedenti e impiegando i valori di σ dei comuni materiali, si ottiene un valore del raggio r* molto piccolo, dell'ordine di 10 Å; compatibilmente con questo valore i nuclei contengono solo un centinaio di molecole. Questo risultato rende evidente un'inadeguatezza del modello, dovuta essenzialmente all'impiego in un calcolo condotto su particelle microscopiche di una grandezza σ determinata con esperienze macroscopiche condotte su superfici piane, ignorando così l'influenza della curvatura delle particelle.
In realtà, la trattazione precedente costituisce solo un primo livello di approssimazione per affrontare il problema in esame, poiché trascura anche gli effetti dovuti al depauperamento dei nuclei critici per effetto della loro crescita e alla rievaporazione delle molecole dai nuclei stessi. Per tenerne conto è stata formulata, da parte di diversi autori, una trattazione più accurata della cinetica della nucleazione, nella quale si assume che l'evoluzione dei nuclei proceda attraverso una successione di reazioni reversibili del tipo:
[9] A1 + An−1 ⇌ An
essendo A1 il monomero. Si tratta in sostanza di una successione di condensazioni ed evaporazioni di singole molecole. Attraverso un'opportuna trattazione statistica risulta che la velocità di nucleazione si può porre proporzionale al prodotto della frequenza delle collisioni β per la superficie dei nuclei critici S(n*)=4πr*2 e per la loro concentrazione C(n*) come segue :
[10] formula.
La precedente equazione, che descrive in modo soddisfacente la nucleazione omogenea attraverso la quale si formano, per esempio, gocce di liquido da un vapore, predice un netto aumento della velocità di nucleazione per un piccolo aumento della soprasaturazione, in accordo con i dati sperimentali. L'andamento della velocità di nucleazione in funzione della temperatura rivela che è presente un massimo accentuato dovuto al fatto che, all'aumentare della temperatura, in un primo tempo prevalgono gli effetti diffusivi mentre successivamente prevalgono quelli dipendenti dalla concentrazione dei nuclei critici, la quale tende ad annullarsi in corrispondenza della temperatura di fusione.
Evoluzione nel tempo di un sistema di particelle
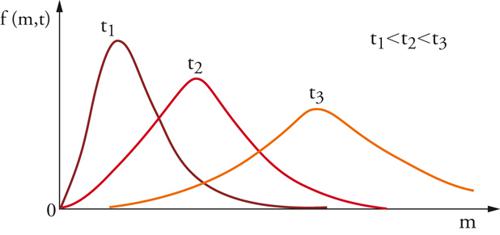
Lo studio dell'evoluzione nel tempo di uno sciame di particelle può essere agevolmente affrontato mediante metodi statistici, assumendo come variabile la massa m delle particelle. Le proprietà del sistema globale potranno allora essere descritte mediante una funzione di distribuzione tale che f (m,t)dm esprima il numero di particelle presenti al tempo t, con massa compresa fra m ed m+dm. Solitamente tale funzione, come illustrato nella fig. 8, ha un valore nullo per m uguale a zero, passa per un massimo e tende quindi asintoticamente a zero. Esistono ovviamente casi di maggiore complessità, relativi ai sistemi polidispersi, nei quali sono presenti più massimi. Se il sistema è soggetto a un'evoluzione, la funzione di distribuzione si trasforma nel tempo come indicato nella fig. 8. Inoltre valgono le seguenti relazioni di conservazione:
[11] formula
[12] formula.
Il comportamento dinamico del sistema è descritto dalla seguente equazione differenziale, nota come bilancio di popolazione e indicata con l'acronimo PBE (Population balance equation):
[13] formula
dove gm esprime la velocità di variazione della massa delle particelle per effetto sia della deposizione su di esse di alcuni componenti presenti nella fase fluida, che subiscono un'eventuale trasformazione chimica, sia per evaporazione di molecole in essa presenti. I due termini B (Birth) e D (Death) esprimono invece la variazione, per unità di tempo e volume, del numero delle particelle aventi un ben definito valore della massa per effetto della coalescenza. La coalescenza, ovviamente, fa nascere particelle di una particolare massa m′, somma di quelle delle particelle che collidono, e fa morire le particelle di massa m che vengono catturate nelle collisioni che portano a coalescenza. I due termini in esame hanno rispettivamente la forma
[14] formula
e
[15] formula,
dove β(m,m′) è un coefficiente di coagulazione fra particelle di massa m ed m′. Infine I(m,t) è, al solito, la velocità di formazione delle particelle attraverso un processo di nucleazione.
Sostituendo le ultime espressioni nell'equazione PBE si ricava un'equazione integrodifferenziale, la quale richiama la nota equazione di Boltzmann che è alla base di tutta la teoria cinetica dei fluidi. Ciò contribuisce ulteriormente a giustificare la menzionata analogia fra un gas e un sistema disperso che può essere assimilato a un fluido sopramolecolare. Essa è di grande importanza, poiché descrive l'evoluzione dinamica di un sistema di particelle; la sua integrazione può essere in generale eseguita o per simulazione con il metodo Monte Carlo, o mediante metodi numerici approssimati come quello dei momenti. Ovviamente tale risultato può essere raggiunto solo se si conoscono espressioni specifiche delle funzioni I, gm e β, che riflettono rispettivamente i fenomeni di nucleazione, crescita e coagulazione delle particelle e che costituiscono gli inalienabili ingredienti fisici del processo che si sta esaminando.
Aspetti applicativi
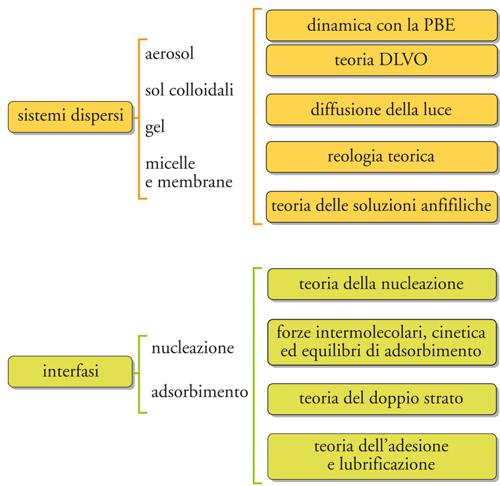
Nella fig. 9 sono riassunte in forma schematica le informazioni e i concetti discussi in precedenza, indicando i diversi settori nei quali sono utilizzati e in che modo questi si interconnettono. I settori applicativi per i quali si richiedono le competenze richiamate nella figura riguardano sia numerosi prodotti, costituiti da una dispersione colloidale (aerosol, materiali compositi, prodotti alimentari, additivi per oli, vernici, farmaci, ecc.) o da una soluzione di un tensioattivo (detersivi, erbicidi, insetticidi, ecc.), sia processi che fanno uso di tensioattivi o di altri fenomeni correlati ai sistemi dispersi (flottazione, trattamento delle acque, flocculazione selettiva, recupero assistito del petrolio, interventi per la tutela ambientale, analisi chimica e fisica dell'atmosfera, ecc.). Sotto il profilo ingegneristico, i settori precedenti contemplano l'applicazione delle tecnologie dei sistemi multifasici finemente suddivisi, quali le polveri fini, le microemulsioni, gli aerosol, i film sottili, le fibre, le schiume, le strutture porose, le superfici irregolari e le macromolecole. Molti dei fattori importanti in tali sistemi microeterogenei hanno ricadute anche sull'ingegneria delle reazioni chimiche; altri possiedono alcune proprietà tipiche dei sistemi colloidali e devono essere ancora esplorati a fondo.
Quest'ultimo è il caso, per esempio, dei semiconduttori costituiti da particelle colloidali che, in virtù delle loro dimensioni, presentano dei tipici effetti quantistici di potenziale interesse applicativo. Le loro proprietà ottiche ed elettroniche risultano peraltro più legate alla struttura delle molecole di cui sono costituiti che alle proprietà del materiale solido. Un esempio ci viene offerto dal fosfuro di cadmio, che in forma massiva si presenta come un solido nero, ma che può assumere un'ampia gamma di colorazioni se viene disperso in particelle con diametri compresi fra 2 e 10 nm. Inoltre, queste particelle sono in grado di promuovere effetti fotocatalitici che possono essere opportunamente modulati variando le dimensioni delle particelle stesse. Anche la sintesi di alcuni materiali inorganici impiegati in tecnologie avanzate viene effettuata in reattori nei quali si ottiene un aerosol di particelle ultrafini di elevata purezza e di dimensioni appropriate per le applicazioni previste. Quali esempi si possono citare i biossidi di titanio e silicio, diversi carburi, boruri e azoturi. Le polveri ultrafini così ottenute possono essere direttamente utilizzate per la fabbricazione di manufatti o sottoposte a ulteriori reazioni.
La tecnica impiegata per la loro sintesi consiste in un rapido riscaldamento, associato a una reazione chimica che ha luogo in fase vapore, con formazione di uno sciame di particelle diluito in una fase gassosa che lo trasporta verso uno stadio di separazione. Così si prepara per esempio il biossido di silicio SiO2, che viene ottenuto, a partire da tetracloruro di silicio, iniettando il reagente in una fiamma formata bruciando una miscela di idrogeno e ossigeno. Hanno luogo le seguenti reazioni:
[16] SiCl4 + O2 → SiO2 + 2Cl2
[17] SiCl4 + 2H2O → SiO2 + 4HCl .
Il processo avviene in un reattore operante a 1700 °C; in sostanza hanno luogo delle reazioni pirolitiche che producono molecole di SiO2, le quali successivamente danno origine a una dispersione di particelle attraverso processi di nucleazione e crescita come quelli precedentemente descritti. Le particelle di silice così ottenute possono essere fuse per produrre vetri sintetici, impiegati per la fabbricazione di fibre ottiche. Alternativamente possono essere fatte reagire con carbone suddiviso, riscaldando una miscela dei due precursori in atmosfera di azoto a 1800 °C. La reazione, agevolata dall'elevata superficie specifica dei materiali impiegati come reagenti, dà origine a una polvere di carburo di silicio (β-SiC) costituita da particelle aventi un diametro medio di circa 0,1 μm, dalla quale per sinterizzazione si ottengono materiali utilizzati come refrattari. Un processo analogo può essere impiegato per produrre, per esempio, carburo di boro, B4C, partendo dall'ossido ottenuto in un reattore ad aerosol attraverso la reazione 7C+2B2O3 ⇌ B4C+6CO, che solitamente avviene riscaldando in un arco elettrico ossido di boro e carbonio massivi. Si tratta di una reazione molto lenta che richiede diversi giorni per essere completata, a causa della difficoltà di sottrarre calore alla miscela reagente. Il processo risulta invece molto rapido se viene condotto riscaldando una miscela di B2O3 e carbone in polvere, preparati entrambi in opportuni reattori ad aerosol. Questo approccio permette di ottenere materiali più pregiati, perché più uniformi e quindi caratterizzati da una più elevata durezza, con un minore dispendio di energia.
Dinamica dell'aerosol troposferico
La troposfera, la parte più bassa dell'atmosfera, si eleva a 10÷15 km di altezza dal suolo e include più dell'80% della massa atmosferica; in essa si svolge gran parte dei fenomeni meteorologici che riguardano il nostro pianeta. Nella troposfera sono presenti particelle provenienti da diverse sorgenti naturali, quali le polveri trascinate dai venti, gli spruzzi marini, le emissioni dei vulcani e particelle di origine antropica, come per esempio quelle derivanti dalla combustione. Solitamente si distingue fra un aerosol primario, costituito dalle particelle che vengono rimosse dal suolo e trasportate nell'atmosfera, e uno secondario, costituito da quelle che si formano attraverso le trasformazioni chimiche che avvengono nell'ambiente stesso. Le dimensioni e la composizione delle particelle possono cambiare per coagulazione con altre particelle, per reazioni chimiche o per condensazione dell'acqua che le trasforma in nebbia o gocce liquide. Le particelle vengono successivamente rimosse dall'atmosfera attraverso due meccanismi: il primo è costituito dalla deposizione sulla superficie terrestre, mentre il secondo è dovuto alla cattura da parte di gocce liquide durante le precipitazioni. L'aerosol atmosferico influisce in modo significativo anche sulla radiazione solare, una parte della quale viene direttamente diffusa o assorbita, influenzando a sua volta la formazione delle nuvole poiché favorisce la condensazione del vapor d'acqua sulle particelle stesse.
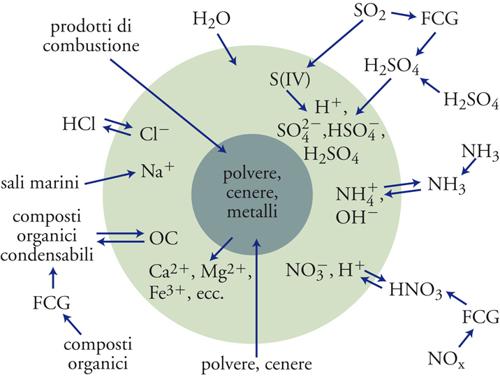
L'insieme di questi fenomeni sottolinea l'importanza di simulare e al limite prevedere il comportamento delle dispersioni atmosferiche, approfondendo le interazioni fra i processi chimici e fisici in esso coinvolti e tenendo opportunamente conto degli effetti dovuti alle attività umane. Si tratta ovviamente di un problema di grande rilevanza, ma anche di elevata difficoltà, poiché comporta la previsione delle dimensioni, della composizione, delle proprietà igroscopiche e della capacità di diffondere e assorbire le radiazioni elettromagnetiche delle particelle che costituiscono l'aerosol atmosferico. Le specie che maggiormente influenzano la sua composizione sono l'acido solforico (H2SO4), l'acido nitrico (HNO3), l'acido cloridrico (HCl), l'ammoniaca (NH3) e una serie di composti organici contenenti più di cinque atomi di carbonio per molecola. Questi composti possono essere considerati i precursori di un'ampia e complessa serie di reazioni chimiche che contribuiscono alla formazione e all'evoluzione delle particelle stesse, come illustrato nella fig. 10.
I modelli matematici che vengono impiegati per comprendere e descrivere l'evoluzione dinamica dell'aerosol atmosferico derivano dall'equazione PBE. Da un lato a causa della complessità e della molteplicità dei fenomeni coinvolti e delle scale spaziali su cui vanno considerati (che variano da quella urbana a quella planetaria), dall'altro per il fatto di essere fenomeni molto diversificati che coinvolgono il trasporto o le trasformazioni delle particelle e che avvengono perciò su scale temporali molto diverse, è opportuno formulare equazioni di bilancio diverse a seconda delle diverse scale spaziali e temporali, così che esse costituiscano, in un certo senso, le tessere di un ampio mosaico in grado di fornire la simulazione globale del sistema preso in considerazione.
Bibliografia
Carpenter 1966: Carpenter, Dewey K., Colloids, in: Encyclopedia of polymer science and technology: plastics, resins, rubbers, fibers, edited Herman F. Mark, Norman G. Gaylord, Norbert M. Bikales, New York, 1966, III, pp. 16-73.
Carrà 1978: Carrà, Sergio, Struttura e stabilità: introduzione alla termodinamica dei materiali, Milano, Mondadori, 1978.
Carrà 1986: Carrà, Sergio, Chimica fisica dei sistemi dispersi, ‟La chimica e l'industria", 68, 1986, 3, pp. 61-71.
De Boer 1968: de Boer, Jan H., The dynamical character of adsorption, 2. ed., Oxford, Clarendon Press, 1968.
Fan 1994: Fan, Liang-Shi e altri, Particle technology: the potential of reaction engineering, ‟Chemical engineering progress", 90, 1994, pp. 55-64.
Flory 1953: Flory, Paul J., Principles of polymer chemistry, Ithaca (N.Y.), Cornell University Press, 1953.
Fridrikhsberg 1986: Fridrikhsberg, Dimitri A., A course in colloid chemistry, Moscow, Mir, 1986 (ed. orig. in russo: 1974).
Israelachvili 1985: Israelachvili, Jakob N., Thermodynamics and geometric aspects of amphiphile aggregation into micelles, vesicles and bilayers, and interactions between them, in: Physics of amphiphiles: micelles, vesicles, and microemulsions, edited by Vittorio Degiorgio, Mario Corti, Amsterdam-New York, North-Holland, 1985, pp. 24-58.
Matijevich 1969-1987: Surface and colloid science, edited by Egon Matijevich e altri, New York, Wiley-Interscience, 1969-1987, 14 v.
Ostwald 1915: Ostwald, Wolfgang, Die Welt der vernachlässigten Dimensionen, Dresden-Leipzig, Steinkopff, 1915.
Pandis 1995: Pandis, Spyros N. - Wexler, Anthony S. - Seinfeld, John H., Dynamics of tropospheric aerosol, ‟Journal of physical chemistry", 99, 1995, pp. 9646-9659.
Pound 1972: Pound, Guy M. - Nishioka, Kazumi - Lothe, Jens, Theory of homogeneous nucleation from the vapour, in: Surface chemistry and colloids, edited by Milton Kerker, London, Butterworths; Baltimore, University Park Press, 1972, pp. 147-188.
Shaw 1970: Shaw, Duncan J., Introduction to colloid and surface chemistry, 2. ed., London, Butterworths, 1970.
Vold, Vold 1983: Vold, Robert D. - Vold, Marjorie J., Colloid and interface chemistry, Reading (Mass.)-London, Addison-Wesley, 1983.
Voyutsky 1978: Voyutsky, Sergej S., Colloid chemistry, Moscow, Mir, 1978.