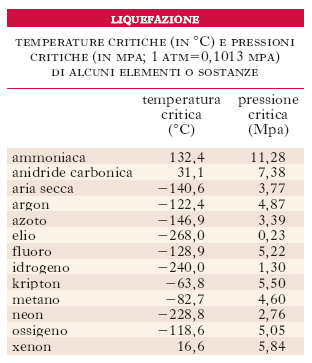
liquefazione
Passaggio dallo stato gassoso (o aeriforme) allo stato liquido. La l. di un aeriforme può avvenire, per sola compressione, soltanto se l’aeriforme è a temperatura inferiore alla temperatura critica (cioè, propriamente, se l’aeriforme è un vapore, essendo gas a temperature superiori alla temperatura critica). A ciascuna temperatura uguale o inferiore alla temperatura critica la l. avviene a una determinata pressione; quella corrispondente alla temperatura critica si chiama pressione critica; man mano che la temperatura si abbassa, anche la pressione occorrente per la l. si abbassa (v. tab.; ➔ gas). Qualunque sia la temperatura (purché inferiore a quella critica), la l. è sempre accompagnata da sviluppo di calore: la quantità di calore che a una data temperatura si libera dall’unità di massa dell’aeriforme quando questa si trasforma nell’unità di massa liquida si chiama calore di l. (alla temperatura considerata); il calore di l. è uguale al calore di evaporazione. Alcuni aeriformi (ossigeno, azoto, idrogeno ecc.) furono a lungo considerati non liquefacibili e detti perciò ‘permanenti’ o ‘incoercibili’: si tratta invece di aeriformi a temperatura critica bassissima (per es., per l’ossigeno, −118,6 °C) e quindi non liquefacibili per sola compressione a temperatura ambiente.
K.P.G. von Linde ottenne la l. dell’aria nel 1895 (➔ aria); è del 1898 (J. Dewar) la l. dell’idrogeno; del 1908 (H. Kamerlingh Onnes) quella dell’elio (la cui temperatura critica è −268 °C, cioè 5 K).