immunoterapia
Originariamente, la cura, attuata per alcune malattie infettive (scarlattina, tifo ecc.), consistente nella somministrazione di vaccini o di sieri specifici, per realizzare uno stato di immunità, rispettivamente attiva o passiva. Il termine si è poi esteso a indicare tutti gli interventi (farmacologici, vaccinali, sierologici, di manipolazione cellulare) in grado di agire sul sistema immunitario per modularne le funzioni. Nell’ambito dell’i. si distinguono l’immunopotenziamento e l’immunosoppressione.
Immunopotenziamento
Questo processo amplifica o modifica in vario modo le componenti che costituiscono la risposta immunitaria. Nel gruppo dei meccanismi specifici di controllo immunitario si distinguono: vaccinazioni, impiego di anticorpi (terapia xenogenica e uso di sieri iperimmuni), immunopotenziamento adottivo. La vaccinazione consiste nel potenziare le difese dell’ospite consentendo la produzione di anticorpi e generando cloni di cellule sensibilizzate in grado di agire su un substrato antigenico nel modo più efficace possibile. Le biotecnologie hanno permesso di produrre vaccini sempre più efficaci, impiegando come immunogeni molecole ricavate da batteri o virus ed evitando così di somministrare il patogeno intero (sia ucciso sia inattivato). Un buon progresso in questo senso si è avuto con la preparazione di vaccini sintetici. Un altro sistema di preparazione è quello dei vettori eterologhi attenuati. Con questa tecnica alcuni virus vengono attenuati (privati cioè del loro potenziale patogeno) e diventano vettori di molecole immunogene verso le quali si vuole ottenere la risposta immunitaria. La tecnica del DNA ricombinante ha rappresentato un altro sensibile progresso. Essa si fonda sulla possibilità di inserire un gene isolato, codificante le molecole immunogene, in un sistema di replicazione naturale: utilizzando cellule batteriche, lieviti o cellule di mammifero, si può provvedere alla sintesi e alla purificazione di prodotti utilizzabili per le vaccinazioni.
L’uso di immunostimolanti aspecifici rappresenta un capitolo ancora in evoluzione. Un modo semplice di classificare gli immunostimolanti si può basare sull’origine e sulle modalità di preparazione dei vari prodotti. Possono pertanto essere distinti prodotti di origine fisiologica (ormoni timici, interferoni, citochine), molecole sintetiche (levamisolo, metisoprinolo, componenti lipopeptidici, induttori della sintesi di interferoni) o molecole di origine biologica e batterica (BCG, bacillo di Calmette Guérin; Corynebacterium parvum, estratti batterici variamente selezionati, endotossine). L’interferenza dei prodotti immunostimolanti aspecifici sulle cellule della risposta immunitaria rappresenta uno dei problemi più complessi. Infatti, se è possibile in prima approssimazione distinguere i vari agenti in rapporto alla specifica cellula bersaglio, non si deve dimenticare la forte interazione che si verifica nei vari momenti della risposta immunitaria stessa; pertanto gli aspetti funzionali e quantitativi conseguenti a una stimolazione primaria vanno accuratamente valutati, ai fini di una corretta interpretazione del risultato finale.
Nell’ambito dell’immunopotenziamento con molecole naturali ha assunto un ruolo importante l’uso delle immunoglobuline per via endovenosa (terapia sostitutiva e immunomodulante), adottato dapprima nei deficit congeniti della risposta umorale (ipo-agammaglobulinemie originate da varie cause) e quindi, grazie a osservazioni sperimentali e cliniche, nel trattamento di alcune malattie autoimmuni o disregolative, tra cui alcune sindromi neurologiche, piastrinopenie e la malattia di Kawasaki.
Immunosoppressione
Gli sviluppi dell’impiego di farmaci ad azione immunosoppressiva sono mirati al trattamento delle malattie autoimmuni e al controllo del rigetto dei trapianti d’organo. Sono noti vari preparati farmaceutici (cortisonici, citostatici, antimitotici, antimetaboliti, inibitori della sintesi purinica ecc.), mezzi ad azione fisica (radioterapia) e alcuni preparati biologici adatti allo scopo.
I farmaci immunosoppressivi svolgono la loro azione deprimendo la risposta del sistema immunitario sia per le reazioni mediate da anticorpi, sia per la fase più strettamente cellulo-mediata. In tal modo si osserva una sostanziale riduzione dei processi infiammatori che rappresentano il substrato anatomopatologico delle lesioni proprie delle malattie del connettivo. I corticosteroidi esercitano un’azione antinfiammatoria e immunosoppressiva, riducendo il numero dei linfociti T con funzione helper circolanti nel sangue, deprimendo la capacità della risposta agli antigeni T-dipendenti e inibendo la produzione di alcuni mediatori chimici (citochine), in grado di attivare momenti funzionalmente critici della risposta immunitaria. I citostatici agiscono in varie fasi della sintesi degli acidi nucleici; possono essere raggruppati in base al meccanismo d’azione e pertanto divisi in alchilanti (ciclofosfamide, clorambucil), analoghi delle purine (6-mercaptopurina, azatioprina) e antagonisti dell’acido folico (metotrexate). La ciclofosfamide ha un’azione sulla fase premitotica della proliferazione cellulare e ha come bersaglio monociti, cellule precursori dei macrofagi, il gruppo delle NK e i linfociti B. L’azatioprina agisce interferendo sulla sintesi di DNA nella fase S del ciclo cellulare e svolgendo un ruolo precipuo su cellule che hanno una funzione citotossica (linfociti T citotossici, cellule NK, azione citotossica mediata da anticorpi); molto usata nelle malattie autoimmuni, è spesso impiegata in associazione ai corticosteroidi e consente una modulazione del dosaggio anche in rapporto alla necessità di prevenire o ridurre nel tempo, quanto più possibile, gli effetti collaterali determinati dalla somministrazione steroidea. Il metotrexate agisce inibendo sia la formazione di RNA sia quella di DNA e ha un’azione prevalente sulla sintesi degli anticorpi. Una molecola chiave nella storia dell’i. è la ciclosporina, molecola dotata di attività sia antinfiammatoria sia immunosoppressiva. Impiegata inizialmente quale potente immunosoppressore per prevenire il rigetto in caso di trapianto, è stata ben presto utilizzata anche nelle malattie a patogenesi autoimmune. Il livello di azione riguarda sia la risposta anticorpale sia l’azione linfocitaria T cellulomediata.
I. dei tumori
Gli studi sulla risposta immunitaria alla crescita neoplastica si basano sulla capacità del sistema immunitario, in alcune condizioni biologiche, di controllare e/o eliminare la crescita delle cellule cancerose. Affinché sia possibile attuare questa funzione, le cellule linfocitarie e le altre componenti del sistema immunitario (umorali o cellulari) debbono essere in grado di discriminare tra cellule cancerose e cellule sane. Il meccanismo consiste nel riconoscimento di un antigene tumorale specifico che sia espresso sulle cellule tumorali o nell’identificazione di antigeni associati alla crescita neoplastica.
La possibilità che il sistema immunitario agisca, o venga stimolato ad agire, terapeuticamente verso i tumori è stata teorizzata sulla base di osservazioni sperimentali e di rilievi clinico-epidemiologici. Il tentativo di risolvere il problema dell’i. dei tumori segue linee di approccio che tengono conto sia dell’eziopatogenesi di alcuni tumori (virus, oncogeni, cofattori), sia della fase nella quale il tumore può essere aggredito. Per es., nella preparazione di un vaccino antitumorale in corso di neoplasie già clinicamente diagnosticabili è necessario considerare che alcune mutazioni geniche possono indurre trasformazioni molecolari associate al tumore. Poiché gli oncogeni, o le molecole regolatrici degli oncogeni, sono coinvolti nelle fasi di proliferazione cellulare, è possibile che si abbiano mutazioni in grado di esprimere proteine o peptidi capaci di stimolare la risposta cellulomediata dei linfociti T.
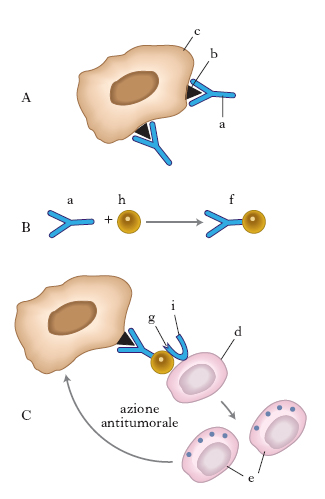
Dato che i tentativi di immunizzazione con cellule tumorali o con antigeni purificati del tumore non hanno fornito dati incoraggianti, sono stati compiuti numerosi tentativi per amplificare la capacità di risposta immunitaria verso i tumori o per stimolare l’immunogenicità stessa delle cellule cancerose. Alcune linee di ricerca hanno proposto l’elaborazione di molecole ibride, ottenute combinando varie caratteristiche di componenti diverse. Tra queste merita interesse l’associazione tra un anticorpo antitumorale e un superantigene (cioè una particolare molecola, spesso di origine batterica, in grado di attivare linfociti T a prescindere dalla specificità del riconoscimento antigenico). Poiché la risposta cellulomediata sembra svolgere un ruolo critico nel controllo della crescita tumorale, il modello elaborato prevede che l’anticorpo riconosca l’antigene tumorale e che il superantigene a esso aggregato sia in grado di attivare il linfocito T, il quale a sua volta attacca il superantigene come falso bersaglio e distrugge di conseguenza la cellula tumorale (v. .).
Altri progressi sono stati ottenuti ricorrendo all’impiego di molecole regolatrici della risposta immunitaria (citochine) che in vario modo interagiscono sulle cellule deputate al controllo della crescita neoplastica. Alcune di queste molecole hanno già trovato applicazione in terapia e rappresentano in ogni caso un modello applicativo in notevole espansione. Si tratta in particolare degli interferoni (IFN) e delle linfochine.
Ulteriori prospettive per l’i. dei tumori si sono aperte con l’applicazione delle biotecnologie, che consentono di produrre anticorpi monoclonali antitumorali. Un altro modello consiste nel produrre anticorpi monoclonali verso bersagli predefiniti (antigeni tumorali specifici o associati alla crescita neoplastica). L’anticorpo diventa il vettore di una molecola citotossica che raggiunge il bersaglio, evitando di colpire o coinvolgere in modo significativo le cellule sane. Malgrado le difficoltà di questa linea di studi, sembra ragionevole ipotizzare che una migliore conoscenza di antigeni tumorali critici possa costituire la base per una futura ed efficace applicazione dell’i. antitumorale mediata da anticorpi monoclonali.