globina
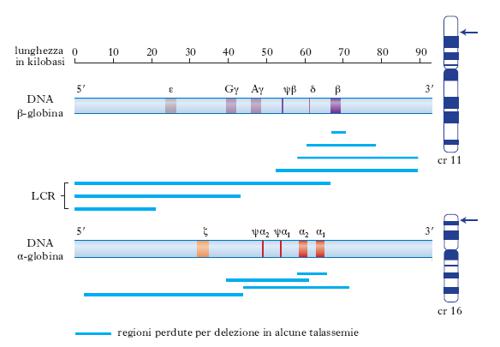
La componente proteica dell’emoglobina. Tutti i geni funzionali delle g. hanno sia la stessa struttura generale, divisa in 3 esoni, sia sequenze nucleotidiche molto simili; è lecito pertanto ipotizzare che tutti i geni delle g. siano derivati da un singolo gene ancestrale che si è duplicato e poi modificato nel corso dell’evoluzione per formare emoglobine adatte alla diversa complessità degli organismi. Nell’uomo i geni globinici fanno parte di due clusters di geni chiamati α e β, localizzati rispettivamente sui cromosomi 16 e 11. Questi clusters comprendono, oltre ai due geni principali dell’adulto α e β, sequenze che sono espresse in diverse fasi dello sviluppo. I geni sono disposti sul cromosoma in maniera tale che tutti hanno la stessa direzione di trascrizione a partire dall’estremità 5′ del DNA, e la posizione del gene all’interno del gruppo rispecchia la successione della sua espressione durante lo sviluppo. Entrambi i clusters contengono pseudogeni, vestigia di geni un tempo funzionanti, e in entrambi la maggior parte del DNA non è codificante e ha funzione sconosciuta, probabilmente non indispensabile. La fig. 1 mostra la successione dell’espressione dei geni funzionali in entrambe le famiglie durante lo sviluppo. Durante le prime settimane di vita nel sacco vitellino ha luogo la sintesi dell’emoglobina, costituita da un tetramero composto da due catene ζ e due catene ε. La produzione di queste due catene globiniche diminuisce velocemente e precocemente mentre inizia la trascrizione dei geni α, presenti in doppia copia, α1 e α2. Il cluster β-globinico contiene un altro gruppo di geni, quelli delle emoglobine fetali γ, anch’essi presenti in doppia copia; le due regioni codificanti differiscono per un solo amminoacido, cioè glicina per Gγ e alanina per Aγ. I geni γ sono trascritti nel momento in cui cessa la funzione dei geni embrionali; a cominciare da poco prima della nascita, per diversi mesi si ha un passaggio graduale e regolato dalla produzione γ a quella β, in maniera che la somma dei due tipi di catene sia costante. Il 97% dell’emoglobina totale nell’uomo adulto è costituito da 2 catene α e da 2 catene β (HbA), mentre la restante emoglobina (HbA2) contiene 2 catene α e 2 catene δ. Le famiglie geniche delle g. costituiscono un sistema interessante per lo studio del controllo epigenetico dell’espressione dei geni (➔ epigenesi).
Nello studio dei processi di regolazione dei geni globinici si è scoperto che ciascun gene presenta elementi regolatori individuali, e che l’intero gruppo è soggetto a un controllo ‘acceso-spento’ che comporta cambiamenti globali nella struttura della cromatina. In alcuni individui affetti da una forma di talassemia, nella quale i geni della famiglia β sono silenti, è presente una delezione di una sequenza di DNA di alcune migliaia di basi a monte del gene per la g. (fig. 2). Tale regione, chiamata LCR (locus control region), è coinvolta nella modulazione dello stato di rilassamento e condensazione della cromatina. Si ipotizza che questo locus del DNA offra siti di riconoscimento alle proteine che promuovono la generale apertura dell’intera regione, rendendo possibile l’accesso alla RNA-polimerasi e ai fattori di trascrizione gene-specifici. La LCR influenza la trascrizione non solo del gene della globina β ma anche degli altri geni globinici della regione. Nella LCR è presente un tipo di cromatina a struttura particolare, eccezionalmente sensibile alla DNasi, enzima che è in grado di tagliare il DNA soprattutto nei punti più accessibili, quando la conformazione è più aperta. È stato osservato che regioni geniche attive mostrano siti ipersensibili alla DNasi (DHS, DNA hypersensitive sites). Per es., negli individui normali, dopo la nascita, spariscono i DHS davanti all’emoglobina ε e γ, entrambe non trascritte nell’adulto. Si pensa pertanto che i DHS siano gli elementi attivi della regione di controllo del locus nei quali si verifica l’allentamento dello stato condensato della cromatina e l’attivazione della trascrizione attraverso un’azione sui promotori dei singoli geni.