Anticorpi e meccanismi genetici della diversita anticorpale
Anticorpi e meccanismi genetici della diversità anticorpale
Gli anticorpi o immunoglobuline sono glicoproteine che riconoscono perlopiù molecole estranee all'organismo espresse da virus, batteri e altri agenti infettivi. Gli anticorpi sono prodotti dai linfociti B, una sottopopolazione di globuli bianchi circolanti nel sangue e negli organi linfoidi (per es., milza e linfonodi). In ciascun individuo esiste un repertorio estremamente ampio di anticorpi diversi, per cui il sistema immunitario è in grado di riconoscere un'enorme varietà di strutture molecolari differenti, chiamate 'antigeni'. Il riconoscimento antigene-anticorpo è molto selettivo, infatti ciascun anticorpo crea un legame complementare con l'antigene corrispondente, e con pochi antigeni di struttura simile a questo, ma non interagisce con la maggior parte degli altri antigeni: per esempio, gli anticorpi contro il virus del morbillo non reagiscono contro quello della poliomielite. Gli anticorpi sono presenti sia in forma solubile nel sangue e in altri liquidi biologici (latte, lacrime, saliva, ecc.), sia sulla superficie dei linfociti B. Quando il siero umano viene sottoposto ad analisi mediante separazione elettroforetica, la gran parte degli anticorpi si colloca nella frazione delle gammaglobuline.
La funzione degli anticorpi è quella di legare gli antigeni e favorirne l'eliminazione. Sulla superficie del linfocita B, l'anticorpo agisce da recettore di membrana (anche chiamato BCR, B cell receptor) e il suo legame con l'antigene è necessario per l'attivazione, la proliferazione e il differenziamento del linfocita B, fino alla formazione della plasmacellula, cellula altamente specializzata che secerne elevate quantità di anticorpi solubili. Nel sangue e negli altri liquidi biologici, gli anticorpi catturano gli antigeni e innescano meccanismi immunomediati di eliminazione, per esempio la fagocitosi dell'antigene da parte di granulociti neutrofili e macrofagi e l'attivazione del complemento, un insieme di glicoproteine del siero che regolano la fagocitosi, la citotossicità, l'infiammazione.
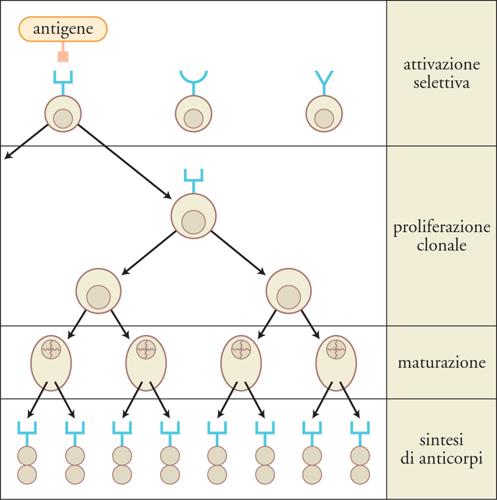
La generazione di un repertorio anticorpale estremamente eterogeneo (nell'ordine di miliardi di diversi anticorpi in ciascun individuo) è dovuta alla ricombinazione dei geni delle immunoglobuline, una modifica irreversibile del materiale genetico che si verifica nei linfociti B immaturi. Il meccanismo che genera la diversità degli anticorpi si basa sull'assortimento casuale di segmenti genici, nonché sull'inserzione di nuovi nucleotidi, per cui si forma un numero enorme di geni riarrangiati. L'estrema eterogeneità del repertorio anticorpale è preesistente all'esposizione all'antigene. Quando il sistema immunitario incontra l'antigene, quei linfociti B che lo riconoscono sono stimolati, proliferano e possono accumulare mutazioni nei geni delle immunoglobuline, modificando di conseguenza l'affinità per l'antigene degli anticorpi codificati. I linfociti B che producono anticorpi ad alta affinità per l'antigene sono selezionati nel corso della risposta immunitaria e si espandono a scapito degli altri linfociti. Nel loro insieme, questi meccanismi assicurano sia la possibilità di produrre anticorpi contro un'enorme varietà di antigeni diversi, sia l'elevata specificità e affinità della risposta anticorpale nei riguardi di un singolo antigene.
Sommario: 1. Molecola anticorpale e legame antigene-anticorpo. 2. Domini immunoglobulinici e superfamiglia delle immunoglobuline. 3. Regioni costanti, variabili, ipervariabili. 4. Classi e sottoclassi di immunoglobuline (Ig). 5. Recettori per Fc. 6. Isotipo, idiotipo, allotipo. 7. Principali funzioni degli anticorpi. 8. Informazione genetica ereditaria e diversità degli anticorpi. 9. Ricombinazione dei geni delle immunoglobuline nei linfociti B immaturi. 10. Diversità delle regioni variabili e cambio delle regioni costanti dopo l'incontro con l'antigene. 11. Immunodeficienze primarie da difetti della risposta anticorpale. □ Bibliografia.
Molecola anticorpale e legameantigene-anticorpo
Gli anticorpi sono glicoproteine formate da due catene pesanti identiche H (Heavy) con peso molecolare di circa 50 kDa e da due catene leggere identiche L (Light) con peso molecolare di circa 25 kDa, unite fra loro da ponti disolfuro. Si tratta di glicoproteine multimeriche, la cui struttura è stata oggetto di approfonditi studi che sono stati condotti con diversi metodi, incluso il frazionamento enzimatico e la cristallografia a raggi X. L'anticorpo intero ha la forma di una Y, con due bracci che si divaricano, ciascuno formato da una catena L e da metà di una catena H appaiate fra loro, e uno stelo, in cui si uniscono le restanti metà delle due catene H; bracci e stelo sono riuniti a livello della cosiddetta 'regione cerniera'; ciascuna estremità dei bracci contiene il sito di legame per l'antigene (fig. 2).
La regione dell'antigene che interagisce con l'anticorpo viene chiamata 'epitopo'. Una singola molecola di antigene può contenere molti epitopi, identici o diversi tra loro, e spesso sulla superficie di virus e batteri un singolo epitopo è presente in centinaia o migliaia di copie. Il legame antigene-anticorpo può coinvolgere entrambi i siti di legame, che interagiscono con due epitopi identici sullo stesso antigene, oppure su antigeni separati, formando così un ponte. D'altra parte, un singolo antigene che presenta più epitopi può essere legato contemporaneamente da numerosi anticorpi, soprattutto se non si tratta di un antigene isolato, ma di una struttura composta da più antigeni, come un batterio. L'interazione di antigeni e anticorpi porta alla formazione dei cosiddetti immunocomplessi.
Quando gli anticorpi sono trattati con l'enzima proteolitico papaina, si generano due frammenti identici, che sono stati denominati Fab (Fragment antigen binding), corrispondenti ai bracci della Y, e un frammento Fc (Frammento cristallizzabile, così chiamato in ragione del fatto che cristallizza facilmente), corrispondente allo stelo. Il taglio enzimatico della molecola anticorpale con la pepsina determina invece una frammentazione dello stelo in piccole subunità, mentre i due bracci rimangono ancora uniti dalla regione cerniera, formando il cosiddetto frammento F(ab′)2.
Domini immunoglobulinici e superfamiglia delle immunoglobuline
Gli anticorpi svolgono la loro funzione in ambienti biologici diversi, spesso nel corso di risposte infiammatorie, e possono essere quindi facilmente esposti a variazioni di pH, azione di proteasi, o altro. Tuttavia, gli anticorpi sono molecole molto stabili grazie alla loro struttura, che si basa sulla ripetizione di un'unità globulare compatta, ripiegata su sé stessa, lunga circa 110 amminoacidi, chiamata 'dominio immunoglobulinico'. Ogni catena H contiene quattro o cinque domini immunoglobulinici, mentre la catena L ne ha due. I domini immunoglobulinici sono omologhi per sequenza lineare amminoacidica, o struttura primaria. In particolare, l'omologia è maggiore nel caso dei domini costanti (C) e minore per i domini variabili (V); questi ultimi corrispondono alla regione dell'anticorpo che interagisce con l'antigene. La struttura secondaria dei domini immunoglobulinici è costituita da due foglietti β, che si formano dal ripiegamento della catena lineare in segmenti giustapposti. Infine un ponte disolfuro tiene insieme i due foglietti β, in maniera tale che si formi la struttura terziaria compatta caratteristica del dominio immunoglobulinico. Gli anticorpi hanno poi una struttura di ordine superiore, la struttura quaternaria, che è data dall'unione delle due catene H e le due catene L in un'unica molecola multimerica, stabilizzata dalle interazioni non covalenti tra i foglietti β di domini immunoglobulinici appartenenti a catene diverse.
Il dominio immunoglobulinico è presente in molte molecole del sistema immunitario, quali il TCR (cell receptor, recettore per l'antigene dei linfociti T) e le molecole del complesso maggiore di istocompatibilità MHC (Major histocompatibility complex), in molecole di adesione, quali ICAM-1 (Intercellular adhesion molecule-1) e VCAM-1 (Vascular adhesion molecule -1), e in molte altre proteine, spesso coinvolte nell'interazione cellula-cellula. Si parla quindi di 'superfamiglia delle immunoglobuline', per indicare l'insieme delle proteine che contengono almeno un dominio immunoglobulinico. Si ritiene che nel corso dell'evoluzione tali proteine si siano differenziate a partire da un unico gene ancestrale, comparso precocemente, codificante per una proteina di 100-110 amminoacidi di lunghezza e con la tipica struttura globulare formata dall'interazione di due foglietti β contrapposti.
Regioni costanti, variabili, ipervariabili
Ogni catena H e L degli anticorpi presenta le cosiddette 'regioni variabili' e 'regioni costanti'. Le regioni che interagiscono con l'antigene sono definite variabili, o V, in quanto la loro sequenza amminoacidica è diversa tra un anticorpo e un altro. Ciascuno dei due bracci dell'anticorpo termina con le regioni variabili VH e VL, appartenenti rispettivamente alla catena H e a quella L e formate ognuna da un dominio immunoglobulinico. Entrambe le regioni V, e in particolare quei tratti che vengono chiamati CDR (Complementarity determining regions), contribuiscono a formare il sito di legame per l'antigene. Ogni regione V contiene tre diversi CDR non consecutivi tra loro nella sequenza amminoacidica lineare, CDR1, CDR2 e CDR3; quando il dominio immunoglobulinico è ripiegato nella sua conformazione nativa, le regioni CDR sporgono come anse dai segmenti ripiegati nel foglietto β e vengono a trovarsi vicine tra loro. Nella struttura tridimensionale dell'anticorpo, le regioni CDR dei domini VH e VL sono contigue e formano nel loro insieme la superficie di interazione specifica con l'antigene. Nelle regioni CDR si concentra la maggiore variabilità tra le sequenze amminoacidiche di anticorpi diversi; infatti tali regioni sono anche chiamate 'ipervariabili' o HV. La restante parte della regione V costituisce un'intelaiatura, framework, che mantiene la struttura del dominio immunoglobulinico ed è formata da quattro regioni FR1, FR2, FR3, FR4.
Le regioni costanti dell'anticorpo sono quelle che non interagiscono direttamente con l'antigene e sono costituite dai domini immunoglobulinici costanti e dalla regione cerniera, appartenente alla catena H. La catena L contiene un dominio immunoglobulinico costante, CL, localizzato all'estremità carbossiterminale, mentre la catena H ne contiene tre o quattro, chiamati CH1, CH2, CH3 e CH4. Le regioni costanti sono responsabili dell'interazione dell'anticorpo con altre componenti del sistema immunitario, per esempio recettori per il frammento Fc e molecole del complemento. In corrispondenza dello stelo della Y, gli anticorpi solubili hanno un'estremità idrofilica, mentre quelli di membrana hanno una regione idrofobica, che si inserisce nello spessore della membrana plasmatica del linfocita B.
Classi e sottoclassi di immunoglobuline (Ig)
Sono state identificate cinque classi diverse di anticorpi, che differiscono fra loro per la struttura delle regioni costanti delle catene H e per la funzione effettrice: IgG, IgM, IgA, IgD, IgE; ciascuna ha la sua specifica classe di catene H, rispettivamente γ, μ, α, δ, ε. Le principali differenze strutturali tra le catene H di classe diversa risiedono nella regione costante, in particolare nella lunghezza della regione cerniera, nel numero e nella lunghezza delle regioni C, nella posizione dei ponti disolfuro, nel numero e nella disposizione delle unità carboidratiche. All'interno della classe delle IgG e di quella delle IgA esistono alcune sottoclassi, caratterizzate da differenze minori tra loro rispetto a quelle esistenti fra le cinque classi. Le IgM e le IgA possono esistere in forma multimerica, cioè in pentameri (IgM) e dimeri (IgA) della classica molecola anticorpale (IgG) a forma di Y. Corrispondentemente, il numero di siti di legame per l'antigene per molecola è dieci nel caso delle IgM e quattro nel caso delle IgA. Ognuna delle cinque classi di Ig può avere catene L di tipo κ oppure λ, che si differenziano tra loro per la regione costante. La diversa struttura delle cinque classi di Ig si riflette nelle rispettive costanti di sedimentazione: le IgG, le IgD e le IgA monomeriche hanno una costante di sedimentazione 7S, le IgA dimeriche 11S, le IgM pentameriche 19S; infine le IgE hanno una costante di sedimentazione 8S, avendo una catena H di maggiore lunghezza amminoacidica rispetto alle altre Ig monomeriche.
Un singolo linfocita B può produrre, in fasi diverse del suo differenziamento, anticorpi di classe diversa, che hanno tutti la stessa specificità antigenica, cioè riconoscono lo stesso antigene. Questo avviene perché ogni linfocita B maturo esprime una sola catena L e una sola regione VH.
IgG. Le IgG sono gli anticorpi più abbondanti nel sangue, avendo una concentrazione di circa 13,5 mg/ml nel siero umano e costituendo circa l'80% degli anticorpi sierici. Nell'uomo, si distinguono quattro sottoclassi di IgG: IgG1, IgG2, IgG3, IgG4, che sono omologhe tra loro per il 90÷95%. Le funzioni delle IgG sono di attivare il complemento e di interagire con il recettore per Fc dei fagociti (le IgG3 e le IgG1 sono le più efficaci a svolgere entrambe queste funzioni), di proteggere il feto durante la gravidanza e il neonato (tutte e quattro le sottoclassi sono in grado di passare dal sangue materno a quello fetale attraverso la placenta). Le IgG hanno grosso modo un'emivita nel sangue di 20 giorni, tranne le IgG3, la cui emivita è di circa una settimana.
IgM. Le IgM sono anticorpi presenti in forma di monomeri sulla superficie dei linfociti B e in forma di pentameri nel siero, a una concentrazione di circa 1,5 mg/ml. Le IgM pentameriche contengono un polipeptide J (Joining) che lega le regioni Fc e favorisce la polimerizzazione dei monomeri in pentameri poco prima della loro secrezione da parte delle plasmacellule. A causa della presenza di dieci siti di interazione per l'antigene, le IgM sono gli anticorpi più efficienti nel legare le particelle batteriche e virali, che espongono sulla loro superficie copie multiple dello stesso epitopo; inoltre, le IgM hanno un'elevata capacità di attivare il complemento.
IgA. Le IgA sono gli anticorpi più abbondanti nelle secrezioni, come latte, lacrime, saliva, muco. Esistono in forma di monomero, dimero, e più raramente tetramero. Le IgA multimeriche contengono come le IgM il polipeptide J, e le IgA presenti nelle secrezioni contengono anche un polipeptide S, o componente secretoria. Le IgA sono rilasciate da plasmacellule localizzate a livello delle mucose, per esempio lungo il tubo digerente o nei bronchi. Le cellule di rivestimento degli epiteli legano le IgA mediante un recettore specializzato localizzato lungo la loro membrana basolaterale. In seguito al legame, il recettore viene internalizzato per endocitosi insieme all'anticorpo ed entrambi sono trasportati sul lato apicale della cellula, quello che guarda il lume della cavità mucosale. Qui le IgA sono liberate, e a esse rimane associato un frammento del recettore che le ha trasportate all'interno della cellula; tale frammento è il polipeptide S, che rimane legato alla catena J. Poiché le superfici mucose sono estremamente estese e le IgA rappresentano la principale classe di anticorpi in questa sede, ogni giorno si produce un quantitativo di IgA maggiore di quello di qualsiasi altra classe di anticorpi. La funzione delle IgA secretorie è quella di favorire l'eliminazione degli agenti patogeni a livello delle mucose, prima che possano formare colonie e penetrare negli epiteli. La presenza delle IgA nel latte materno è molto importante per le difese immunitarie del neonato nei primi mesi di vita.
IgD. Le IgD sono anticorpi monomerici che si trovano sulla superficie dei linfociti B, e in concentrazioni basse nel sangue, corrispondenti a circa 0,03 mg/ml. La loro funzione principale è quella di recettore di membrana per l'antigene, mentre non si conosce una funzione effettrice per le IgD solubili.
IgE. Le IgE sono presenti nel sangue a concentrazione bassissima, almeno 100 volte inferiore a quella delle IgD. Le IgE sono monomeri, la cui funzione effettrice è utile per la difesa dalle infezioni parassitarie. Le IgE tramite il loro Fc si legano al recettore ad alta affinità sulla superficie dei granulociti basofili e dei mastociti e quando legano l'antigene possono mediare l'attivazione di queste cellule, determinando il rilascio di mediatori dell'infiammazione e il richiamo di altri leucociti. Le IgE sono coinvolte in risposte immunitarie di tipo allergico, come lo shock anafilattico, l'asma e la rinite allergica.
Memoria della risposta anticorpale
Nel corso di una tipica risposta immunitaria primaria, cioè il primo incontro con l'antigene, sono prodotti inizialmente anticorpi specifici di tipo IgM, che compaiono nel sangue dopo 5-10 giorni dall'immunizzazione, seguiti dalle IgG e dagli anticorpi delle altre classi. Nella risposta secondaria o della memoria, cioè il successivo incontro con lo stesso antigene, la risposta è più rapida ed efficiente, infatti gli anticorpi specifici aumentano nel sangue già dopo 1-3 giorni, raggiungono una concentrazione più alta e hanno un'affinità media più elevata per l'antigene. Inoltre prevalgono subito le IgG e le Ig di classi diverse dalle IgM, in particolare le classi di anticorpi prevalenti nella risposta secondaria sono quelle che hanno dominato nella parte terminale della risposta primaria. Nell'insieme, questi cambiamenti rendono più efficace la protezione dalla malattia al secondo incontro con lo stesso agente infettivo, poiché non soltanto la quantità (concentrazione nel sangue e nei tessuti) e la qualità (affinità per l'antigene) degli anticorpi sono aumentate, ma anche la risposta effettrice (classe di anticorpi) è più adatta a difendere l'ospite da quello specifico agente patogeno. Il sistema immunitario dell'uomo e degli altri Vertebrati può mantenere la memoria immunitaria antigene-specifica a lungo; nel corso del tempo, ciascun individuo incontra antigeni diversi e sviluppa un proprio corredo di risposte della memoria.
Recettori per Fc
Molti dei recettori per Fc appartengono alla superfamiglia delle Ig, mentre il recettore per le IgE di tipo II presenta omologia con le lectine di tipo C. La funzione dei recettori per Fc è quella di mediare alcune fra le funzioni effettrici più importanti degli anticorpi, quali la fagocitosi degli antigeni rivestiti da anticorpi e l'attivazione di cellule con attività citotossica. Inoltre alcuni recettori per Fc mediano il trasporto delle Ig, per esempio il recettore per Fc neonatale è responsabile del trasporto degli anticorpi presenti nel latte materno attraverso l'epitelio della mucosa intestinale del neonato.
Recettori per Fc delle IgG o FcγR. Sono stati finora identificati nell'uomo tre tipi di FcγR, che differiscono per la distribuzione cellulare e la funzione. Ciascuna sottoclasse di IgG ha un'affinità differente per i tre tipi di FcγR, e di conseguenza uno spettro diverso di funzioni effettrici: (a) tipo I o FcγRI, espresso da fagociti mononucleati, media la fagocitosi degli immunocomplessi; (b) tipo II o FcγRII, espresso da una più ampia varietà di cellule; quando legano le IgG mediante il sottotipo B di questo recettore, i linfociti B ricevono un segnale inibitorio, che controlla l'attivazione di queste cellule in presenza di elevate concentrazioni di anticorpo; (c) tipo III o FcγRIII, espresso da fagociti mononucleati, granulociti neutrofili, linfociti NK (Natural killer). Il legame delle IgG a questo recettore induce attivazione di risposte cellulari effettrici, per esempio stimola l'attività citotossica dei linfociti NK. Nel topo è stato di recente identificato un nuovo recettore per le IgG, che è stato chiamato 'tipo IV' o FcγRIV, e che lega selettivamente le IgG2, con affinità intermedia.
Recettori per Fc delle IgE o FcεR. Sono stati identificati nell'uomo due tipi di recettori per Fc delle IgE, che sono espressi da tipi cellulari diversi: (a) tipo I o FcεRI, ad altissima affinità per le IgE, si trova sulla superficie di granulociti basofili, eosinofili e mastociti; (b) tipo II o FcεRII, a bassa affinità per le IgE, è espresso da linfociti e fagociti mononucleati. In membrana, questo recettore può essere sottoposto a taglio proteolitico, con il conseguente distacco di frammenti solubili capaci di legare le IgE.
Isotipo, idiotipo, allotipo
Gli anticorpi di un individuo sono estremamente eterogenei e mostrano almeno due livelli di diversità, l'isotipo e l'idiotipo. Inoltre, anticorpi provenienti da individui diversi della stessa specie possono essere differenti anche per allotipo.
Isotipo. Gli isotipi sono i tipi di catena H presenti nelle diverse classi di anticorpi. Sono definiti isotipi anche i due tipi diversi di catena L. Gli anticorpi di individui della stessa specie hanno un numero ristretto di isotipi in comune (nell'uomo cinque isotipi per le catene H, due per le catene L).
Idiotipo. In ogni individuo esiste un repertorio ampio di anticorpi di specificità antigenica diversa. Tali anticorpi sono diversi a livello delle regioni VH e VL e all'interno di queste soprattutto nelle regioni HV. Le regioni VH e VL hanno una sequenza amminoacidica e una struttura tridimensionale unica per ciascun anticorpo e costituiscono il prodotto di un singolo clone di linfociti B. La struttura tridimensionale formata dall'accoppiamento di VH e VL può funzionare da antigene ed essere riconosciuta da anticorpi complementari che la legano in maniera specifica, riconoscendo epitopi definiti 'idiotopi'. Gli idiotopi possono essere 'privati', se sono propri di un singolo anticorpo e di solito corrispondono alle regioni HV, oppure 'pubblici', se sono condivisi da alcuni anticorpi e corrispondono a zone di omologia nelle regioni V. L'insieme degli idiotopi di un singolo anticorpo è definito 'idiotipo'.
Allotipo. Le catene H e L degli anticorpi sono il prodotto di geni presenti con diverse varianti alleliche in una popolazione di individui. I prodotti di geni polimorfi delle immunoglobuline sono chiamati 'allotipi'.
7. Principali funzioni degli anticorpi
Anticorpi di membrana
Gli anticorpi espressi sulla membrana dei linfociti B funzionano da recettori cellulari per l'antigene. L'estremità carbossiterminale delle catene H termina con un dominio transmembrana e una piccola coda intracellulare, cui si associano non covalentemente molecole coinvolte nella trasmissione all'interno della cellula del segnale generato dal legame dell'antigene. Quando due o più anticorpi di membrana interagiscono con l'antigene, si genera un segnale di attivazione nei linfociti B. Tale evento, insieme a segnali accessori forniti dai linfociti T CD4 helper, induce la proliferazione e il differenziamento dei linfociti B. Questo meccanismo di attivazione selettiva dei linfociti B che hanno incontrato l'antigene è essenziale per l'induzione della risposta anticorpale specifica, anche detta 'risposta umorale'. Dal differenziamento terminale dei linfociti B attivati dall'antigene si originano le plasmacellule, che secernono anticorpi solubili contenenti le stesse regioni V dell'anticorpo espresso in membrana dal linfocita B precursore.
Anticorpi solubili
Le immunoglobuline secrete nel siero e nei liquidi biologici dalle plasmacellule hanno la funzione di legare una molteplicità di antigeni grazie alla diversità delle regioni variabili e di attivare un numero limitato di funzioni effettrici, mediante pochi tipi di regioni costanti. Gli anticorpi possono legare antigeni solubili, per esempio tossine, e neutralizzarle, ossia impedire che svolgano la loro funzione di danno all'ospite. Le IgG (soprattutto le IgG1 e le IgG3) e le IgM hanno la capacità di attivare il complemento, un insieme di fattori che si attivano a cascata a partire dalla formazione di immunocomplessi. Se gli antigeni sono componenti della superficie di un microrganismo patogeno e gli anticorpi li rivestono, l'attivazione del complemento determina la formazione di pori nella membrana, con conseguente lisi del microrganismo.
In ogni caso, l'attivazione del complemento libera una serie di mediatori dell'infiammazione, determinando il richiamo di leucociti e l'attivazione di funzioni cellulari che facilitano l'eliminazione dell'antigene, come la fagocitosi. Le IgG (nell'uomo soprattutto le IgG1 e le IgG3) hanno anche la capacità di 'opsonizzare' gli antigeni, ossia di renderli un pasto più appetitoso per i fagociti. Questo perché gli antigeni rivestiti da anticorpi sono riconosciuti dai recettori per Fc delle IgG di tipo I espressi dai fagociti mononucleati e dai granulociti neutrofili, e tale interazione attiva il processo di fagocitosi. Le cellule rivestite da anticorpi possono essere bersaglio della citotossicità anticorpo-dipendente mediata da cellule, o ADCC (Antibody-dependent cell-mediated cytotoxicity), una funzione svolta dai linfociti NK e mediata dall'attivazione di queste cellule attraverso il recettore per Fc delle IgG di tipo III. Anche i granulociti eosinofili possono svolgere attività ADCC, in particolare il loro bersaglio sono elementi rivestiti da IgE e riconosciuti mediante il recettore per Fc delle IgE di tipo I.
Informazione genetica ereditaria e diversità degli anticorpi
Il sistema immunitario è in grado di produrre elevate quantità di anticorpi contro una varietà di antigeni diversi. Questo si verifica non solo quando gli antigeni provengono da microrganismi patogeni, ma anche nel caso di antigeni sintetizzati in laboratorio. Addirittura, si riesce a ottenere la produzione di anticorpi altamente specifici nei confronti di molecole che non esistono in natura. Come sia possibile che l'informazione genetica per un così elevato numero di anticorpi sia conservata nel genoma umano (e in quello degli altri Vertebrati che hanno un repertorio diversificato di recettori per l'antigene) è stato un mistero irrisolto per molto tempo. La soluzione è stata ipotizzata da W.J. Dreyer e J.C. Bennett nel 1965, i quali hanno suggerito che il sito di legame per l'antigene fosse codificato da segmenti genici separati da quello codificante per la regione costante dell'anticorpo, e che l'enorme repertorio anticorpale fosse dovuto alla diversità dei segmenti genici delle sole regioni variabili.
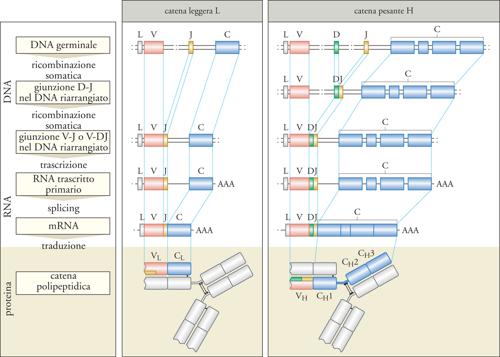
Tale ipotesi è stata verificata sperimentalmente nel 1976 da Susumu Tonegawa, che per questa scoperta ha ricevuto il Premio Nobel per la medicina o la fisiologia nel 1987. Mediante la tecnica Southern Blot, Tonegawa ha scoperto che geni codificanti per regioni V e C localizzati su frammenti separati di DNA in cellule non linfoidi si trovano invece vicini in un clone di linfociti B. Ciò significa che nei linfociti B si verifica un processo di riarrangiamento del DNA che determina l'avvicinamento di segmenti genici che sono distanti in tutte le altre cellule. In ogni linfocita B, la ricombinazione dei geni della catena L avvicina due segmenti genici, J e V, scelti in maniera casuale tra una moltitudine di segmenti genici codificanti per le regioni V. I segmenti genici V e J avvicinati dalla ricombinazione formano un gene composto insieme al segmento genico codificante per la regione C. Un processo analogo si verifica per la catena H, in cui sono presenti anche i segmenti genici D (fig. 3). Questo meccanismo rende ciascun clone linfocitario geneticamente diverso da ogni altra cellula dello stesso individuo (ricombinazione somatica) e modifica irreversibilmente il genoma dei linfociti B. Un simile processo di ricombinazione avviene nei linfociti T, che riarrangiano in maniera analoga il DNA delle catene del loro recettore per l'antigene.
9. Ricombinazione dei geni delle immunoglobuline nei linfociti B immaturi
I geni riarrangiati delle catene L sono formati da un segmento genico V e uno J, che codificano per la regione V, e un segmento genico C, corrispondente alla regione C della proteina. Per le catene λ esistono nell'uomo circa 30 segmenti funzionali V e 4 J, per le catene κ 40 V e 5 J. I geni riarrangiati delle catene H contengono segmenti genici V, J e anche D (Diversity), che insieme codificano per la regione V. Nel locus genico umano delle catene H si trovano circa 65 segmenti genici funzionali V, 27 D e 6 J. Il numero totale dei segmenti genici presenti nei loci genici delle catene H e di quelle L è più elevato del numero dei segmenti funzionali, poiché molti segmenti sono pseudogeni. Non è stato ancora chiarito come avvenga il riarrangiamento dei geni delle immunoglobuline, ma è importante la presenza di sequenze fiancheggianti i segmenti genici coinvolti nella ricombinazione, chiamate RSS (Recombination signal sequences). Si tratta di eptameri e nonameri, separati da sequenze spaziatrici non conservate, riconosciuti dall'apparato di enzimi di ricombinazione, e in particolare dai prodotti dei geni RAG-1 e RAG-2 (Recombination activating genes). La ricombinazione avviene con taglio del DNA e ricongiunzione dei segmenti genici, con delezione della regione di DNA interposta, o mediante inversione nel caso di orientamento trascrizionale opposto dei segmenti genici. La giunzione fra segmenti genici può avvenire in maniera imprecisa, per esempio nucleotidi appartenenti a introni possono essere inclusi nella sequenza codificante. Inoltre, nei punti di giunzione tra segmenti genici diversi possono essere aggiunti nucleotidi P (Palindrome), se sono complementari a una sequenza palindromica che si genera all'estremità di uno dei due filamenti di DNA durante la ricombinazione, o N (Non-germline), se sono inseriti in maniera casuale dalla transferasi desossinucleotidica terminale. I punti di giunzione tra segmenti genici presentano la più alta variabilità di sequenza e codificano per le regioni CDR3, situate nel sito di legame per l'antigene.
I geni delle immunoglobuline sono localizzati nell'uomo sui cromosomi 14 (catene H), 2 (catene κ), 22 (catene λ). Nel corso dello sviluppo dei linfociti B nel midollo osseo, la ricombinazione inizia nel locus genico κ; successivamente se nessuno dei due cromosomi 2 riarrangia in maniera produttiva, si ha la ricombinazione al locus genico λ. Il riarrangiamento al locus genico H avviene in maniera tale che nelle cellule mature sia prodotta un'unica regione V, che si può associare a segmenti genici per le regioni costanti di ognuna delle cinque classi. Nei linfociti B maturi è prodotto un solo tipo di catena L (esclusione isotipica); per ciascuna catena immunoglobulinica, uno solo dei due alleli è attivo nella trascrizione (esclusione allelica). Quindi, ogni clone di linfociti B periferici esprime una sola regione VL e una sola regione VH, che determinano la sua specificità antigenica. Poiché il riarrangiamento avviene in modo casuale e diverso in ogni cellula, l'insieme dei linfociti B circolanti produce un repertorio estremamente ampio di anticorpi e ha la potenzialità di riconoscere una moltitudine di antigeni differenti.
Il numero di diverse catene H è uguale al prodotto tra il numero dei corrispondenti segmenti V, D, J (65×27×6), pari a 10.530 combinazioni, e analogamente il numero di diverse catene L è almeno 200(40×5) per le catene κ e 120(30×4) per quelle λ. Il numero di combinazioni possibili è notevolmente aumentato dalla diversità generata dall'imprecisione giunzionale e dall'aggiunta di nucleotidi N e P. Inoltre, il sito di legame per l'antigene è formato dall'accoppiamento casuale di catene H e catene L. Quindi, il numero teorico di anticorpi diversi che si possono generare è elevatissimo; nell'uomo il repertorio anticorpale è costituito da più di 100 miliardi di combinazioni differenti. Il numero effettivo di anticorpi presenti in un individuo è inferiore a quello teorico, considerando che non tutte le sequenze nucleotidiche possibili sono compatibili con la trascrizione e traduzione completa delle catene polipeptidiche (nella ricombinazione si possono generare segnali di stop) e non tutte le combinazioni di catene H e L si appaiano correttamente. Inoltre, i linfociti B che producono anticorpi in grado di reagire contro antigeni dell'individuo (self) sono eliminati nel corso dello sviluppo linfocitario e non contribuiscono al repertorio dei linfociti B periferici.
Diversità delle regioni variabili e cambio delle regioni costanti dopo l'incontro con l'antigene
Quando un antigene incontra le cellule del sistema immunitario, vengono attivati solo quei linfociti B che esprimono un anticorpo in grado di legarlo e in presenza di segnali accessori essi proliferano e differenziano. Si tratta solitamente di una risposta che coinvolge un numero limitato ma eterogeneo di cloni cellulari, che producono anticorpi diretti verso uno o più epitopi dell'antigene. Nel corso del processo di differenziamento antigene-dipendente, i geni per le immunoglobuline dei linfociti B attivati vanno incontro a mutazioni puntiformi con una frequenza almeno 100 volte superiore a quella delle mutazioni spontanee degli altri geni (ipermutazione somatica). Le mutazioni geniche degli anticorpi si concentrano nelle sequenze codificanti le regioni CDR, e possono determinare una modifica dell'affinità di legame antigene-anticorpo, ossia un aumento o una diminuzione. Per un processo di selezione guidato dall'antigene, le mutazioni che incrementano l'affinità dell'anticorpo conferiscono un vantaggio ai linfociti B portatori della mutazione e ne incrementano le capacità di sopravvivenza, proliferazione e differenziamento. Questo determina nel tempo un aumento progressivo dell'affinità per l'antigene degli anticorpi circolanti (maturazione dell'affinità). I cloni linfocitari che producono anticorpi a elevata affinità per l'antigene a distanza di tempo dall'immunizzazione sono solitamente un gruppo ristretto, selezionato da quello più ampio ed eterogeneo dei cloni inizialmente reclutati nella risposta; inoltre si tratta di cloni che hanno accumulato mutazioni dopo l'incontro con l'antigene. In contrasto con questa tipica risposta oligoclonale, attualmente è possibile ottenere una grande quantità di anticorpi prodotti da un singolo clone linfocitario (anticorpi monoclonali), grazie a una metodologia messa a punto nel 1974 da Georges J.F. Köhler e César Milstein, cui è stato assegnato il Premio Nobel per la medicina o la fisiologia nel 1984. Gli anticorpi monoclonali più comunemente in uso sono prodotti da linfociti B di topo e trovano tantissime applicazioni nella ricerca, nella diagnostica, nella terapia (in quest'ultimo caso si tratta per lo più di anticorpi 'umanizzati', cioè modificati in modo da renderli più simili ad anticorpi umani).
Nel corso del differenziamento dei linfociti B dopo l'incontro con l'antigene, l'isotipo H dell'anticorpo prodotto è finemente regolato. I linfociti B circolanti che non hanno mai incontrato l'antigene (cellule vergini) producono IgM e IgD, che sono espressi in superficie come recettori di membrana. L'espressione contemporanea di due isotipi è dovuta alla formazione di due RNA maturi diversi, utilizzati come stampo rispettivamente per la catena μ e per quella δ. Durante la risposta immunitaria, i linfociti B stimolati dall'antigene (cellule della memoria) possono esprimere anticorpi di altre classi, ossia IgG, IgA, IgE, senza cambiare la regione VH. Inoltre, quando il linfocita B differenzia in plasmacellula, gli anticorpi sono prodotti come proteine di secrezione. Il cambio di isotipo (switch) è regolato a livello del DNA mediante un processo di ricombinazione che interessa i geni per le regioni C. Il cambio di isotipo è fortemente influenzato da segnali accessori prodotti dai linfociti T CD4 helper che agiscono sul linfocita B nel processo di differenziamento antigene-dipendente. Nella maggior parte dei casi, vengono prodotti anticorpi di tipo IgG; la stimolazione antigenica in presenza di TGF-β (Transforming growth factor-β) può spingere verso la produzione di anticorpi IgA, mentre quella in presenza di interleuchina-4 può aumentare la produzione di anticorpi IgE. Il tipo di agente infettivo, il sito di ingresso dell'agente patogeno, le cellule che partecipano alla risposta immunitaria sono tutti fattori che influenzano il cambio di isotipo mediante una modifica delle citochine presenti nell'ambiente. In questo modo, gli anticorpi prodotti sono di solito adatti a fornire una risposta effettrice efficace nel contesto in cui devono funzionare.
Immunodeficienze primarie da difetti della risposta anticorpale
Le immunodeficienze primarie sono malattie ereditarie dovute all'alterazione di geni della risposta immunitaria. A seconda della gravità del difetto, le immunodeficienze primarie possono essere clinicamente silenti, manifestarsi con episodi ripetuti di infezioni, o essere incompatibili con la vita. Negli ultimi anni, si è registrato un notevole progresso nella definizione dei difetti molecolari responsabili di molte immunodeficienze primarie, con importanti ricadute sulle prospettive di diagnosi e terapia per queste malattie. Difetti ereditari della risposta anticorpale possono essere dovuti all'alterazione di geni espressi dai linfociti B, oppure di geni espressi da altre cellule che regolano l'attivazione dei linfociti B, principalmente i linfociti T CD4 helper. Fra i geni dei linfociti B la cui mutazione è causa di immunodeficienza, un gruppo essenziale è quello che controlla la diversità dei geni delle immunoglobuline prima e dopo l'incontro con l'antigene. Questo gruppo comprende per lo più geni che codificano enzimi coinvolti nella riparazione e nel danno del DNA. Il difetto funzionale o l'assenza dei prodotti dei geni RAG-1 e RAG-2 è causa di una forma severa di immunodeficienza primaria, in quanto sia i geni delle Ig sia quelli del recettore per l'antigene dei linfociti T non possono essere riarrangiati, per cui non si sviluppano linfociti T e B maturi. Si tratta di una patologia rara, che rientra nel gruppo delle malattie definite SCID (Severe combined immunodeficiency).
Immunodeficienze meno severe sono causate dall'alterazione di geni codificanti enzimi coinvolti nell'ipermutazione somatica e nel cambio di classe delle Ig: poiché questi eventi genetici avvengono dopo la stimolazione antigenica, la risposta anticorpale si può sviluppare fino alla formazione di IgM antigene-specifiche, ma sono deficitarie le altre classi di anticorpi e non si verifica la maturazione dell'affinità. Queste patologie rientrano nel gruppo di malattie definite HIGM (Hyper IgM syndromes). Nella HIGM2 l'immunodeficienza è dovuta a un difetto del gene codificante l'enzima AID (Activation-induced cytidine deaminase). Tale enzima è indispensabile sia per l'ipermutazione somatica sia per il cambio di classe delle Ig, ma non è noto quale sia il suo meccanismo d'azione; poiché AID mostra omologia con enzimi che processano l'RNA, è stato ipotizzato che entrambi i processi di modifica del DNA in cui AID è coinvolto richiedano la formazione di un RNA intermedio. Anche difetti del gene codificante l'enzima UNG (Uracyl-DNA-glycosylase) portano a una malattia di tipo HIGM con alterazioni sia del cambio di isotipo delle Ig sia dell'ipermutazione somatica; è stato proposto che per tali eventi genetici sia necessaria la rottura del doppio filamento di DNA, e che gli enzimi AID e UNG siano entrambi coinvolti in questo processso. Infine, nella HIGM4 il difetto genetico coinvolge uno o più fattori ancora non identificati che agiscono a valle di AID e sono necessari per il cambio di classe delle Ig ma non per l'ipermutazione somatica.
La caratterizzazione a livello molecolare delle alterazioni genetiche che causano deficit della risposta anticorpale aiuta a definire nel dettaglio i meccanismi che generano la diversità anticorpale e apre nuove prospettive per la cura delle immunodeficienze causate da tali alterazioni. Un approccio innovativo è la terapia genica, che propone di sostituire il gene assente con il corrispondente gene funzionale. Se da una parte la terapia genica è potenzialmente in grado di ripristinare completamente la funzione deficitaria, dall'altra, con i metodi attualmente disponibili, essa è associata a un elevato rischio di insorgenza di leucemie; questo approccio è quindi da valutare con estrema cautela.
Bibliografia
Janeway 2005: Immunobiology: the immune system in health and disease, 6. ed., edited by Charles A. Janeway jr e altri, New York, Garland Science, 2005.
William 2003: Fundamental immunology, 5. ed., edited by Paul E. William, Philadelphia, Lippincott Williams & Wilkins, 2003.