conformazionale, analisi
In chimica, studio di tutte le varie disposizioni nello spazio che gli atomi di una molecola possono assumere in relazione ai vincoli geometrici e al contenuto energetico della molecola stessa. Infatti alle conformazioni più stabili corrispondono i contenuti energetici minimi.
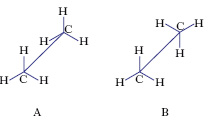
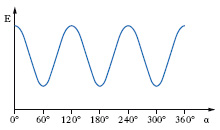
Le conformazioni di una molecola dipendono dalle diverse disposizioni nello spazio degli atomi che la costituiscono, che differiscono fra loro solo per rotazione degli atomi attorno a legami semplici per cui due e più c. possono trasformarsi l’una nell’altra senza rottura di legami. Si dicono isomeri conformazionali (o conformeri) due molecole che per una data configurazione differiscono per una diversa disposizione degli atomi nello spazio dovuta solo a una loro rotazione attorno a legami semplici; così sono isomeri conformazionali dell’etano le strutture I e II, che si dicono rispettivamente eclissate e sfalsate (fig. 1), perché guardandole lungo l’asse C-C gli atomi d’idrogeno appaiono sovrapposti gli uni agli altri (in A) o ruotati di 60° (in B). Riportando in un grafico l’energia potenziale E della molecola dell’etano in funzione dell’angolo di rotazione α (fig. 2), i minimi d’energia si ottengono a 60°, 180°, 300° corrispondenti alle c. sfalsate che risultano quindi le più stabili.
Le barriere di potenziale che separano i minimi hanno all’incirca il valore di 12 kJ/mole. Tale barriera è facilmente superata dalle molecole, a temperatura ordinaria, grazie all’energia cinetica dovuta agli urti reciproci, cosicché si ha una rapida interconversione degli isomeri conformazionali che risultano non separabili. Nei composti saturi, ad anello, quale il cicloesano, si è trovato, in accordo a precedenti ipotesi, che la molecola non può avere una struttura planare ma esiste in due forme non planari, dette a sedia (più stabile) e a barca. L’analisi c. estesa a molecole complesse, a polimeri biologici, sintetici ecc. ha consentito di collegare certi aspetti della reattività chimica alla struttura spaziale, in particolare alla c. molecolare.