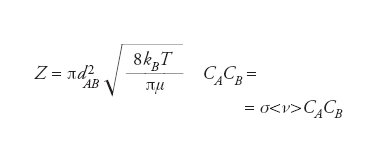urto tra particelle
urto tra particelle
La dinamica della collisione fra particelle influenza in modo fondamentale le principali proprietà chimico-fisiche di gas e liquidi, quali la diffusività, la conducibilità termica, la viscosità, i processi di eccitazione e di rilassamento energetico e la reattività. La frequenza di collisione fra due molecole A e B di diametro d e massa m aventi comportamento di gas ideale e funzione di distribuzione di velocità maxwelliana è uguale a
dove T è la temperatura, kB la costante di Boltzmann, dAB è la media geometrica dei diametri delle due particelle, μ=mAmB/(mA+mB) è la massa ridotta CA e CB le concentrazioni delle due molecole. Il primo e il secondo termine dell’equazione hanno un preciso significato fisico e corrispondono alla sezione d’urto intermolecolare σ e alla velocità media 〈ν>. Il numero di collisioni che avviene a pressione atmosferica in un gas a temperatura ambiente è estremamente elevato: in un metro cubo di aria ca. 1034 ogni secondo. Dividendo per la densità del gas, ciò vuol dire che ogni molecola collide con un’altra ca. un miliardo di volte ogni secondo e percorre un cammino libero medio λ prima di ogni collisione di ca. 1 millesimo di millimetro (micron). La velocità media di una molecola in condizioni standard (1 atmosfera e 25 °C) è di ca. 500 m/s. La frequenza di collisione di una molecola χ è proporzionale alla pressione P secondo la legge χ=σ〈ν>P/kBT. Le proprietà di trasporto sono funzione della frequenza di collisione e della velocità media. In particolare, il coefficiente di diffusione di una specie chimica in un gas, che è proporzionale alla velocità di trasporto di materia, è 1/3 〈ν>2/χ, la conducibilità termica, vale a dire il parametro che determina la capacità di trasferire energia, è uguale a 1/3 〈ν>2/χ moltiplicato per la capacità termica del gas e la sua densità, mentre la viscosità, che determina la capacità di trasporto del momento, è uguale a 1/3 〈ν>2/χ moltiplicato per la massa delle molecole e la loro densità.
→ Molecole