Tomografia
Tomografia
Tomografia a risonanza magnetica nucleare di Roberto Passariello, Bruno Beomonte Zobel, Massimo Gallucci, Carlo Masciocchi
SOMMARIO: 1. Generalità. 2. Formazione dell'immagine in RMN. 3. Sistema nervoso centrale (SNC). 4. Torace e addome: a) polmoni e cuore; b) addome. 5. Scavo pelvico. 6. Apparato muscolo-scheletrico. 7. Vantaggi e svantaggi della tomografia a risonanza magnetica. 8. Effetti biologici, pericoli e controindicazioni. □ Bibliografia.
1. Generalità
Nata come indagine strutturale in campo chimico e fisico nell'immediato dopoguerra (v. risonanza magnetica nucleare, suppl.), la risonanza magnetica nucleare (RMN) è stata inizialmente utilizzata in diagnostica medica nel 1971 da Damadian (v., 1971) e nel 1973 da Lauterbur (v., 1973). Il primo ha impiegato la RMN per la caratterizzazione tessutale dei tumori dapprima in vitro e poi in vivo, inizialmente su animali e in seguito sull'uomo. Il secondo ha aperto la strada teorica e tecnica all'ottenimento di immagini di sezioni del corpo umano, strada successivamente seguita da vari gruppi di ricerca e che ha portato la RMN a essere la più promettente tecnica di imaging diagnostico a disposizione del radiologo.
Entrata nell'uso clinico nel 1982-1983 con le prime sporadiche apparecchiature, per lo più installate in ospedali universitari e centri di ricerca, la RMN comincia ad avere oggi una discreta diffusione, anche se limitata dall'elevato costo degli impianti, che varia da 1,5 a 3 miliardi di lire, e dalle difficoltà di installazione, dovute al notevole peso del magnete e alla necessità di schermare il campo magnetico generato.
Com'è successo per la tomografia computerizzata (TC), anche la RMN ha avuto fin dal suo avvento, e ha ancora oggi, un prevalente e più elettivo impiego diagnostico nella patologia del sistema nervoso, ma già si stanno individuando numerose condizioni patologiche degli organi toracici e addominali e di strutture delle estremità diagnosticabili tramite la RMN, la cui importanza clinica, a confronto con altre indagini diagnostiche, aumenterà con il progresso tecnologico delle apparecchiature.
2. Formazione dell'immagine in RMN
La localizzazione nello spazio dei protoni in base al fenomeno della RMN e la conseguente ricostruzione dell'immagine si ottengono sostanzialmente modificando il campo magnetico statico con l'applicazione di campi magnetici supplementari o gradienti, uno per ognuna delle tre direzioni dello spazio. La conseguente variazione della frequenza di risonanza, la quale, come è noto, aumenta o diminuisce con l'aumentare o il diminuire dell'intensità del campo, consente di localizzare nello spazio i protoni che risuonano alla frequenza di risonanza specifica dello strato del corpo che si vuole esaminare (v. risonanza magnetica nucleare: Principi fisici, suppl.). In pratica, pertanto, il magnete che genera il campo statico contiene al suo interno le tre coppie di spire che generano i gradienti e inoltre, sempre posizionate in maniera coassiale, le bobine di irraggiamento e di ricezione della radiofrequenza di risonanza.
La localizzazione è di fatto possibile analizzando l'intensità del segnale mediante la trasformata di Fourier e applicando un algoritmo di ricostruzione per proiezioni, così come si fa in tomografia computerizzata.
Il metodo, relativamente semplice in linea di principio, individuato quasi casualmente da Lauterbur in base alle osservazioni fatte su di un magnete difettoso, il quale aveva una disomogeneità di campo, risulta viceversa notevolmente complesso nella sua applicazione. Ciò dipende soprattutto dalla necessità di ottenere un'estrema precisione nell'emissione della radiofrequenza e nel rilevamento del segnale di risonanza e della variazione della magnetizzazione microscopica sul piano perpendicolare alla direzione del campo magnetico H0; inoltre, nel corso di una stessa acquisizione, si devono individuare più piani simultaneamente (v. Mansfield, 1977) o addirittura un volume, qualora si utilizzi la più complessa trasformata di Fourier a tre dimensioni.
Un elemento critico, per quanto riguarda il rilevamento del segnale e di conseguenza la qualità delle immagini ottenute, e l'antenna ricevente: ne esistono diversi tipi che differiscono per forma e dimensioni, a seconda delle parti del corpo da studiare. Le antenne più grandi si utilizzano per lo studio del cranio e delle estremità; esistono poi bobine superficiali che si pongono a contatto delle parti del corpo che è necessario studiare ad alta risoluzione (colonna vertebrale, occhio, articolazione temporo-mandibolare, scroto, mammelle, ecc.).
3. Sistema nervoso centrale (SNC)
La RMN, pur non potendo ancora essere considerata un'indagine di screening, per motivi economici e di disponibilità degli impianti, ha già oggi indicazione elettiva nella diagnosi di alcuni quadri patologici difficilmente investigabili con altre metodiche, invasive e non.
Come la TC ha significato agli inizi degli anni settanta il superamento della pneumoencefalografia e ha limitato il ricorso ad altre indagini, quali l'angiografia, a casi selezionati, la RMN offre oggi ulteriori prospettive di superamento nei confronti delle tecniche contrastografiche spinali e cerebrali.
L'assenza di ‛artefatti ossei', oltre alla multiplanarità delle scansioni effettuabili, permette infatti di ottenere la visualizzazione ottimale di molte strutture ‛problematiche' per le altre metodiche diagnostiche, quali le strutture della fossa cranica posteriore e il midollo spinale. La non necessità di ricorrere a mezzi di contrasto, grazie alla possibilità di variare i parametri delle sequenze ed esaltare così differenze di ‛contrasto', permette alla RMN di utilizzare lo stesso liquido cefalo-rachidiano come mezzo di contrasto, ottenendo quell'effetto ormai noto come ‛effetto mielografico'.
La fisiopatologia della quasi totalità delle lesioni acquisite del SNC si attua acutamente con tre modalità: le patologie prevalentemente intracellulari si esprimono con un ‛edema citotossico', le patologie prevalentemente di barriera emato-encefalica con un ‛edema vasogenico', le ipertensioni liquorali con un ‛edema interstiziale'. È intuibile che proprio dalle modificazioni di tenore e chimismo dell'idrogeno relative agli edemi menzionati dipende l'elevata sensibilità della RMN ai quadri patologici del SNC (v. Agnoli e altri, 1986). Analogamente le differenze rilevabili tra sostanza bianca e sostanza grigia e la possibilità di visualizzare le gliosi riparative di lesioni pregresse dipendono dal differente tenore di idrogeno presente nell'acqua e nei fosfolipidi dei diversi tessuti.
L'esperienza attuale indica, dunque, che la RMN è una metodica generalmente più sensibile della TC nell'identificazione di processi patologici del SNC.
Nel campo delle patologie malformative, la RMN è senza meno di prima scelta per le forme a carico della base cranica, della cerniera occipito-atlantoidea e delle strutture cerebello-tronco-midollari (v. Bydder e altri, 1983). Nella patologia siringomielica la RMN permette diagnosi di certezza già alla prima investigazione sagittale mediana. La cavità siringomielica è stata per la prima volta visualizzata direttamente tramite la RMN, e questo rende la RMN esame di prima istanza nel sospetto diagnostico della patologia siringomielica. Nelle sindromi di Arnold-Chiari si può documentare con lo stesso esame e con la stessa scansione l'entità delle patologie malformative scheletriche e di quelle del nevrasse: ipoplasia ed ernia degli emisferi cerebellari, dismorfismi bulbo-ponto-mesencefalici, idrocefalo, siringomielia.
Nelle patologie degenerative, oltre alla documentazione emisferica, è possibile per la prima volta l'identificazione delle strutture troncali e cerebellari con buona definizione di contrasto tra sostanza bianca e sostanza grigia. Nei pazienti affetti da patologie degenerative dei gangli della base e delle strutture diencefalo-mesencefalo-cerebellari, la RMN offre un ausilio all'inquadramento nosologico, identificando le strutture primariamente compromesse.
Nella patologia tumorale, l'applicazione della RMN è di particolare utilità per la diagnosi delle forme sottotentoriali, in cui l'assenza di ‛artefatti ossei', frequentemente presenti nella TC, insieme alla possibilità delle scansioni multiplanari rendono possibile la dimostrazione di neoplasie che sfuggono alle altre indagini diagnostiche (v. Brant-Zawadzki e altri, 1984). Anche per le forme sopratentoriali, tuttavia, questa indagine può risultare utile ai fini di una definizione più precisa dei confini del tumore e dei rapporti con l'area edemigena perifocale, prospettando nuovi criteri di valutazione chirurgica e radioterapica.
Nelle patologie vascolari la RMN presenta netti vantaggi ai fini diagnostici, rispetto ad altre metodiche, solo nelle forme acute, oltre che, naturalmente, in quelle sottotentoriali e nelle gliosi riparative (v. Gallucci e altri, 1985). Negli altri casi, comunque, la RMN offre la possibilità di una visualizzazione diretta delle anomalie congenite o acquisite a carico dei grossi vasi, oltre alla miglior delimitazione del processo stesso e dell'edema circostante. Le lesioni ischemiche acute, infatti, appaiono ben documentate, con estensione generalmente più ampia di quella messa in luce dalla TC, per la presenza di prolungati tempi di rilassamento perifocali imputabili a edema. Più difficile è la valutazione delle lesioni emorragiche, che possono manifestarsi in modo non univoco all'esame RMN, inducendo a non considerare questo come metodo di scelta, almeno nelle fasi acute e subacute (v. Gomori e altri, 1985). Il movimento dei protoni all'interno dei vasi fa sì, inoltre, che la RMN consenta l'identificazione di strutture vascolari di grosso e medio calibro, offrendo informazioni sulle occlusioni e sulle anomalie di decorso e struttura. L'indagine è elettiva per l'identificazione di malformazioni non identificate dall'esame angiografico e pertanto comunemente note come ‛criptiche'.
Nell'ambito della patologia infiammatoria e demielinizzante questa metodica ha destato notevole interesse. Nel caso delle malattie demielinizzanti, infatti, la RMN dimostra una sensibilità diagnostica che supera in alcune casistiche il 90% e che comunque la rende più attendibile di altre indagini quali i potenziali evocati o l'isoelectrofocusing liquorale. Nei pazienti affetti da queste malattie si riscontrano aree rotondeggianti, isolate o confluenti o a banda periventricolare, diffuse, a esclusivo interessamento della sostanza bianca, caratterizzate da prolungati tempi di rilassamento. La visualizzazione è possibile fin dalle fasi più acute del processo patologico. Non si ritiene che esistano criteri strumentali di diagnosi differenziale tra sclerosi multipla, leucoencefaliti o altre patologie di tipo infiammatorio, degenerativo o tossico della sostanza bianca. La diagnosi differenziale, pertanto, necessita del determinante ausilio della conoscenza clinica.
Nella patologia vertebro-midollare l'elevata risoluzione di contrasto e la visione multiplanare, specie quella utilissima sagittale, hanno reso la RMN indagine di elezione (v. Norman e altri, 1984). Nei pazienti che presentano sintomatologia riferibile a compressioni cervicali, dorsali o lombari è spesso evidente un'alterazione del segnale proveniente dai dischi intervertebrali. I dischi degenerati, a causa della riduzione dei valori della densità protonica e del T2 (tempo di rilassamento spin-spin), dovuta alla perdita d'acqua, danno un segnale di bassa intensità. Sfruttando l'effetto ‛mielografico' della colonna di liquor nelle sequenze ‛T2-pesate', le protrusioni discali e le eventuali compressioni sul sacco durale vengono evidenziate in maniera ottimale.
Anche nei casi di patologia neoformativa intra o extradurale, le scansioni sagittali e coronali consentono la corretta individuazione della lesione e le sequenze ‛T2-pesate' consentono la definizione dell'estensione della stessa, provocando l'annullamento del segnale proveniente dal tessuto normale e l'esaltazione del segnale ‛patologico'.
In conclusione possiamo oggi a ragione considerare la RMN come l'indagine di prima istanza per molte patologie del SNC. L'estrema sensibilità alle variazioni del contenuto di idrogeno, la non utilizzazione di radiazioni ionizzanti, la non invasività, la ripetitività consentono al clinico di inserire questa indagine ai primi stadi di molti protocolli diagnostici e, in termini ideali, di anteporla alla stessa TC, che andrebbe riservata a fasi successive e più mirate.
4. Torace e addome
Mentre per lo studio del sistema nervoso centrale la superiorità della RMN rispetto alle altre tecniche di diagnostica per immagini si sta sempre più affermando, permangono ancora alcuni problemi che tendono a ostacolare la piena utilizzazione della RMN a livello toraco-addominale. Il movimento legato alle escursioni respiratorie, difficilmente controllabile a causa della sua variabilità, unitamente all'attività cardiaca e alla peristalsi dei visceri cavi, influenza negativamente i lunghi tempi di acquisizione necessari per la formazione delle immagini; ciò si traduce nella presenza di artefatti che ostacolano la corretta interpretazione delle immagini stesse. A questo va aggiunta la completa mancanza di un valido mezzo di contrasto gastrointestinale e l'ancora insufficiente esperienza con mezzi di contrasto per uso endovascolare, i quali, come già in passato per la TC, potrebbero migliorare notevolmente l'accuratezza diagnostica della RMN, riducendo i problemi legati alla durata dell'esame e alla minore risoluzione spaziale rispetto ad altre tecniche diagnostiche.
Già ora l'estrema duttilità e il rapido progresso tecnologico della RMN hanno consentito di ridurre l'effetto di alcuni di questi fattori. È il caso, per esempio, della utilizzazione di sequenze con breve intervallo fra gli impulsi, le quali permettono di minimizzare l'effetto degli artefatti da movimento, migliorando la risoluzione anatomica e diminuendo consistentemente il tempo d'esame. In futuro lo sviluppo e la ricerca tecnologica saranno sicuramente in grado di eliminare i problemi esistenti, ampliando ulteriormente le possibilità di studio offerte dalla RMN.
a) Polmoni e cuore.
Mentre nell'ambito della patologia polmonare sono state effettuate solo sporadiche applicazioni della RMN, per lo più riferite alla stadiazione del cancro broncogeno, dove questa tecnica ha dimostrato maggiore sensibilità della TC nell'individuazione di linfonodi mediastinici tumefatti (v. Webb e altri, 1985), notevolissimo interesse ha suscitato e altrettanto notevoli possibilità ha dimostrato la RMN nello studio del cuore. Il fatto che i protoni del sangue in movimento non emettano segnale fa sì che nello studio con RMN esista un notevole contrasto tra miocardio e cavità cardiache, che consente un'esatta definizione dello spessore e delle variazioni durante il ciclo cardiaco del primo. Infatti, per avere una rappresentazione delle strutture cardiovascolari netta, non disturbata dal movimento sistodiastolico, lo studio con RMN del cuore viene effettuato con cardiosincronizzazione della ripresa del segnale, vale a dire che si possono ottenere immagini indifferentemente in qualunque fase del ciclo cardiaco, con conseguenti importanti rilievi di ordine morfologico e funzionale. Utilizzando tale tecnica sono state indagate con successo, grazie all'elevata risoluzione di contrasto e alla visione multiplanare della RMN, numerose condizioni patologiche del muscolo, delle cavità e dei grandi vasi, di tipo congenito e acquisito (v. Higgins, 1986). Fra le più importanti vale la pena di ricordare le cardiopatie congenite infantili, l'ischemia miocardica, la cardiomiopatia ipertrofica, le malformazioni dei grandi vasi mediastinici. I brillanti risultati ottenuti, unitamente alle prospettive di valutazioni metaboliche con agenti paramagnetici specifici e con spettroscopia in vivo, fanno ritenere che in futuro la RMN rappresenterà una delle indagini di più largo impiego nella patologia cardiovascolare.
b) Addome.
Nell'addome superiore, l'anatomia epatica, come quella del pancreas, viene riportata in modo estremamente fedele da parte della RMN. Le strutture venose portali appaiono chiaramente distinguibili dal restante parenchima epatico grazie alla loro bassa intensità di segnale. Nonostante l'effetto dei movimenti respiratori sia più evidente per il fegato, lo studio del lobo sinistro risulta più agevole che con la TC, con cui spesso, in questa regione, si registrano artefatti originati dall'interfaccia aria/liquido presente nello stomaco.
La RMN sembra essere più sensibile dell'angio-TC nell'identificazione di metastasi epatiche, a patto però che le sequenze utilizzate abbiano parametri temporali estremamente brevi: TR (tempo di ripetizione della sequenza spin-eco) inferiore a 300 ms e TE (ritardo dell'eco) inferiore a 30 ms (v. Stark, 1985; v. risonanza magnetica nucleare: Principi fisici, suppl.).
Altre condizioni patologiche alla cui individuazione la RMN si dimostra particolarmente adatta sono gli angiomi epatici. Questi presentano dei valori di T1 (tempo di rilassamento spin-reticolo) e T2 estremamente lunghi e perciò molto diversi da altre lesioni occupanti spazio nel fegato. Caratteristicamente appaiono come zone di netta ipointensità nelle sequenze a TR e TE brevi, mentre nelle sequenze a TR e TE lunghi presentano un segnale iperintenso rispetto al fegato normale. Anche nelle condizioni di aumentato accumulo di ferro nelle cellule epatiche (emosiderosi) la RMN offre un quadro patognomonico: il ferro infatti agisce come una sostanza paramagnetica provocando una netta ipointensità del parenchima epatico.
Le neoplasie primitive epatiche vengono meglio identificate nelle sequenze a TR e TE lunghi, per la loro elevata intensità di segnale; va però sottolineato che non è possibile distinguere tra neoplasia primitiva e secondaria unicamente in base al comportamento del segnale di RMN. La multiplanarità della RMN può tuttavia essere adeguatamente utilizzata nella valutazione dell'eventuale estensione neoplastica nei tronchi portali e nella vena cava inferiore.
Nonostante la buona qualità del quadro anatomico, la possibilità di un uso allargato della RMN nello studio della patologia pancreatica deve essere ancora vagliata sulla base di casistiche più ampie delle attuali. In via del tutto preliminare si può affermare che, anche nei confronti del pancreas, la possibilità di acquisire le immagini secondo piani orientati lungo qualsivoglia direzione dello spazio rende più chiare e facilmente valutabili le vie di diffusione delle colate pancreatiche in corso di pancreatite acuta. Inoltre risulta più semplice dimostrare la presenza di una trombosi vasale, associata a una flogosi e a un carcinoma pancreatico, senza ricorrere all'uso di mezzi di contrasto. La RMN potrebbe consentire il precoce riconoscimento del passaggio dalla necrosi pancreatica alla formazione di una pseudocisti, mediante l'individuazione della membrana che racchiude questa lesione. Ma accanto a queste note positive vanno considerati l'incostante riconoscimento del sistema duttale pancreatico e la mancata evidenza delle piccole calcificazioni, che costituiscono un aspetto frequente nei pazienti portatori di pancreatite cronica. Allo stato attuale, quindi, la TC e la colangio-pancreatografia retrograda per via endoscopica rappresentano gli esami in grado di risolvere la maggior parte dei problemi diagnostici relativi alla patologia pancreatica.
Anche nel settore della patologia surrenale le casistiche finora considerate risultano abbastanza esigue. I surreni, date le loro ridotte dimensioni, risentono più di altri organi della minore risoluzione spaziale offerta dalla RMN. In aggiunta a ciò, la supposta possibilità di caratterizzazione tessutale delle masse surrenali, in base alle caratteristiche del segnale, affermata in un primo tempo (v. Reining e altri, 1985), non sembra realizzarsi sempre. Nel 20% dei casi le lesioni surrenali appaiono difficilmente differenziabili tra di loro e solo la accertata presenza dell'eventuale neoplasia primitiva consentirebbe, in alcuni casi, di distinguere tra adenomi non funzionanti e metastasi (v. Reining e altri, 1986).
La RMN è una metodica di studio estremamente promettente nelle affezioni renali. Corticale e midollare vengono facilmente differenziate grazie al più lungo valore di T1 della midollare. Questo contrasto, naturale e fisiologico, tende progressivamente ad annullarsi all'aumentare dei valori di TR e TE utilizzati nella sequenza. Inoltre esso varia al variare di due fattori fondamentali: la vascolarizzazione renale e l'entità della diuresi. Perciò la perdita della differenziazione corticomidollare rappresenta una spia molto sensibile di malattia cronica renale oppure di un arresto improvviso della normale funzionalità renale, come capita in caso di rigetto di rene trapiantato (v. Geisinger e altri, 1984).
Tutte le lesioni focali renali possono essere facilmente distinte dalla RMN a seconda della loro natura solida o cistica e talvolta è anche possibile individuare, nell'ambito di lesioni a componente solida, i diversi tessuti da cui la lesione origina, grazie al differente comportamento del segnale. Le cisti sierose si distinguono bene dalle dilatazioni calico-pieliche, ma soprattutto dalle cisti a contenuto emorragico, che presentano costantemente alto segnale indipendentemente dai valori di TR e TE utilizzati.
Il carcinoma renale, pur manifestandosi in modo abbastanza eterogeneo, invia sempre un segnale più basso rispetto al parenchima normale nelle immagini a TR e TE brevi. Inoltre, malgrado la minore risoluzione spaziale, la diffusione metastatica a livello della vena renale e/o della vena cava inferiore risulta particolarmente evidente: senza dubbio viene messa in luce meglio dalla RMN che dalla TC. Un altro punto a favore della RMN, rispetto alla TC, è la possibilità di distinguere tra trombosi neoplastica e trombosi ematica.
La RMN fornisce informazioni altrettanto importanti in caso di trapianto renale, in cui l'indagine consente di evidenziare eventuali situazioni patologiche, diversificando i casi di rigetto da quelli di necrosi tubulare acuta e tossicità da ciclosporina.
Grazie alla visione multiplanare, la RMN offre informazioni diagnostiche simili e molto spesso superiori a quelle della TC nello studio dei vasi retroperitoneali (aorta, cava), in virtù del contrasto naturale offerto dai protoni in movimento; in assenza o riduzione di questo per stenosi, ectasia ‛neunsmatica, trombosi o turbolenza del flusso, l'intensità del segnale cambia in maniera peculiare, offrendo interessanti rilievi semeiologici di tipo morfologico e funzionale.
5. Scavo pelvico
A livello dello scavo pelvico, l'esame RMN incontra minori limitazioni che nel caso dell'addome superiore, grazie alla ridotta influenza dei movimenti respiratori e al migliore contrasto determinato dalla presenza di abbondante tessuto adiposo che separa tra loro i diversi organi.
Le neoplasie vescicali sono molto evidenti sia nella loro componente intravescicale che nell'eventuale estensione perivescicale. L'invasione neoplastica del grasso perivescicale sembra essere mostrata più precocemente dalla RMN che dalla TC (v. Fisher e altri, 1985.
Anche la patologia della ghiandola prostatica può essere efficacemente documentata con la RMN. Questa tecnica consente, infatti, di distinguere anatomicamente la porzione centrale della ghiandola rispetto a quella periferica, permettendo una valutazione altrettanto ottimale della regione periuretrale. L'unica condizione è l'uso di sequenze a TR e TE lunghi. In corso di patologia infiammatoria, l'aumento delle dimensioni della regione periferica, unitamente a un'aumentata intensità del segnale, quando vi sia anche il sospetto clinico, consente di porre diagnosi con notevole facilità senza dover ricorrere alla fastidiosa introduzione di una sonda ecografica per via transrettale.
Un problema ancora dibattuto riguarda la differenziazione tra iperplasia e neoplasia. Secondo alcuni autori, oltre alla differente localizzazione anatomica, le lesioni carcinomatose presentano, rispetto a quelle adenomatose, una netta disomogeneità e una maggiore intensità di segnale nelle sequenze a TR e TE lunghi (v. Ling e altri, 1986). Altri autori, invece, pensano che tale condizione non sia una regola o che, perlomeno, presenti un certo numero di eccezioni; pertanto, nelle forme iniziali, solo la possibilità di individuare la differente regione ghiandolare coinvolta indirizzerà verso una diagnosi corretta (v. Hricak e altri, 1985).
L'aspetto dell'utero, pur variando leggermente in rapporto alle diverse fasi del ciclo, mantiene delle caratteristiche fondamentali che facilitano il riconoscimento di eventuali alterazioni presenti. Nelle sequenze a brevi valori di TR e TE non sempre è possibile separare l'endometrio dal miometrio, ma nelle immagini con TR e TE lunghi, in condizioni normali, è possibile distinguere tre zone differenti a livello uterino: una zona più interna, rappresentata dall'endometrio, ad alta intensità di segnale; una zona intermedia, estremamente sottile, a bassa intensità, denominata zona giunzionale, facente parte del miometrio e caratterizzata da un ridotto flusso vascolare; una regione più esterna, che costituisce la rimanente parte del miometrio, a intensità di segnale intermedia. Le ovaie sono facilmente identificabili in vicinanza delle tube e si presentano con un segnale simile a quello delle strutture muscolari nelle immagini a TR e TE brevi, mentre trasmettono segnali uguali o leggermente più intensi di quelli del tessuto adiposo nelle immagini a TR e TE lunghi.
Per quanto riguarda la patologia, sicuramente le condizioni di più facile diagnosi sono i leiomiomi uterini. Il fibroma uterino, in assenza di complicazioni, appare come una massa rotondeggiante, di dimensioni variabili, a bassa intensità di segnale qualunque sequenza si utilizzi. Ma allorché si presentano fenomeni di emorragia, degenerazione cistica o ialinizzazione all'interno della neoplasia, l'aspetto tende a variare e l'intensità del segnale può aumentare nelle sole sequenze a TR e TE lunghi oppure anche in quelle a TR e TE brevi.
Un settore in cui la RMN può apportare un positivo contributo è sicuramente quello delle malformazioni uterine; la diagnosi di certezza è legata all'esecuzione di un esame isterosalpingografico seguito eventualmente dalla celioscopia. Nonostante l'attuale esperienza sia ancora limitata, la possibilità di valutare contemporaneamente sia il cavo uterino che la sua morfologia esterna permette di giungere alla diagnosi senza dover ricorrere all'esecuzione di esami più aggressivi. Il contributo della RMN allo studio dei tumori maligni dell'utero si esplica soprattutto nella corretta stadiazione ai fini dell'utilizzazione del migliore approccio terapeutico. Sulla base di esperienze iniziali (v. Bries e altri, 1984), la RMN viene considerata equivalente alla TC come criterio di attribuzione ai vari stadi delle pazienti con carcinoma cervicale, ma è convinzione di molti autori che, con l'avvento di miglioramenti tecnici e l'uso di una corretta preparazione della paziente, la RMN sarà in grado di delimitare con maggior precisione l'estensione della neoplasia.
Un campo in cui la RMN dimostra già da ora un'indiscussa superiorità è quello delle recidive di cancro del collo uterino. Essa consente, infatti, nelle sequenze a TR e TE lunghi, di separare le aree di fibrosi, che presentano una bassa intensità di segnale, da quelle in cui la neoplasia è recidivata, dove il segnale è invece elevato. Per quanto riguarda le ovaie, la differenziazione tra cisti semplici e cisti emorragiche è ancora una volta facilitata dal loro diverso comportamento. Le cisti di origine follicolare presentano basso segnale nelle immagini a TR e TE brevi e alto segnale in quelle a TR e TE lunghi. La presenza di metaemoglobina nelle cisti emorragiche provoca, invece, una riduzione del T1 e di conseguenza un alto segnale anche nelle sequenze a TR e TE brevi.
Nel campo delle lesioni neoplastiche, forse con la sola eccezione delle cisti dermoidi, le caratteristiche del segnale RMN non consentono, allo stato attuale, di separare nettamente i diversi tipi di tumori ovarici. Perciò, anche in questo settore, si rendono necessari ulteriori progressi prima di poter decidere se la RMN si rivelerà superiore alle altre tecniche di imaging nella corretta stadiazione delle forme tumorali.
La RMN, grazie all'utilizzazione di radiazioni non ionizzanti e all'assoluta mancanza di effetti nocivi conosciuti, è stata utilizzata, in via sperimentale, per lo studio di gravidanze patologiche dopo il terzo mese. Nonostante positive valutazioni preliminari (v. Weinreb e altri, 1985), l'applicazione della RMN in questo settore è tuttora gravemente limitata dai lunghi tempi di acquisizione, che rendono le immagini estremamente sensibili al movimento fetale. In futuro si spera di ovviare a questo inconveniente mediante l'adozione di sequenze di impulsi di durata inferiore rispetto a quelle tradizionalmente usate.
Utili informazioni, infine, può fornire la RMN sulle condizioni dell'ultimo tratto del tubo digerente, specialmente per quanto riguarda la natura dei tessuti neoformati.
6. Apparato muscolo-scheletrico
Lo studio della patologia muscolo-scheletrica e articolare si basa su tecniche di indagine diagnostica tradizionali, come la radiologia convenzionale e la xeroradiologia, o più sofisticate, quali la tomografia computerizzata, l'ecografia e la scintigrafia. La RMN rappresenta l'ultima nata tra le moderne tecniche di imaging diagnostico dell'apparato muscolo-scheletrico ed è tuttora in una fase di verifica e sperimentazione, il cui obiettivo è l'individuazione di settori ditale patologia in cui essa possa rivelarsi la tecnica di elezione. Si spera che, grazie alla multiplanarità, la RMN sia in grado di offrire una visione spaziale completa e affidabile delle lesioni.
Soprattutto nel settore delle articolazioni coxo-femorale, del ginocchio e della caviglia, la RMN ha già conseguito notevoli successi. Interessante appare lo studio delle necrosi asettiche della testa femorale mediante RMN. Questo tipo di lesioni è documentato tardivamente con l'esame radiologico tradizionale. La RMN consente di riconoscere precocemente la lesione - elemento, questo, di estrema importanza per un intervento terapeutico risolutivo -, dimostrando una sensibilità sicuramente superiore a quella della TC e paragonabile a quella della scintigrafia (v. Reiser e altri, 1984).
Nel campo della patologia del ginocchio il confronto deve essere eseguito soprattutto con la TC. La RMN, allo stato attuale, si dimostra superiore alla TC nella diagnosi delle tendinopatie del rotuleo, delle sinoviti pigmentarie villonodulari (PVNS) e delle lesioni acute parziali del legamento crociato anteriore (v. Moon e altri, 1983). In questi tipi di patologia la RMN consente di valutare con precisione l'estensione della lesione, di fondamentale importanza soprattutto nel caso di tendinosi del rotuleo, di distinguere fenomeni degenerativi da processi infiammatori cronici, come nel caso delle sinoviti villonodulan, e di valutare l'entità del danno discriminando lesioni parziali da lesioni totali del legamento crociato anteriore (v. Totty e altri, 1986).
Anche per quel che riguarda l'articolazione tibio-tarsica, e più in generale il piede, la RMN ha delle indicazioni elettive, che sono rappresentate dalle tendinopatie dell'achilleo, dalle osteocondriti dell'astragalo e dalle PVNS (v. Li e altri, 1984).
Un settore in cui la RMN sta assumendo un'importanza diagnostica sempre maggiore è quello della patologia traumatica, infiammatoria o tumorale delle parti molli. Già numerosi lavori, infatti, dimostrano la superiorità della RMN rispetto sia alla TC che all'arteriografia. Il grande vantaggio è rappresentato dalla possibilità di caratterizzare la lesione individuandone le componenti grassose, muscolari, vascolari. Inoltre la RMN mostra una maggiore sensibilità diagnostica, una risoluzione di contrasto più significativa e la capacità di delimitare e definire l'estensione reale della patologia (v. Turner e altri, 1985).
La radiologia convenzionale, più o meno associata a scintigrafia, rimane tuttora la tecnica diagnostica di prima istanza nella patologia tumorale dell'osso.
La RMN si è dimostrata superiore alla TC nella valutazione dei rapporti della neoplasia con i tessuti molli circostanti e nella visualizzazione della lesione, soprattutto grazie alla dimostrazione diretta delle dimensioni. Inoltre la RMN consente di stabilire i rapporti con le strutture vascolari individuando i piani di clivaggio eventualmente presenti (v. Dooms e altri, 1985). Pertanto la RMN sta progressivamente soppiantando sia la TC che l'arteriografia, relegandole a tecniche di seconda istanza in tale tipo di patologia.
In conclusione la RMN sta assumendo un importante significato nella diagnostica dell'apparato osteo-articolare e dei tessuti molli. Trova, infatti, indicazioni sempre più estese, riuscendo a semplificare protocolli diagnostici complessi. L'aumento delle conoscenze circa la caratterizzazione tessutale e la possibilità della spettroscopia in vivo potrebbero consentire alla RMN di assumere un ruolo fondamentale e insostituibile in tale settore.
7. Vantaggi e svantaggi della tomografia a risonanza magnetica
La tomografia a RM, rispetto alla più nota e diffusa tomografia computerizzata a raggi X (comunemente nota come tomografia assiale computerizzata o TAC), presenta i seguenti vantaggi.
1. Mentre la TAC fornisce, per definizione, sezioni del corpo su piani assiali e può solo ricavare per ricostruzione elettronica la visione di sezioni coronali e sagittali, con notevole perdita del potere informativo, la TRM permette di acquisire informazioni sui tre piani dello spazio (assiale, coronale e sagittale).
2. La TRM offre un contrasto notevolmente maggiore e quindi un maggior potere di discriminazione in virtù della multiparametricità dell'intensità del segnale. Il segnale che porta alla formazione dell'immagine TAC è monoparametrico, poiché dipende solo dal coefficiente di attenuazione (densità elettronica) dei tessuti attraversati; il segnale della TRM è invece multiparametrico, in quanto dipende contemporaneamente dalla densità protonica, dai tempi di rilassamento longitudinale e trasversale, dallo spostamento chimico e dal movimento. Ciò comporta che ‛pesando' specificamente l'uno o l'altro parametro con una apposita sequenza di acquisizione, la stessa struttura anatomica o patologica può comparire nell'immagine a livelli di contrasto radiologico estremamente diversi, con conseguente possibilità di individuare criteri di ‛caratterizzazione tessutale' sulla base delle variazioni delle intensità di segnale. Questa elevata sensibilità di contrasto consente di evitare l'impiego di mezzi di contrasto artificiali come si fa in TAC.
3. Dato che il calcio non emette segnale di risonanza, l'osso in TRM si rileva per il segnale fornito dai protoni della sua matrice organica. Conseguentemente in TRM non si hanno quegli artefatti che si hanno in TAC e che spesso limitano le possibilità diagnostiche a livello di distretti particolarmente soggetti ad artefatti, come la base cranica e la fossa posteriore, la colonna vertebrale e lo scavo pelvico.
4. L'uso di campi magnetici e onde radio privi di effetti biologici di interesse clinico ai livelli di intensità di uso corrente rende la TRM non pericolosa dal punto di vista biologico, mentre la TAC potenzialmente lo è, in quanto fa uso di raggi X ad azione ionizzante.
Oltre ai rischi e alle controindicazioni della TRM, di cui parleremo in seguito (v. cap. 8), gli svantaggi di questa metodica rispetto alla TAC sono: un più lungo tempo di acquisizione del singolo strato o della serie di strati, una più lunga durata dell'esame nel suo complesso, la mancata evidenza delle calcificazioni, il maggior costo dell'apparecchiatura e della sua manutenzione e, infine, i problemi di installazione legati al peso del magnete, usualmente superiore alle dieci tonnellate, e alla presenza di campi dispersi.
8. Effetti biologici, pericoli e controindicazioni.
Quando una persona è esposta a un campo magnetico, ogni variazione del campo può determinare nei tessuti conduttori la produzione di una corrente elettrica. Pertanto il campo magnetico statico determinerà il formarsi di una corrente elettrica nel sangue, che è un conduttore in movimento, mentre le variazioni di campo dovute ai gradienti indurranno una corrente nei tessuti conduttori immobili. Infine le onde radio determineranno un assorbimento di energia da parte dei tessuti esposti al campo, con conseguente sviluppo di calore.
Per ridurre i pericoli di questi effetti il campo magnetico statico nell'uso clinico non dovrebbe superare i 2,5 tesla e il campo a radiofrequenza non dovrebbe determinare un aumento della temperatura corporea superiore a 1 °C.
Va inoltre considerato che il campo magnetico può influire sia a livello elettrico (alterazione funzionale) che magnetico (movimenti e riscaldamento) su pace-makers e che l'indagine può risultare pericolosa per pazienti portatori di clips metalliche, specie intracraniche, per pregressi interventi su formazioni vascolari o altamente vascolarizzate. I movimenti di torsione indotti sulle clips dai gradienti potrebbero infatti provocare lesioni nei tessuti vicini o emorragie.
Il campo elettromagnetico può a volte indurre stimoli abnormi in pazienti con epilessia o gravi cardiopatie.
Nel complesso, comunque, prese le opportune precauzioni, possiamo considerare l'indagine con RMN un esame non invasivo e non pericoloso, tanto che può essere eseguito anche su bambini. L'esame dovrebbe essere eseguibile, senza particolari inconvenienti, anche sulle donne gravide.
Per l'indagine non sono richieste preparazioni speciali: digiuno, pulizia intestinale, accertamenti biochimici. Un punto che non va assolutamente trascurato è la preparazione psicologica del paziente, per evitare che giunga all'esame senza sapere nulla o, peggio, avendo informazioni erronee sul procedimento diagnostico al quale sta per essere sottoposto.
La necessità della preparazione psicologica è motivata dal fatto che il paziente contribuisce alla corretta realizzazione dell'indagine con la perfetta immobilità per un tempo che oscilla tra i 30 e i 60 minuti in uno spazio ristretto che può causare sensazioni di claustrofobia o di soffocamento.
Nonostante tale preparazione, esiste, secondo dati riportati, una percentuale di pazienti del 2-3% che rifiuta di farsi inserire all'interno del magnete o che impone di interrompere l'esame dopo alcuni minuti.
È difficile esaminare pazienti che non siano in grado di collaborare: neonati o bambini, traumatizzati gravi o in stato confusionale, pazienti molto sofferenti, ecc.
La selezione dei pazienti deve necessariamente prendere in considerazione tutti i fattori esposti, in modo da ottenere esami dimostrativi, non provocando danni, e utilizzare in modo ottimale l'apparecchiatura.
BIBLIOGRAFIA
Agnoli, A., Gallucci, M., Feliciani, M., Fabbrini, G., Conti, F., NRM imaging evaluation of cerebral edemas, in PET and NMR, new perspectives in neuroimaging and in clinical neurochemistry. Neurology and neurobiology, vol. XXI (a cura di L. Battistin e F. Gesterbrand), New York 1986.
Biagini, C., Buoni, C., Conti, F., Passariello, R., Pavone, P., Elementi di risonanza magnetica nucleare per il medico, Roma 1984.
Brant-Zawadzki, M., Badami, J.P., Mills, C.M., Norman, D., Newton, T.H., Primary intracranial tumor imaging: a comparison of MR and CT, in ‟Radiology", 1984, CL, pp. 435-440.
Bries, J.R., Ellis, J.H., Kopecky, K.K., Sutton, G.P., Stehman, F.B., Ehrlich, C.E., Assement of primary gynecologic malignancies: comparison of 0.15 T resistive MRI and TC, in ‟American journal of radiology", 1984, CXLIII, pp. 1249-1257.
Bydder, G.M., Steiner, R.E., Thomas, D.J., Marshall, J., Gilderdale, D.J., Young, I.R., NMR imaging of the posterior fossa: 50 cases, in ‟Clinical radiology", 1983, XXXIV, pp. 173-188.
Damadian, R., Tumor detection by NMR, in ‟Science", 1971, CLXXI, pp. 1151-1153.
Dooms, G.C., Fisher, M.R., Hricak, H., Higgins, C.B., MR imaging of intramuscular haemorrhage, in ‟Journal of computer assisted tomography", 1985, IX, pp. 908-913.
Fisher, M.R., Hricak, H., Tanagho, E.A., Urinary bladder MR imaging, in ‟Radiology", 1985, CLVII, pp. 471-477.
Gallucci, M., Fabbrini, G., Conti, F., Ruggieri, S., Agnoli, A., NMR imaging in transient cerebral ischemia, in ‟Cephalgia", 1985, suppl. 2, pp. 65-68.
Geisinger, M.A., Risius, B., Jordan, M.L., Magnetic resonance imaging of renal transplants, in ‟American journal of radiology", 1984, CXLIII, p. 1229.
Gomori, J.M., Grossman, R.I., Goldberg, H.I., Zimmerman, R.A., Bilaniuk, L.T., Intracranial hematomas: imaging by high-field MR, in ‟Radiology", 1985, CLVII, pp. 87-93.
Higgins, C.B., Overview of MR of the heart - 1986, in ‟American journal of radiology", 1986, CXLVI, pp. 907-918.
Hricak, H., Dooms, G.C., Jeffrey, R.B., Fisher, M.R., Tanagho, E., Higgins, C.B., MR imaging and ct in the evaluation of carcinoma of the prostate, in The scientific assembly and annual meeting of the Radiological Society, Chicago, November 1985, Chicago 1985.
Lauterbur, P.C., Image formation by induced local interaction: examples employing nuclear resonance, in ‟Nature", 1973, CCXLII, pp. 190-191.
Li, K.C., Henkelman, R.K., Poon, P.Y., Rubenstein, J., MR imaging of the normal knee, in ‟Journal of computer assisted tomography", 1984, VIII, pp. 1147-1154.
Ling, D., Lee, J.K.T., Heiken, J.P., Balfe, D.M., Glazer, H.S., McClennan, B.I., Prostatic carcinoma and benign prostatic hyperplasia: inability of MR imaging to distinguish between the two diseases, in ‟Radiology", 1986, CLVIII, pp. 103-107.
Mansfield, P., Multiplanar image formation using NMR spin echoes, in ‟Journal of physical chemistry", 1977, X, p. 155.
Moon, K.L., Genant, H.K., Helms, C.A., Chafetz, N.I., Crooks, L.E., Kaufman, L., Musculoskeletal applications of nuclear magnetic resonance, in ‟Radiology", 1983, CXLVII, pp. 161-171.
Norman, D., Mills, C.M., Brant-Zawadzki, M., Yeates, A., Crooks, L.E., Kaufman, L., MR imaging of the spinal cord and canal: potentials and limitations, in ‟American journal of neuroradiology", 1984, V, pp. 9-14.
Reining, J.W., Doppman, J.L., Dwyer, A.J., Frank, J., MRI of indeterminated adrenal masses, in ‟American journal of radiology", 1986, CXLVII, pp. 493-496.
Reining, J.W., Doppman, J.L., Dwyer, A.J., Johson, A.R., Knop, R.H., Distinction between adrenal adenomas and metastases using MR imaging, in ‟Journal of computer assisted tomography", 1985, IX, pp. 898-901.
Reiser, M., Rupp, N., Heller, H.J., Allgayer, B., Lukas, P., Lange, J., Pfafferott, K., Fink, U., MR-tomography in the diagnosis of malignant soft-tissue tumours, in ‟European journal of radiology", 1984, IV, pp. 288-293.
Stark, D.D., MRI of the abdomen and pelvis, in The fourth annual meeting of the Society of Magnetic Resonance in Medicine, London, August 19, 1985, London 1985.
Totty, W.G., Murphy, W.A., Lee, J.K.T., Soft-tissue tumours: MR imaging, in ‟Radiology", 1986, CLX, pp. 135-141.
Turner, D.A., Prodromos, C.C., petasnick, J.P., Clark, J.W., Acute injuries of the ligaments of the knee: magnetic resonance evaluation, in ‟Radiology", 1985, CLIV, pp. 717-722.
Webb, W.R., Jensen, B.G., Sollitto, R., Bronchogenic carcinoma: staging with MR compared with staging CT and surgery, in ‟Radiology", 1985, CLVI, pp. 117-124.
Weinreb, J.C., Lowe, T.W., Santos-Ramos, R., Cunningham, F. G., Parkey, R., Magnetic resonance imaging in obstetric diagnosis, in ‟Radiology", 1985, CLIV, pp. 157-161.
Tomografia a emissione di positoni di Alberto Del Guerra
SOMMARIO: 1. Introduzione. 2. Cenni storici. 3. Le componenti di un centro per la PET. 4. Elementi tecnici: a) fenomeni fisici nella PET; b) il tomografo. 5. Applicazioni cliniche della PET: a) considerazioni generali; b) esempi di indagini cliniche per alcuni organi. 6. Conclusioni. □ Bibliografia.
1. Introduzione
La tomografia a emissione di positoni (TEP), chiamata più comunemente PET (acronimo della dizione anglosassone Positron Emission Tomography), è una tecnica non invasiva che permette di effettuare studi quantitativi di fisiologia e fisiopatologia. Essa si basa sull'uso di traccianti marcati con radioisotopi che emettono positoni (β+). Per tracciante si intende un elemento, o una sostanza, che viene introdotto in un sistema per studiarne le funzioni biologiche. Il tracciante deve mescolarsi immediatamente e uniformemente ai costituenti del sistema senza perturbarlo minimamente; deve quindi riprodurre il ‛comportamento' del sistema, ma allo stesso tempo essere perfettamente identificabile. Nel caso di un tracciante radioattivo, la struttura chimica regola il suo comportamento, mentre l'emissione di radiazioni ne assicura l'identificabilità. La scelta del particolare tipo di tracciante dipende dall'organo (o tessuto) da studiare, dal processo fisiologico o patologico che si vuole investigare e dalla cinetica del radiofarmaco, che deve assicurare una sufficiente concentrazione di radioattività nell'organo bersaglio.
Per un'indagine con la PET il tracciante iniettato nel paziente è marcato con un radioisotopo che emette positoni. Ogni positone emesso, dopo aver percorso al massimo alcuni mm, si annichila con un elettrone del tessuto biologico circostante e produce due fotoni (raggi γ), ciascuno con energia di 511 keV, a 180° tra di loro. La rivelazione dei due fotoni in coincidenza temporale da parte di due rivelatori contrapposti definisce una direzione nello spazio (detta anche ‛linea di volo'), lungo la quale si trova il punto di annichilazione. Ruotando i rivelatori attorno al paziente si ottiene il sinogramma, cioè l'insieme delle proiezioni da cui risalire alla distribuzione spaziale del tracciante all'interno del bersaglio biologico in esame.
Le tecniche di ricostruzione dell'immagine sono simili a quelle usate nella tomografia assiale computerizzata (TAC, v. radiologia medica); in entrambi i casi ci si basa su un'equazione integrale,
P(r, ϕ) ∝ ∫Γf(x, y) ds,
dove P(r, ϕ) è la cosiddetta ‛proiezione' secondo la direzione Γ (individuata dalle coordinate r e ϕ), proporzionale all'integrale della funzione f(x, y), che rappresenta: a) il coefficiente di trasmissione dei raggi X per la TAC; b) l'attività dell'emettitore β+ nella PET.
Gli algoritmi di ricostruzione sia per la TAC che per la PET sono ben più sofisticati di una semplice retroproiezione, prodotta retroproiettando le misure ottenute per una distribuzione originale di tre sorgenti di diversa intensità, tuttavia, in entrambi i casi, il punto di partenza per la ricostruzione delle immagini è sempre costituito dalle ‛proiezioni', cioè dalle misure sperimentali lungo linee definite nello spazio. Nella TAC la definizione della linea è ottenuta collimando la sorgente di raggi X; nella PET, invece, è assicurata dalla ‛collimazione elettronica' prodotta nella rivelazione dei due γ in concidenza. Proprio la collimazione elettronica rappresenta uno dei maggiori vantaggi della PET rispetto alla tomografia a fotone singolo (detta comunemente SPECT, acronimo dell'espressione anglosassone Single Photon Emission Computed Tomography,) che necessita di collimatori passivi per la definizione della linea di volo del fotone. L'imaging con i positoni è quindi più efficiente dell'imaging a fotone singolo, in quanto non vi sono i collimatori passivi che assorbono una gran parte della radiazione incidente (efficienza tipica di trasmissione dei collimatori = 10-4 ÷ + 10-3). Inoltre, al contrario di quanto accade nella SPECT, l'intensità di conteggio nella PET è in prima approssimazione indipendente dalla profondità della sorgente all'interno del bersaglio; ciò consente di applicare fattori di correzione assoluti, che tengano conto dell'assorbimento dei fotoni nel bersaglio, e perciò di effettuare misure quantitative della concentrazione del tracciante nel tessuto biologico. È quindi possibile derivare valori assoluti per funzioni tessutali come il flusso sanguigno, il consumo di substrato metabolico, ecc., con il 5 ÷ 10% di incertezza. Inoltre la disponibilità tra gli emettitori β+ di radioisotopi fisiologici e a vita molto breve, come l'ossigeno-15, l'azoto-13, il carbonio-11 e il fluoro-18, rende la PET uno strumento diagnostico estremamente potente e affidabile.
2. Cenni storici
L'impiego di radioisotopi che emettono positoni per l'imaging medico fu proposto per la prima volta nel 1951 da Wrenn e da Sweet, che suggerirono di utilizzare un isotopo del rame, il 64Cu. Il primo tentativo sperimentale è dovuto a Brownell e Sweet (v., 1953), che usarono un tracciante marcato proprio con 64Cu e due blocchi di scintillatore (ioduro di sodio attivato al tallio) contrapposti per la localizzazione di tumori cerebrali. Una scansione attorno al bersaglio con traslazioni e rotazioni forniva un imaging bidimensionale ‛convenzionale' della distribuzione del radioisotopo, senza alcun tentativo di ricostruzione tomografica. Nel 1959 Anger e Rosenthal (v., 1959) presentarono al congresso della IAEA (International Atomic Energy Agency) a Vienna un prototipo di camera a positoni costituito da due cristalli contrapposti di ioduro di sodio di grande area (28 cm di diametro). Anche in questo caso veniva prodotta un'immagine puramente bidimensionale. Solo nel 1962 Rankowitz e collaboratori (v., 1962), del Laboratorio Nazionale di Brookhaven negli Stati Uniti, svilupparono il concetto di tomografia di una sezione trasversa. Essi costruirono un anello di 32 rivelatori di NaI che circondava il paziente. L'immagine era ottenuta per semplice retroproiezione, secondo il principio illustrato nella tav. I. Nello stesso periodo, e in maniera indipendente, Oldendorf (v., 1961) e Kuhl ed Fdwards (v., 1963) proponevano metodi tomografici per l'imaging con radioisotopi emettenti un singolo fotone, dando inizio alla già citata SPECT.
Questi primi accenni di metodi tomografici, che avevano avuto origine nell'ambito della medicina nucleare, rimasero tuttavia nel limbo per più di dieci anni, fino al primo prototipo di tomografo per la TAC sviluppato da Hounsfield (v., 1972), nel 1972 (per tale realizzazione Hounsfield ha ricevuto assieme a Cormack il premio Nobel per la medicina nel 1979). Solo allora, in seguito alla messa a punto dei metodi di ricostruzione per la TAC e agli straordinari progressi tecnici nel campo dei rivelatori e dell'elettronica, venne ripresa in vari centri la ricerca per la costruzione di tomografi per positoni, fino ad arrivare a un primo prototipo commerciale installato presso l'Università di California a Los Angeles nel 1976.
Negli ultimi dieci anni sono stati compiuti progressi notevoli nell'imaging e nell'affidabilità delle relative macchine e sono sorte alcune ditte specializzate che forniscono macchine commerciali. Attualmente sono circa cinquanta i tomografi PET installati nel mondo, la maggior parte negli Stati Uniti; nonostante l'alto costo di questi strumenti, se ne prevede un raddoppio nei prossimi cinque anni.
3. Le componenti di un centro per la PET
La tomografia a emissione di positoni richiede una collaborazione multidisciplinare, con fisici, chimici, matematici, informatici e medici, che lavorano insieme. Si possono enucleare cinque componenti necessarie per la formazione e il corretto funzionamento di un centro PET per la ricerca clinica: 1) il ciclotrone; 2) la radiochimica; 3) il tomografo; 4) il calcolatore e il software di ricostruzione; 5) la componente medica.
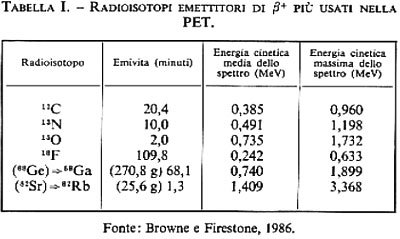
Il ciclotrone. - L'utilizzo di radioisotopi fisiologici a vita molto breve (v. tab. I), come il carbonio-11, l'azoto-13 e l'ossigeno-15, richiede, per la loro produzione, la presenza di un ciclotrone nella stessa sede del centro PET; il fluoro18, invece, che ha una emivita di 110 minuti circa, può anche essere prodotto in un ciclotrone lontano e inviato al centro tramite rapidi mezzi di comunicazione (questo accade, per esempio, negli Stati Uniti, dove centri PET nel sud della California ricevono regolarmente per trasporto aereo 18F-desossiglucosio dal laboratorio Crocker dell'Università di California a Davis, a più di 400 km di distanza). Alternativamente si va sempre più diffondendo l'utilizzo di gallio-68 e rubidio-82, che sono ottenibili da generatori (rispettivamente germanio-68 e stronzio-82), che possono essere direttamente utilizzati in centri ospedalieri e di ricerca, senza la necessità di ciclotroni in loco. Tali generatori sono analoghi alla colonna molibdeno-99 ⇒ tecnezio-99m, la cui introduzione nel 1960 da parte di Tucker (v., 1960) e la successiva commercializzazione a partire dal 1966 hanno determinato uno sviluppo eccezionale della medicina nucleare.
La radiochimica. - È necessario attrezzare il centro PET con un reparto di radiochimica ‛calda' estremamente efficiente, per effettuare la marcatura dei radiofarmaci, i controlli di purezza e i test biologici; specialmente per l'utilizzo di radioisotopi fisiologici a vita brevissima (11C, 13N e 150) il reparto di radiochimica è una componente particolarmente critica, perché deve ‛maneggiare' anche centinaia di mCi di radioisotopo per avere in linea alcuni mCi di radiofarmaco da iniettare nel paziente.
Il tomografo. - Lo strumento per la rilevazione dei due fotoni di annichilazione è l'elemento cruciale di un centro per la PET. Il tomografo è di solito costituito da un insieme di scintillatori (visti da fototubi), disposti in varie geometrie; dall'iniziale sistema a due cristalli contrapposti si è passati a configurazioni sempre più complesse: due gamma camere contrapposte ruotanti, un anello di scintillatori, strutture esagonali con copertura di un grande angolo solido e strutture a vari anelli adiacenti.
I diversi tipi di rivelatori con i rispettivi vantaggi e limiti saranno discussi nel cap. 4.
Il calcolatore e il software di ricostruzione. - Parte integrante del tomografo è il calcolatore, che è preposto all'acquisizione dei dati e alloro immagazzinamento in memorie di massa, alla ricostruzione delle immagini e alla loro elaborazione. Il progresso scientifico e tecnologico in questo campo è stato straordinario negli ultimi dieci anni; i tomografi commerciali sono forniti di calcolatori dedicati di media grandezza e di processori vettoriali in grado di eseguire una prima ricostruzione delle immagini a mano a mano che ricevono i dati. Inoltre si tende sempre di più a presentare le immagini in forma tridimensionale mediante tecniche di contorno, di ombreggiatura, di sezionatura, ecc. La maggior parte dei tomografi è intrinsecamente bidimensionale e la tridimensionalità delle immagini è ottenuta interpolando e sovrapponendo immagini ottenute su piani diversi. Tuttavia i due fotoni di annichilazione sono emessi su tutto l'angolo solido, per cui, onde utilizzare tutta l'informazione disponibile, cioè tutti i decadimenti radioattivi, ci si sta sempre più orientando verso tomografi con una grande copertura d'angolo solido e verso un'acquisizione dei dati in forma direttamente tridimensionale. Si utilizza quindi sempre di più il concetto di voxel (volume element) invece di quello di pixel (picture element) e anche gli algoritmi di ricostruzione tendono a diventare intrinsecamente tridimensionali.
La componente medica. - È evidente che in un centro per la PET è essenziale la presenza di una qualificata componente medica. Come sarà ampiamente discusso nel cap. 5, infatti, le applicazioni cliniche della PET hanno uno spettro potenziale assai vasto, e di volta in volta saranno necessari fisiologi, cardiologi, neurologi, internisti, psichiatri, ecc. Non è pensabile che esista un centro per ogni specializzazione interessata: il centro PET sarà piuttosto unico (per ogni complesso clinico o per più complessi) e a esso ricorreranno tutti gli specialisti delle varie branche della medicina.
4. Elementi tecnici.
a) Fenomeni fisici nella PET.
La rivelazione dei due fotoni di annichilazione è l'ultimo di una serie di processi fisici indipendenti: 1) l'emissione e l'annichilazione dei positoni; 2) l'interazione dei fotoni nel bersaglio biologico; 3) l'interazione del fotone nel rivelatore.
Emissione e annichilazione dei positoni. - I positoni sono emessi secondo il caratteristico spettro β continuo, fino all'energia cinetica massima caratteristica di ciascun radioisotopo (v. tab. I). Il positone percorre un tratto finito (range) nel tessuto, perdendo energia fino a raggiungere la termalizzazione. Il range in acqua varia da una frazione di mm per il 18F (che ha la minima energia) ad alcuni mm per l'isotopo con l'energia più elevata (il 82Rb). Una volta termalizzato (di solito si trascura il fenomeno dell'annichilazione in volo, che è inferiore all'1% 2 ÷ 2%), il β+ si annichila con un elettrone della materia circostante. Per la conservazione della quantità di moto totale del sistema, se il positone e l'elettrone fossero fermi, i due fotoni sarebbero emessi esattamente in versi opposti. Invece, a causa del moto di Fermi, l'emissione dei due fotoni è ‛circa' collineare, con una distribuzione gaussiana attorno a 180°. In acqua la larghezza a mezza altezza della distribuzione è di circa 0,5.
Interazione dei fotoni nel bersaglio biologico. - Il cammino libero medio di un fotone con un'energia di 511 keV in acqua è di circa 10 cm. La testa e il torace di un essere umano hanno uno spessore di circa 20 cm di acqua equivalenti, cioè di circa due cammini liberi medi. Questo significa che una buona parte dei fotoni emessi nel processo di annichilazione interagisce nel tessuto. Solo circa il 15 ÷ 20% delle coppie di fotoni raggiungerà il rivelatore senza subire alcun processo di diffusione; negli altri casi almeno uno dei due fotoni sarà completamente assorbito nel tessuto o subirà comunque una diffusione Compton che lo devierà dalla linea di volo originale e quindi produrrà un ‛rumore' nell'immagine ricostruita, provocando un effetto di sfuocamento e di perdita di contrasto. Si è accennato al fatto che la correzione per attenuazione è in prima approssimazione indipendente dalla posizione della sorgente emettitrice all'interno del bersaglio. In realtà la correzione è la stessa per tutti i punti che appartengono alla stessa linea di volo, ma è diversa per ciascuna proiezione. È quindi necessario, soprattutto nel caso di indagini PET in organi estesi, effettuare prima una misura sperimentale per valutare la correzione da applicare a ciascuna proiezione. Questa misura viene effettuata utilizzando lo stesso tomografo come rivelatore e una sorgente di fotoni di energia intorno ai 511 keV. Di solito si usa proprio una sorgente di germanio-68 gallio-68, che emette positoni e quindi due fotoni da 511 keV che vengono rivelati in coincidenza. Nei tomografi ad anello la sorgente viene posta tra l'anello e il paziente; facendo ruotare la sorgente attorno al paziente (oppure utilizzando una sorgente estesa), si misura l'attenuazione dei fotoni lungo le varie proiezioni. I coefficienti ricavati in trasmissione si utilizzano poi per correggere le ‛proiezioni' ottenute in tomografia a emissione e quindi per apportare una correzione locale pixel per pixel.
Interazione del fotone nel rivelatore. - Il fotone che interagisce nel rivelatore rilascia energia sotto forma di effetto Compton e di effetto fotoelettrico. La localizzazione del fotone dipende dal potere frenante del rivelatore e dalla sua ‛efficienza quantica', cioè dall'efficienza nel convertire l'energia perduta dal fotone in un'utile informazione digitale. Il tipo di rivelatore scelto è quindi determinante per la geometria e le prestazioni del tomografo, come sarà discusso nel paragrafo seguente.
b) Il tomografo.
Un rivelatore ideale per un tomografo per la PET dovrebbe possedere i seguenti requisiti: a) un'alta efficienza di rivelazione per fotoni da 511 keV, per garantire un'elevata statistica di conteggi; b) una risposta all'interazione del fotone estremamente rapida, per far sì che la finestra temporale per la collimazione elettronica sia la più stretta possibile, in modo da ridurre le coincidenze accidentali; c) un'elevata risoluzione spaziale, poiché la precisione nella direzione della linea di volo determina la localizzazione trasversa della sorgente.
Inoltre il tomografo ideale dovrebbe: a) avere una grande copertura dell'angolo solido, per utilizzare al massimo le informazioni disponibili (le disintegrazioni nucleari del radioisotopo β+-emettente); b) essere in grado di accettare ed elaborare un'elevata intensità di conteggi, senza problemi di tempi morti. La somministrazione di radioisotopi a vita brevissima, come 11C, 13N, 15O, rende possibile infatti raggiungere frequenze istantanee di disintegrazione anche superiori a 108 s-1 senza impiegare dosaggi troppo elevati per il paziente. Un esame dura tipicamente da 5 a 10 minuti e la dose rilasciata al paziente è dell'ordine del rad.
Naturalmente non tutti i parametri possono essere ottimizzati allo stesso tempo. Una soluzione che risponde meglio a una richiesta può essere estremamente insoddisfacente per un'altra. Pertanto i vari tipi di tomografi possono essere paragonati solo in termini delle loro prestazioni globali, cioè della qualità dell'immagine (risoluzione spaziale, contrasto, contenuti quantitativi) ottenuta in un dato tempo con una data dose di radiazioni rilasciata al paziente.
I tomografi per la PFT si dividono in due grandi classi: quelli per la testa e quelli per il corpo intero. Nel primo caso saranno in genere molto compatti con una piccola apertura utile (diametro tipico di 30 ÷ 40 cm); il tomografo per il corpo intero invece avrà un campo di vista più grande (diametro utile di 60 ÷ 80 cm). L'ottimizzazione del tomografo per un tipo di indagine, ad esempio per quella neurologica, non implica necessariamente un'analoga ottimizzazione per un altro tipo di indagine, ad esempio per quella cardiologica.
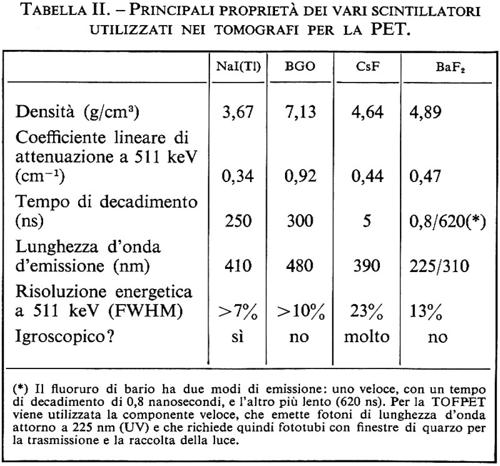
La prima generazione di tomografi, a partire dal 1974, era del tipo a singolo anello di cristalli di NaI(Tl), secondo la configurazione originale ideata dal gruppo di Brookhaven. Per la generazione successiva di tomografi gli sforzi sono stati rivolti ad aumentare sia la sensibilità (convenzionalmente misurata nei tomografi ad anello in conteggi al secondo per μCi di radioisotopo per ml di acqua) sia la frequenza di campionamento spaziale. L'aumento della sensibilità diminuisce il tempo dell'esame e produce immagini con minore rumore statistico; una più alta frequenza di campionamento migliora la risoluzione spaziale, ma aumenta il rumore statistico.
Seguendo un suggerimento di Cho e Farukhi (v., 1977), la sensibilità di un tomografo a singolo anello di ioduro di sodio è stata aumentata di un fattore almeno due sostituendo lo ioduro di sodio con un nuovo cristallo, il germanato di bismuto (Bi46e3O12, chiamato semplicemente BGO). Questo cristallo è il materiale scintillante di più alta densità (7,13 g/cm3, circa doppia di quella dello ioduro di sodio) e con il più elevato Z medio. Il miglioramento fu dimostrato per la prima volta dal gruppo di Montreal (v. Thompson e altri, 1979) su un tomografo per la testa (POSITOME Il). La tav. II,1 è una foto del tomografo POSITOME IIIp, un modello perfezionato del tomografo originale, formato da 2 anelli di 64 cristalli di BGO visti ciascuno da un singolo fototubo. Usando uno scintillatore denso come il BGO, è stato possibile ridurre le dimensioni dei singoli cristalli, migliorando quindi la risoluzione spaziale. Per aumentare l'angolo solido coperto, vengono ora normalmente adottate soluzioni a molti anelli adiacenti con capacità di imaging contemporaneo di sezioni parallele e oblique. I tomografi commerciali dell'ultima generazione hanno anche 4 o 5 anelli con un campo di vista longitudinale di circa 6 ÷ 8 cm. La tav. II, 2 è una fotografia di uno dei più recenti tomografi commerciali (ECAT III), installato presso l'Istituto di Fisiologia Clinica del CNR di Pisa. L'ECAT III è un tomografo per il corpo intero con un diametro utile di ~60 cm, costituito da vari anelli (fino a 4) ciascuno con 512 cristalli di BGO.
L'uso dell'informazione del tempo di volo per localizzare l'annichilazione del positone fu suggerito da Anger (v., 1974) nel 1974. Misurando la differenza tra i tempi di arrivo dei due fotoni è possibile risalire alla posizione del punto di annichilazione lungo la linea di volo. Scintillatori come lo ioduro di sodio e il germanato di bismuto non consentono l'utilizzo di tale tecnica, perché la risposta in luce del cristallo all'assorbimento del fotone è troppo lenta: la differenza fra i tempi di arrivo dei due fotoni può essere misurata con una precisione di alcuni nanosecondi, per cui l'incertezza sulla posizione del centro emettitore diventa superiore al diametro del tomografo. L'uso di scintillatori estremamente veloci, come il fluoruro di cesio (CsF) o di bario (HaF2), ha permesso di ottenere una risoluzione temporale di circa 400 picosecondi, che comporta un'incertezza nella localizzazione di circa 6 cm. Questo non permette di determinare direttamente la posizione della sorgente, ma assicura un migliore rapporto segnale/rumore, riducendo la zona di possibile localizzazione. Il metodo delle retroproiezioni per la localizzazione della sorgente può essere rappresentato in una PET convenzionale e in una PET con informazione del tempo di volo. Quest'ultima tecnica è chiamata comunemente TOFPET, acronimo dell'espressione anglosassone Time Of Flight Positron Emission Tomo graphy.
Le principali proprietà degli scintillatori comunemente utilizzati per la PET sono descritte nella tab. Il.
Una risoluzione spaziale di 3 ÷ 4 mm è considerata il limite pratico per l'imaging PET, se si tiene conto dei fenomeni fisici (range dei positoni, non collinearità dei fotoni) e dei parametri sperimentali (dimensione dei cristalli e loro accoppiamento con i fototubi). Per ottenere tale risoluzione spaziale in un sistema a molti scintillatori si usa semplicemente un gran numero di cristalli di dimensioni trasverse ridotte; ad esempio, per un tomografo a singolo anello, vengono correntemente usate varie centinaia di cristalli di BGO di dimensioni 4 x 10 mm2. Cristalli così piccoli richiedono un grande numero di canali di elettronica e inoltre presuppongono fototubi ‛speciali' per la raccolta della luce emessa da ciascun cristallo, o l'uso di complicati sistemi di codifica; in entrambi i casi si ha un aggravio dei costi e della complessità del sistema.
Un rivelatore alternativo, capace di una risoluzione spaziale elevata (con facilità si ottengono 2 mm) e con il quale si possono coprire facilmente grandi aree, e la cosiddetta ‛camera proporzionale multifili'. Una camera proporzionale multifili può essere vista come un insieme di contatori proporzionali a gas. Essa consiste di due elettrodi piani a massa (catodici) e di una serie di fili anodici a tensione positiva in atmosfera di gas. Se viene prodotta una ionizzazione nel gas, gli elettroni liberati migrano verso i fili anodici, dove subiscono un processo di moltiplicazione a causa dell'elevato campo elettrico in prossimità dei fili (105 V/cm). Ciò provoca una valanga di elettroni che migrano verso l'anodo e di ioni che recedono verso i piani catodici. Questa valanga provoca un segnale che può essere rivelato direttamente sui fili anodici, oppure sui piani catodici. Dalla determinazione della posizione della valanga si risale quindi alla localizzazione bidimensionale dell'interazione primaria (ad esempio l'interazione di un fotone con il gas) che ha generato il processo. Le camere proporzionali multifili sono state originariamente costruite per esperimenti di fisica delle particelle elementari, ma il loro uso si è rapidamente esteso a vari altri campi della fisica, della biologia e della medicina. Purtroppo il potere frenante di un gas per fotoni da 511 keV è praticamente nullo e quindi per poter essere utilizzate in tomografia a positoni le camere proporzionali multifili devono essere accoppiate a convertitori opportuni ad alto Z e ad alta densità. Alcuni prototipi di tomografi che fanno uso di questo tipo di rivelatore sono istallati in centri di ricerca, altri sono allo studio.
5. Applicazioni cliniche della PET
a) Considerazioni generali.
Le applicazioni cliniche della PET coprono tutto lo spettro di indagini della medicina nucleare convenzionale e della tomografia a emissione di un singolo fotone (SPECT), con il grande vantaggio di fornire risposte quantitative e quindi di maggior valore diagnostico. Inoltre l'utilizzo di radioisotopi a vita breve (e in particolare dei radioisotopi fisiologici) permette di condurre indagini dinamico-funzionali non altrimenti effettuabili. A titolo di esempio citiamo alcune indagini cliniche per i vari organi: a) per il cervello, la determinazione delle dimensioni di una lesione, gli studi sul flusso sanguigno e sul metabolismo, il monitoraggio degli effetti di una terapia antitumorale; b) per il cuore, lo studio della cardiopatia ischemica e delle miocardiopatie, basato sull'analisi regionale della funzionalità meccanica, del flusso sanguigno e del metabolismo miocardico; c) per i polmoni, la rivelazione di un embolo, la localizzazione e la valutazione quantitativa di tumori primitivi e di metastasi; d) per la tiroide, lo studio della tireotossicosi, la misura quantitativa delle lesioni cancerose, il monitoraggio della terapia antitumorale; e) per il fegato, la determinazione dei tumori primitivi e secondari, lo studio della funzione epatica e della cistifellea; f) per le ossa, lo studio dei traumi e la localizzazione delle forme tumorali primitive e secondarie; g) per il corpo intero, la rivelazione differenziale degli ascessi, lo studio degli anticorpi monoclonali e del loro uso nel trattamento dei tumori, ecc.
Per effettuare tutte queste analisi non solo bisogna avere un tomografo con la sensibilità opportuna, ma è anche necessario disporre di una serie di traccianti specifici, marcati con un radioisotopo β+-emettente. In analogia con lo sviluppo dei traccianti convenzionali della medicina nucleare, marcati con tecnezio-99m, indio-111, iodio-123 e iodio-131, ecc., si sta ora rapidamente sviluppando la ricerca di traccianti specifici per la PET. Il fluoro-18 è già impiegato con successo nella ricerca di tumori ossei e per lo studio del metabolismo del glucosio e del flusso sanguigno. Esistono innumerevoli traccianti marcati con il 18F, specifici per i vari tipi di indagine; ad esempio, per indagini sul cervello, il 18F-desossiglucosio è utilizzato per studi sul metabolismo del glucosio, il 18F-glutammato per studi sul metabolismo tumorale e sull'invecchiamento precoce (morbo di Alzheimer), la 18F-fluorodopa per lo studio di particolari forme di neuropatologia, come il morbo di Parkinson, il 18F-spiperone per lo studio dell'epilessia, ecc.
Esistono numerosi altri traccianti, marcati con gli altri radioisotopi elencati nella tab. I, per varie altre indagini specifiche. E evidente che il diffondersi della PET va di pari passo con la disponibilità di traccianti opportuni che permettano di sviluppare un sempre maggior numero di procedure diagnostiche.
Nei paragrafi successivi saranno illustrati alcuni esempi di applicazioni cliniche della PET per alcuni organi: il cervello, il cuore e la tiroide. Questi esempi non coprono tutto lo spettro disponibile, ma servono solo a dare un'idea della potenzialità attuale e delle possibilità future di questa tecnica diagnostica.
b) Esempi di indagini cliniche per alcuni organi.
Il cervello. - Nel metabolismo cerebrale i due substrati sono glucosio e ossigeno. La PET permette di misurare il metabolismo cerebrale del glucosio (usando il 18F-desossiglucosio, FDG) e dell'ossigeno (usando l'150) in condizioni sia normali che patologiche. Il desossiglucosio è un analogo del glucosio che viene anch'esso trasportato all'interno della cellula per subire il processo di fosforilazione, ma, non potendo essere utilizzato nella glicolisi, viene allontanato dalla cellula con meccanismi molto più lenti. Ciò permette di studiare il consumo cellulare di glucosio, evitando la sovrapposizione di complessi fenomeni di reimmissione in circolo.
La tav. III, I mostra il metabolismo del 18F-desossiglucosio in un soggetto ‛normale'. È proprio nella neuroanatomia funzionale che sono stati conseguiti i primi importanti risultati da parte del gruppo dell'Università di California a Los Angeles. In condizioni normali con orecchi e occhi aperti, ma senza stimoli particolari, i due emisferi cerebrali mostrano una distribuzione di radioattività (cioè di FDG) simmetrica, leggermente più intensa nella corteccia frontale. Con orecchi e occhi chiusi si registra invece una netta riduzione di FDG nell'emisfero destro, mentre sotto stimolo auditivo si determina un aumento del metabolismo del glucosio nell'intero lobo temporale destro, indipendentemente dal lato auditivo che viene stimolato; e così via per le altre condizioni fisiologiche normali associate a vari stimoli sensoriali e intellettivi.
Il consumo regionale di glucosio in pazienti normali è stato confrontato con quello in pazienti affetti da morbo di Alzheimer o da altre forme di demenza. I pazienti con morbo di Alzheimer presentano indici metabolici molto più bassi degli individui normali della stessa età. La diminuzione del consumo di glucosio è soprattutto marcata al livello corticale; in pazienti affetti da morbo di Huntington, invece, si ha una forte riduzione del consumo di glucosio al livello dello striato e del talamo, mentre il metabolismo corticale è quasi normale.
La tav. IV mostra uno studio del flusso sanguigno cerebrale in un soggetto normale, cui è stato iniettato un singolo ‛bolo' di acqua marcata con 15Q. Nella figura è rappresentata una sezione centrale del cervello riprodotta a intervalli di 3 secondi a partire dall'iniezione. Nel riquadro è rappresentata la curva attività integrale-tempo per la zona di interesse nella regione temporale destra (evidenziata da una circonferenza nella figura) e per tutta la sezione in esame. Il momento dell'arrivo del bolo al cervello è chiaramente evidente. Questo tipo di sensibilità consente un'analisi quantitativa impensabile con i tomografi della prima generazione e apre nuove frontiere allo studio e al trattamento precoce dell'ischemia cerebrale. Lo studio regionale del consumo cerebrale di ossigeno (LCMRO2, acronimo dell'espressione anglosassone Locai Cerebral Metabolic Rate for (O2) deve essere combinato con quello del glucosio (LCMRGlc, Local Cerebral Metabolic Rate for Glucose): è stato dimostrato infatti che appena 24 ore dopo un fatto ischemico cerebrale, mentre l'LCMRGlc rimane normale, si ha una forte riduzione dell'LCMRO2 nella zona ischemica.
Fra le innumerevoli applicazioni in patologia clinica è importante citare gli studi sulla schizofrenia. Poiché questa alterazione patologica non causa cambiamenti morfologici nel cervello, essa non è diagnosticabile con i metodi convenzionali di imaging con raggi X. L'immagine PET dimostra invece delle gravi alterazioni funzionali con diminuzione del flusso sanguigno e un'alterazione del metabolismo del glucosio nelle aree frontali. Un'interessante applicazione della PET si ha anche nella localizzazione dei foci epilettici e nella diagnosi del morbo di Parkinson. Nella tav. V è mostrata l'immagine della sezione centrale del cervello di un soggetto normale, confrontata con quella di un soggetto affetto da morbo di Parkinson. Il tracciante utilizzato è 6-fluorodopa, marcata con 18F, che evidenzia anomalie di funzionamento dei corrispondenti neurotrasmettitori.
È infine importante ricordare le ricerche sui tumori cerebrali (in particolare le indagini sul metabolismo e sul trattamento terapeutico dei gliomi) e gli studi sull'azione terapeutica di nuovi farmaci in campo psichiatrico.
Il cuore. - Oltre a quello delle applicazioni neurologiche, l'altro campo fertile della PET è quello delle applicazioni cardiologiche. La più comune patologia cardiaca nell'adulto è la cardiopatia ischemica, che è dovuta a uno squilibrio tra domanda e apporto di ossigeno in una più o meno ampia regione del miocardio. Per studiare i cambiamenti di volume delle cavità ventricolari si utilizza di solito monossido di carbonio, marcato con 11C (11C-CO), che ha una grande affinità per l'emoglobina, con cui forma 11C-carbossiemoglobina. Per misurare la perfusione cardiaca si utilizza invece ammoniaca marcata con 13N (13N-NH2), che diffonde passivamente nella miocellula, oppure 82Rb, che segue il metabolismo del potassio. È importante sottolineare che, sebbene sostanze come il CO e l'NH3 siano dannose per il nostro organismo, la brevissima emivita dei radioisotopi utilizzati implica un'attività specifica estremamente elevata, per cui si possono avere dosi traccianti già con concentrazioni dell'ordine del picomolare e cioè inferiori ai livelli fisiologici.
Informazioni importanti sul funzionamento del cuore di un individuo sano o malato possono essere ottenute attraverso l'uso del substrato del metabolismo del glucosio: il FDG. Al contrario del cervello, il cuore può utilizzare per la produzione di energia altri substrati immagazzinati, come il glicogeno, i lipidi, ma in particolare gli acidi grassi liberi. Tuttavia, se il lavoro cardiaco e la richiesta energetica sono mantenuti costanti e contemporaneamente la disponibilità di acidi grassi diminuisce, il cuore deve utilizzare altri substrati e preferibilmente fa uso del glucosio. Nella tav. VI, 1 è mostrato il consumo miocardico di FDG in un individuo normale. In presenza di un fatto ischemico regionale, si ha un impedimento delle normali capacità metaboliche. Poiché il flusso sanguigno, e quindi la quantità di ossigeno, diminuisce nella regione ischemica, la beta-ossidazione degli acidi grassi diminuisce e si ha un incremento del consumo del glucosio. Nella tav. VI, 2 è mostrata un'immagine di flusso sanguigno ottenuta con 82Rb; è evidente una zona di ridotta perfusione nella parete anteriore del ventricolo sinistro. Nella tav. VI, 3 infine è mostrata l'immagine della distribuzione di NH3 nella sezione centrale del cuore di un cane cui è stata procurata artificialmente un'ischemia acuta della parete anteriore del ventricolo sinistro mediante bloccaggio della coronaria discendente anteriore. È netta la zona di mancata perfusione in alto a sinistra nel ventricolo sinistro.
La tiroide. - L'imaging morfo-funzionale della tiroide è una delle applicazioni specifiche dei tomografi PET costituiti da camere a fili, che possiedono un'altissima risoluzione spaziale. Presso l'ospedale Cantonale di Ginevra è in corso da vari anni una sperimentazione clinica sull'utilizzo del tomografo HIDAC per studi sulla tiroide. I pazienti esaminati sono in generale in attesa di parziale tiroidectomia o di terapia con radioiodio e sono affetti da diverse forme patologiche: dal gozzo multinodulare, all'adenoma tiroideo, all'ipertiroidismo del morbo di Basedow, ecc. L'immagine PET viene utilizzata per una valutazione accurata del volume della tiroide e per una mappatura dettagliata delle zone di assorbimento dello iodio; solo raramente l'analisi PET ha portato a un cambiamento della diagnosi.
Nella tav. VII è mostrata l'immagine della tiroide di una paziente affetta da morbo di Basedow. L'esame PET è stato effettuato 24 h dopo la somministrazione di ~200 μCi di 124I. I tomografi usati in questi casi producono immagini intrinsecamente tridimensionali, come quella riprodotta nella tav. VII. La presentazione in tre dimensioni è ottenuta in questo caso mediante la tecnica di ‛ombreggiatura' della superficie di contorno dell'organo. Si noti l'estrema precisione con cui sono evidenziati i contorni anatomici della tiroide. Ciò è il risultato dell'elevata risoluzione spaziale del tomografo.
6. Conclusioni.
Indagini cliniche con la tecnica della tomografia a emissione di positoni sono state effettuate negli ultimi dieci anni in centri selezionati di ricerca e hanno permesso lo studio in vivo della fisiologia (specie delle funzioni metaboliche) e della patologia di vari organi, in particolare del cuore e del cervello. Le applicazioni a scopi diagnostici sono ancora allo stadio iniziale, ma il numero delle procedure sta aumentando rapidamente. A ciò ha contribuito indubbiamente lo sviluppo dei rivelatori e dell'elettronica, che ha prodotto un notevole miglioramento delle prestazioni della PET, in termini sia di risoluzione spaziale che di informazioni quantitative. Questo progresso è illustrato nella tav. VIII, 1 e 2, dove sono mostrate le immagini del ‛fantoccio' del cervello ottenibili dai vari tomografi PET nel corso degli ultimi dieci anni.
È particolarmente importante sottolineare che la maggior parte della ricerca clinica è stata finora condotta con tomografi aventi una risoluzione spaziale di circa 1 cm o peggiore, per cui ci si attende un grande balzo in avanti di qualità diagnostica quando le macchine dell'ultima generazione, con risoluzione spaziale di 4-5 mm, avranno raggiunto una piena diffusione a livello clinico. Notevole è stato inoltre l'aumento della capacità di quantificare la concentrazione di radioattività. Si osservi in particolare la tav. VIII, 2: nell'immagine ottenuta con un tomografo del 1984 non compaiono nè falsi negativi nè falsi positivi. Siamo ora vicini a quel 5 ÷ 10% di accuratezza quantitativa, che permetterà alla PET di divenire nei prossimi anni uno dei più potenti strumenti diagnostici per analisi funzionali.
BIBLIOGRAFIA
Anger, H.O., Tomography and other depth-discrimination techniques, in Instrumentation in nuclear medicine, vol. II (a cura di G.J. Hine e J.A. Sorenson), New York 1974, p. 62.
Anger, H.O., Rosenthal, D.J., Scintillation camera and positron camera, in Medical radioisotope scanning, IAEA, Wien 1959, pp. 59-82.
Bateman, J.E., Connolly, J.F., Stephenson, R., Tappern, G.J., Flesher, A.C., The Rutherford laboratory Mark I MWPC positron camera, in ‟Nuclear instruments and methods", 1984, CCXXV, pp. 209-231.
Bohm, C., Eriksson, L., Bergström, M., Positron emission tomography. Basic principles, correction and camera design, in Lecture notes in medical informatics, vol. XXXII, Selected topics in image science (a cura di O. Nalcioglu e Z.H. Cho), Berlin 1984, pp. 84-127.
Browne, E., Firestone, R.B., Table of radioactive isotopes, (a cura di V.S. Shirley), New York 1986.
Brownell, G.L., Burham, C.A., Chesler, D.A., Bradshaw, J,. Kaufman, D., Weise, S., PCR-I-high resolution positron tomograph using analog coding, in ‟IEEE transactions on medical imaging", 1984, MI-III, p. 10-16.
Brownell, G.L., Correia, A., Zamenhof, R.G., Positron instrumentation, in Recent advances in nuclear medicine, vol. V (a cura di J.H. Lawrence e T.F. Budinger), New York 1978, pp. 1-50.
Brownell, G.L., Sweet, W.H., Localization of brain tumours with positron emitters, in ‟Nucleonics", 1953, XI, pp. 40-45.
Budinger, T.F., Time of flight positron emission tomography: status relative to conventional PET, in ‟Journal of nuclear medicine", 1983, XXIV, pp. 73-78.
Cho, Z.H., Farukhi, S., Bismuth germanate as a potential scintillation detector in positron cameras, in ‟Journal of nuclear medicine", 1977, XVIII, pp. 840-844.
Cormack, A.M., Representation of a function by its line integrals, with some radiological applications, in ‟Journal of applied physics", 1963, XXXIV, pp. 2722-2727.
Crocker Nuclear Laboratory,??? Annual report 1984-1985, Davis, Cal., 1985.
Dagher, A., Thompson, C.J., Real-time data rebinning in PET to obtain uniformly sampled projections, in ‟IEEE transactions on nuclear science", 1985, NS-XXXII, pp. 811-817.
Del Guerra, A., Conti, M., Nelson, W.R., Porinelli, R., Rizzo, C., 3-D imaging with a 3-D PET: a complete simulation of the HISPET tomograph, in Proceedings of the international workshop on physics and engineering of computerized multidimensional imaging and processing (a cura di T.F. Budinger, O. Nalcioglu e Z.H. Cho), Bellingham, Wash., 1986, pp. 34-41.
Del Guerra, A., Lim, C.B., Lum, G.K., Ortendahl, D., Pérez-Méndez, V., Medical positron imaging with a dense drift space MWPC, in ‟IEEE transactions on medical imaging", 1982, TMI-I, pp. 4-11.
Derenzo, S.E., Precision measurements of annihilation point spread distributions for medically important positron emitters, in Positron annihilation (a cura di R.R. Hasiguti e K. Fujiwara), Sendai, Japan, 1979, pp. 819-824.
Derenzo, S.E., Recent developments in positron emissiontomography (PET) instrumentation, in Proceedings of the international workshop on physics and engineering of computerized multdiimensional imaging and processing (a cura di T.F. Budinger, O. Nalcioglu e Z.H. Cho), Bellingham, Wash., 1986, pp. 232-243.
Derenzo, S.E., Budinger, T.F., Huesman, R.H., Cahoon, J.L., Vuletich, T., Imaging properties of a positron tomograph with 280 BGO crystals, in ‟IEEE transactions on nuclear science", 1981, NS-XXVIII, pp. 81-89.
Engel, J. Jr., Kuhl, D.E., Phelps, M.E., Crandall, P.H., Comparative localization of the epileptic foci in partial epilepsyby PET, in ‟Annals of neurology", 1982, XII, pp. 529-537.
Eriksson, L., Bohm, C., Kesselberg, M., Blomqvist, G., Litton, J,. Widen, L., Bergström, M., Ericson, K., Greitz, T., A four ring positron camera system for emission tomography of the brain, in ‟IEEE transactions on nuclear science", 1982, NS-XXIX, pp. 539-543.
Frackowiack, R.S.J., Lenzi, G.L., Jones, T., Heather, J.D., Quantitative measurement of cerebral blood flood and oxygen metabolism in man using O-15 and positron emission tomography: theory, procedure nd normal values, in ‟Journal of computed assisted tomography", 1980, IV, pp. 727-736.
Frackowiack, R.S.J., Pozzilli, C., legg, N.J., Duboulay, G.H., Marshall, J., Lenzi, G.L., Jones, T., Regional cerebral oxygen supply and utilisation in dementia: a clinical and physiological study with oxygen-15 and positron tomography, in ‟Brain", 1981, CIV, pp. 753-778.
Heiss, W.D., Phelps, M.E. (a cura di), Positron emission tomography of the brain, Berlin 1983.
Herman, G.T., Image reconstruction from projections. The fundamentals of computerized tomography, New York 1980.
Hoffman, E.J., Dahlbom, M., Ricci, A.R., Wenberg, I.N., Examination of the role of detection systems in quantitation and image quality in PET, in ‟IEEE transactions on nuclear science", 1986, NS-XXXIII, pp. 420-424.
Hoffman, E.J., Huang, S.C., Phelps, M.E., Quantitation in positron emission computed tomography: 1. Effect of object size, in ‟Journal of computed assisted tomography", 1979, III, pp. 299-308.
Hoffman, E.J., Huang, S.C., PHelps, M.E., Quantitation in positron computed emissiontomography: 4. Effect of accidental coincidences, in ‟Journal of computed assisted tomography", 1981, V, pp. 391-400.
Hoffman, E.J., Phelps, M.E., Huang, S.C., Collard, E.P., Bidaut, L.M., Schwab, R.L., Ricci, A.R., Dynamic gated and high resolution imaging with ECAT III, in ‟IEEE transactions on nuclear science", 1986, NS-XXXIII, pp. 452-455.
Hoffman, E.J., Phelps, M.E., Huang, S.C., Kuhl, D.E., Crabtree, M., Burke, M., Burgiss, S., Keyser, R., Highfill, R., Williams, C., A new tomograph for quantitative positron emission computed tomography of the brain, in ‟IEEE transactions on nuclear science", 1981, NS-XXVIII, pp. 99-103.
Hoffman, E.J., Phelps, M.E., Huang, S.C., Kuhl, D.E., Crabtree, M., Burke, M., Burgiss, S., Keyser, R., Highfill, R., Williams, C., A new tomograph for quantitative positron emission computed tomography of the brain, in ‟IEEE transctions on nuclear science", 1981, NS-XXVIII, pp. 99-103.
Hoffman, E.J., Phelps, M.E., Huang, S.C., Plummer, D., Kuhl, D., Evaluating the performance of multiplane positron tomographs designed for brain imaging, in ‟IEEE transactions on nuclear science", 1982, NS-XXIX, pp. 469-473.
Hoffman, E.J., Ricci, A.R., Van der Steel, L., Phelps, M.E., ECAT III: basic design considreations, in ‟IEEE transactions on nuclear science" 1983, NS-XXX, pp. 729-733.
Hounsfield, G.N., A method and apparatus for examination of a body by radiation such as X or gamma radiation, Patent specification 1283915, The patent office, London 1972.
Huang, S.C., Hoffman, E.J., Phelps, M.E., Kuhl, D.E., Quantitation in positron emission tomography: 2. Effects of inaccurate attenuation correction, in ‟Journal of computed assisted tomography", 1979, III, pp. 804-814.
Huang, S.C., Hoffman, E.J., Phelps, M.E., Kuhl, D.E., Quantitation in positronemission tomography: 3. Effect of sampling, in ‟Journal of computed assisted tomography", 1979, IV, pp. 819-826.
Jeavons, A., Hood, K., Herlin, G., Parkamn, C., Townsend, D., Magnanini, R., Frey, P., Donath, A., The high density avalanche chamber for positron emission tomography, in ‟IEEEE transactions on nuclear science", 1983, NS-XXX, pp. 640-645.
Jones, T., Positron emission tomography, in ‟British medical bulletin", 1980, XXXVI, pp. 231-235.
Jones, T., The application of positron emission tomography, in Computed emission tomography (a cura di P.J. Ell e B.L. Holman), Oxford 1982, pp. 211-239.
Karp, J.S., Muehllehner, G., Performance of a position sensitive scintillation detector, in ‟Physics in medicine and biology", 1985, XXX, pp. 643-655.
Kuhl, D.E., Edwards, R.Q., Image separation radioisotope scanning, in ‟Radiology", 1963, LXXX, pp. 653-662.
Kuhl, D.E., Phelps, M.E., Markham, C.H., Meiter, E.J., Riege, W.H., Winter, J., Cerebral metabolism and atrophy in Huntington's disease determined by FDG and CT scan, in ‟Annals of neurology", 1982, XII, pp. 425-434.
Lenzi, G.L., Frackowiack, R.S.J., Jones, T., Cerebral oxygen metabolism and blood flow in human cerebral ischaemia infarction, in ‟Journal of cerebral blood flow and metabolism", 1982, II, pp. 321-335.
Mazziotta, J.C., Phelps, M.E., Plummer, D., Kuhl, D.E., Quantitation in positron computed tomography: 5. Physical-anatomical effects, in ‟Journal of computed assisted tomography", 1981, V, pp. 734-743.
Mullani, N.A., Gaeta, J., Yerian, K., Wong, W.H., Hartz, R. K., Philippe, E.A., Bristow, D., Gould, K.L., Dynamic imaging with high resolution time-of-flight PET camera: TOFPET I, in ‟IEEE transactions on nuclear science", 1984, NS-XXXI, pp. 609-613.
Oldendorf, W.H., Isolated flying spot detection of radiodensity discontinuities: displaying the internal structural pattern of a complex-object, in ‟IRE transactions on bio-medical electronics", 1961, BME-VIII, pp. 68-72.
Phelps, M.E., Hoffman, E.J., Huang, S.C., Kuhl, D.E., ECAT - a new computerized tomographic imaging system for positron emitting radiopharmaceuticals, in ‟Journal of nuclear medicine", 1978, XIX, pp. 635-647.
Phelps, M.E., Hoffman, E.J., Huang, S.C., Kuhl, D.E., Positron computed tomography: present and future design alternatives, in Medical radionuclide imaging, vol. I, IAEA, Wien 1980, pp. 199-230.
Phelps, M.E., Huang, S.C., Hoffman, E.J., Kuhl, D.E., Validation of tomographic mesaurements of cerebral blood volume with C-11 labelled carboxyhaemoglobin, in ‟Journal of nuclear medicine", 1979, XX, pp. 328-334.
Phelps, M.E., Huang, S.C., Hoffman, E.J., Selin, C., Sokoloff, L., Kuhl, D.E., Tomographic measurement of local cerebral glucose metabolism rate in humans with (F-18) 2-fluoro, 2-deoxy-D-glucose: validation of method, in ‟Annals of neurology", 1979, VI, pp. 371-388.
Phelps, M.E., Mazziotta, J.C., Huang, S.C., Study of cerebral function with positron computed tomography, in ‟Journal of cerebral blood flow and metabolism", 1982, II, pp. 113-162.
Rankowitz, S., Robertson, J.S., Higinbotham, W.A., Niell, A. M., Positron scanner for locating brain tumours, in ‟IRE International Convention Record", 1962, IX, pp. 49-56.
Sauli, F., Principles of operation of multiwire proportional and drift chambers, CERN report 77-09, Geneve 1977.
Sauli, F., Le camere proporzionali multifli: un potente strumento per la ricerca applicata, in ‟Il nuovo saggiatore", 1986, II, pp. 26-42.
Sweet, W.H., Uses of nuclear disintegration in diagnosis and treatment of brain tumours, in ‟New England journal of medicine", 1957, CCXLV, p. 845.
Ter-Pogossian, M.M. (a cura di), Reconstruction tomography in diagnostic radiology and nuclear medicine, Baltimora 1977.
Ter-Pogossian, M. M., Positron emission tomography (PET), in Three-dimensional biomedical imging, vol. II (a cura di R. A. Robb), Boca Raton, Fla. 1985, pp. 41-55.
Thompson, C.J., Dagher, A., Meyer, E., Evans, A.C., Imaging performance of a dynamic positron emission tomograph: POSITOME IIIp, in ‟IEEE transactions on medical imaging", 1986, MI-V, pp. 183-198.
Thompson, C.J., Yamamoto, Y.L., Meyer, E., Positome II: a high efficiency positron imaging system for dynamic brain studies, in ‟IEEE transactions on nuclear science", 1979, NS-XXVI, pp. 585-589.
Townsend, O., Frey, P., Donach, A., Volume measurement in vivo using positron tomography, in ‟Nuclear instruments and methods", 1984, CCXXI, pp. 105-112.
Tucker, W.D., Radioisotope cows, in ‟Journal of nuclear medicine", 1960, I, p. 60.
Williams, C.W., Crabtree, M.C., Burgiss, S.G., Design and performance characteristics of a positron emission computed axial tomograph ECAT-II, in ‟IEEE transactions on nuclear science", 1979, NS-XXVI, pp. 619-627.
Williams, E.D. (a cura di), An introduction to emission computed tomography, The Institute of Physical Sciences in Medicine. Report n. 44, London 1985.
Wrenn, E.R., Good, M.L., Handler, P., The use of positron emitting radioisotopes for the localization of brain tumours, in ‟Science", 1971, CXIII, pp. 525---527.
Yamamoto, Y., Ficke, D.C., Ter-Pogossian, M.M., Performance study of PET VI, a positron computed tomograph with 288 Cesium fluoride detectors, in ‟IEEE transactions on nuclear science", 1982, NS-XXIX, pp. 529-533.
Yamamoto, Y.L., Thompson, C.J., Diksic, M., Meyer, M., Fendez, W.H., Positron emission tomography, in ‟Journal of radiation physics and chemistry", 1984, XXIV, pp. 385-403.