tomografia computerizzata
tomografia computerizzata
Tecnica radiodiagnostica strumentale di imaging (in sigla TC), ampiamente utilizzata nella diagnosi di patologie cerebrali e in alcuni aspetti funzionali a esse correlate (➔ imaging cerebrale, diagnosi e ricerca). Tecnica. Rispetto alle immagini radiologiche classiche, le immagini TC sono superiori per qualità e dettaglio, a strato nettamente più sottile, e possono essere sottoposte a elaborazioni computerizzate, con cui è possibile visualizzare il distretto anatomico in esame secondo proiezioni biplanari o tridimensionali. Inizialmente realizzate con un classico corredo tubo radiante-detettore, dal 1998 sono state sviluppate apparecchiature che hanno sfruttato accorgimenti tecnologici tipici delle cosiddette TC di terza generazione, caratterizzate da detettori ad arco che ruotano solidali al tubo radiogeno posizionato al suo opposto, con il lettino del paziente che si muove perpendicolarmente a esso: sono le cosiddette TC spirale e, a partire dagli anni Novanta del 20° sec., le TC a detettori multipli (MDCT, MultiDetector Computed Tomography, o MSCT, MultiSlice Computed Tomography). Tali apparecchiature hanno consentito di passare da TC ad acquisizione di singole sezioni anatomiche sul piano assiale a vere e proprie tecniche di acquisizione volumetrica. L’aspetto caratterizzante gli apparecchi MDCT è la fila parallela di elementi fotosensibili, la cui funzione è captare il raggio radiante che attraversa la sezione anatomica in studio. Essi sono costituiti da una corona i cui elementi, distribuiti per un numero di file da 8, 16 sino a 40, sono connessi a singoli convertitori analogicodigitali: il tipo di apparecchiatura (TC multislice- 4, -16, -32 o -64) deriva dal numero di convertitori analogico-digitali in grado di essere messo simultaneamente in azione nel corso dell’emissione di un singolo irraggiamento, per singola rotazione del tubo radiante. La metodica consente di acquisire dati relativi a un intero volume del distretto anatomico in esame secondo la combinazione di due opzioni: la risoluzione spaziale, ossia la possibilità di visualizzare il distretto anatomico in singole immagini di spessore estremamente sottile, nell’ordine di decimi di millimetro; il tempo di acquisizione, che può essere ridotto al minimo, e l’elevata risoluzione temporale, traducibile in centinaia d’immagini in pochissimi secondi, che consente di studiare distretti anatomici estremamente estesi, come gli arti inferiori, oppure seguire con un’elevata risoluzione temporale il passaggio di un mezzo di contrasto (MDC), per studi angiografici (angio-TC, o CTA) o per la misurazione della perfusione cerebrale (CT perfusion). Parametri indicativi delle prestazioni delle singole macchine MDCT sono: il raw thickness, che indica lo spessore delle file di detettori per scansione; il raw scans, ossia lo spessore delle scansioni brute acquisite, che sono scarsamente diagnostiche per l’elevato rumore di fondo ma da cui è possibile effettuare elaborazioni elettroniche ad altissima risoluzione anatomica. Il fine ultimo delle moderne apparecchiature per immagini è di far sì che l’unità minima di visualizzazione di ogni immagine, il pixel, abbia struttura cubica per consentire di elaborare immagini su diversi piani dello spazio con identica efficacia, senza la necessità di acquisirli singolarmente con conseguente aggravio dei tempi di esame e maggior esposizione radiante del paziente.
TC dei distretti encefalici e cranici
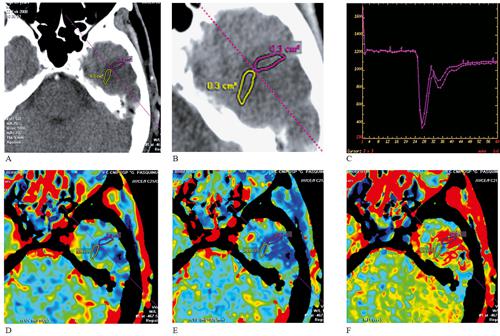
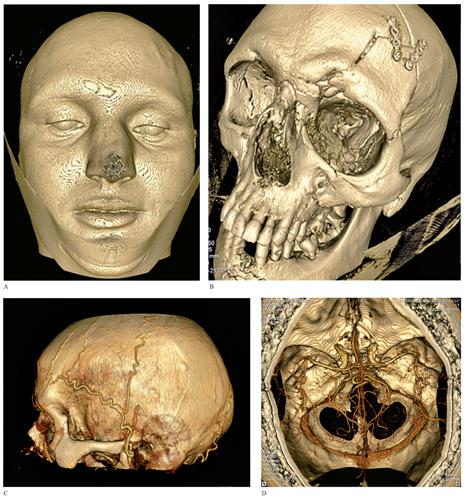
Le strutture encefaliche e craniche in senso generale sono oggetto di studio con le moderne apparecchiature MDCT con duplice vantaggio: la rapida acquisizione delle immagini, che consente di ridurre al minimo il disagio per i pazienti poco collaboranti, come i pazienti in fase ictale acuta con stato di coscienza alterato o i bambini molto piccoli; la possibilità di elaborare con algoritmi matematici opportunamente dedicati la mole d’immagini acquisita, cosi da ottenere immagini a elevata accuratezza anatomica, consentendo di rappresentare il distretto dallo strato cutaneo superficiale a quello muscolare e osseo, sino al distretto arterioso intra- ed extracranico e al cervello, tutto con i dati relativi a una singola acquisizione. Inoltre, la rapidità di acquisizione di immagini senza esposizioni radianti particolarmente onerose per il paziente, ha fatto si che la perfusione cerebrale diventasse elemento di studio specifico della TC (CT perfusion). Questa consiste nell’acquisire ripetutamente in tempi rapidi un determinato volume anatomico, durante un’infusione endovena di un bolo di mezzo di contrasto piccolo ma con flusso estremamente elevato, che agisce come un tracciante poiché segue le fasi del circolo ematico, che cosi possono essere registrate e rappresentate in grafico o con mappe. Rispetto allo studio della perfusione con la RM vi è il vantaggio di avvalersi di misurazioni con parametri assoluti, poiché la densità dei pixel è una misura assoluta nella TC, mentre quelli della RM risentono moltissimo delle variazioni naturali del segnale. Le immagini di perfusione rappresentano dinamicamente il microcircolo ematico cerebrale con indicatori specifici, come il volume ematico (CBV, Cerebral Blood Volume) e il flusso ematico (CBF, Cerebral Blood Flow), le cui variazioni possono essere patognomoniche in caso di ischemia arteriosa: in fase iperacuta è fondamentale identificare il tessuto cerebrale infartuato vero e proprio da quello che conserva ancora un margine di recupero (zona di penombra). Su quest’ultimo possono agire le moderne terapie di trombolisi: la corretta identificazione di tale distretto mediante CT perfusion consente di mirare il trattamento medico sistemico o endoarterioso responsabile dell’ischemia, il distretto encefalico e quindi recuperare il danno neurologico. La CT perfusion è applicata anche nell’ambito della diagnostica differenziale tra tumori cerebrali a diversa aggressività biologica: in generale quelli maggiormente maligni accompagnano il loro accrescimento con lo sviluppo di una serie di strutture vascolari patologiche. La valutazione di alcuni parametri di perfusione, in particolare del CBV, è in grado di identificare elementi suggestivi di tale neovascolarizzazione, conferendo alla lesione il carattere di malignità è aggressività. Alcuni moderni protocolli di chemioterapia in campo oncologico basano il loro principio di azione proprio sull’interferenza con quei fattori che favoriscono il processo di vascolarizzazione patologica dei tumori. A livello cerebrale è possibile studiare le risposte di tumori a terapie mirate proprio misurando con la CT perfusion il grado di neovascolarizzazione locale. Sullo stesso principio si basa l’applicazione della CT perfusion nella diagnosi differenziale tra radionecrosi e ripresa locale di tumore: la perfusione vascolare del tessuto tumorale recidivante è spesso identificabile solo con tale metodica, rendendo completamente differente l’iter terapeutico e, com’è possibile immaginare, la prognosi del paziente.