terapia biologica
terapia biologica
Insieme di agenti che mimano o contrastano l’azione di sostanze naturali implicate nella trasmissione di segnali essenziali per la vita delle cellule attraverso l’azione mirata (target therapy) su singole strutture (recettori, proteine, sequenze di DNA) coinvolte nei processi biologici di crescita cellulare, o su classi di molecole deputate alla risposta immunitaria. La t. b. costituisce una frontiera dell’intervento terapeutico in patologie quali tumori, artrite reumatoide, malattie croniche intestinali (per es. la malattia di Crohn ➔ Crohn, Burrill Bernard).
La terapia biologica in oncologia
La selettività dell’azione della terapia biologica, che si svolge principalmente sulle cellule tumorali e assai meno sulle cellule sane, consente di aumentarne l’efficacia e di ridurne gli effetti collaterali con conseguente miglioramento della qualità della vita dei pazienti. Gli agenti comunemente inclusi nella terapia biologica in oncologia sono: anticorpi monoclonali (MoAbs); fattori di crescita per progenitori emopoietici delle cellule del sangue; inibitori della crescita tumorale; inibitori della proliferazione vascolare indotta da tumore (farmaci anti-angiogenici); modificatori della risposta biologica al tumore (interferoni e interleuchine). Le modalità terapeutiche riguardano solitamente l’immunoterapia con vaccini e la terapia genica.
I farmaci biologici in oncologia
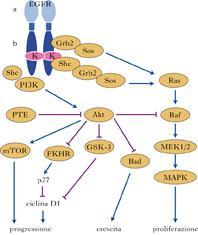
I cosiddetti farmaci biologici sono il risultato dei progressi nel campo delle biotecnologie e della ricerca che hanno portato alla conoscenza dei meccanismi che regolano la trasformazione di cellule umane sane in cellule maligne. Un ruolo dominante, nello sviluppo di una terapia molecolare contro il cancro, è assunto dall’inibizione dei segnali di crescita tumorale. Generalmente le cellule normali hanno bisogno di segnali di crescita per passare da uno stato di quiescenza a uno di proliferazione attiva. Questi segnali vengono trasmessi alla cellula attraverso recettori transmembrana che legano classi distinte di molecole che trasducono (ossia, in questo caso, attivano) i segnali stessi; tali segnali sono costituiti da fattori di crescita diffusibili, da componenti della matrice extracellulare e da molecole di adesione/interazione tra cellula e cellula. Molti degli oncogeni tumorali agiscono simulando normali segnali di crescita. Si può concludere che le cellule tumorali autogenerano molti dei loro segnali di crescita, e in questo modo riducono la dipendenza dagli stimoli provenienti dal microambiente. I recettori di superficie che trasducono i segnali stimolatori all’interno della cellula sono essi stessi bersaglio di deregolazione durante la patogenesi tumorale.Sono stati sviluppati un numero di nuovi agenti terapeutici per il trattamento del cancro, che identificano come bersaglio gli elementi chiave delle cascate metaboliche dei segnali, compresi i recettori dei fattori di crescita epidermici (EGFRs), i recettori ErbB, i recettori tirosinchinasici, altre chinasi, i geni ras, PI3/Akt, e la chinasi delle BRC-ABL.
L’azione biologica sui recettori dell’EGFR
Molti studi sperimentali e clinici comprovano l’opinione che l’EGFR sia un importante obiettivo per la terapia anticancro. Due sono gli approcci terapeutici che hanno dato risultati molto promettenti e che oggi sono utilizzati negli studi clinici per inibire l’EGFR: gli anticorpi monoclonali (Mabs) e piccole molecole inibitorie dell’attività enzimatica della tirosinchinasi dell’EGFR. I Mabs, in genere, vengono orientati verso il dominio esterno dell’EGFR al fine di bloccare l’azione della molecola che si lega al recettore e quindi l’attivazione di quest’ultimo. Gli inibitori della chinasi della tirosina (TKIs) ostacolano reazioni biochimiche quali l’autofosforilazione del dominio intracellulare della chinasi della tirosina per l’EGFR e quindi l’attivazione di segnali proliferativi intracellulari. L’uso del trastuzumab, un anticorpo monoclonale diretto al ricettore ErbB-2, nel trattamento del cancro della mammella, è ben noto. Gli anticorpi diretti all’antigene delle cellule B-CD20 hanno notevole attività clinica in pazienti affetti da linfomi a basso e alto grado di malignità. Diversi farmaci inibitori della tirosinchinasi (TKIs) sono stati sintetizzati e valutati per una potenziale attività pre-clinica. Queste molecole sono generalmente antagonisti reversibili che legano il dominio catalitico intracellulare della tirosinchinasi. L’effetto principale di questi agenti è volto a ritardare la crescita, anche se alcuni farmaci provocano comunque una regressione del tumore. In questo contesto, la molecola di elezione tra tutti questi farmaci può essere considerata l’imatinib mesilato, un inibitore selettivo della chinasi intracellulare ABL, dell’oncoproteina nata dalla fusione chimerica BCR-ABL tipica della leucemia cronica mieloide, del recettore transmembrana c-KIT e del Platelet-Derived Growth Factor Receptors (PDGF-R). Esso inibisce l’attività della tirosinchinasi del recettore c-KIT nelle cellule dei tumori stromali gastrointestinali.
L’azione biologica sulla cellula del vaso endoteliale
La cellula del vaso endoteliale è diventata un obiettivo importante per la terapia del cancro e sono stati sviluppati molti inibitori dell’angiogenesi con funzione di agenti terapeutici anticancro. Diversi Mabs e TKIs attivi contro il fattore di crescita vascolare VEGF o i suoi recettori sono stati recentemente approvati per la terapia dei tumori del colon-retto, del polmone, della mammella e del rene, nella maggior parte dei casi in associazione a farmaci chemioterapici. Bevacizumab è un anticorpo monoclonale diretto contro il VEGF ed è stato il primo farmacoantiangiogenico approvato nel trattamento dei tumori solidi. È oggi (2009) approvato nel trattamento del tumore del colon metastatico, del tumore polmonare metastatico e del carcinoma mammario metastatico. Sunitinib è un TKI orale, inibitore selettivo di diverse tirosinchinasi recettoriali per il VEGF. Sorafenib è una piccola molecola che inibisce selettivamente la Raf chinasi, il PDGF, il recettore per il VEGF 2-3 e il c-KIT.