Tecnologie elettrochimiche
Tecnologie elettrochimiche
Le tecnologie elettrochimiche si basano sull’uso di elettrolizzatori costituiti, nella loro essenza, da una cella formata da due elettrodi, uno positivo e uno negativo, separati da una soluzione elettrolitica con trasporto esclusivamente di tipo ionico. Gli elettrolizzatori sono alimentati dall’esterno da un generatore di corrente, in modo da far decorrere nella cella la reazione chimica desiderata. Quindi, in sintesi, gli elettrolizzatori consentono di ottenere prodotti chimici a spese di un consumo di elettricità. La produzione di prodotti strategici è rappresentativa dell’importanza industriale di queste tecnologie. Esemplificativo è il caso del processo cloro-soda, il cui volume produttivo è dell’ordine di vari milioni di tonnellate per anno e che richiede un’estensione di elettrodi stimata in qualche chilometro quadrato e un consumo di elettricità pari a quella fornita da almeno dieci grandi centrali elettriche. Questi imponenti investimenti sono giustificati dalla vasta diffusione dei materiali d’uso sia come prodotti finali sia come intermedi. Ed è appunto dalla scala di queste produzioni che emerge l’importanza rivestita dalle tecnologie elettrochimiche nello sviluppo industriale.
Altrettanto significativo è l’esempio della estrazione dell’alluminio, la cui industria è seconda d’importanza solo a quella del cloro-soda. La diffusione del metallo è dovuta alle caratteristiche di resistenza e di leggerezza che ne favoriscono l’uso in vari comparti industriali. Inoltre, l’alluminio può essere trattato per prevenire la corrosione, e di qui il suo uso per infissi o manufatti di largo consumo.
Di seguito saranno illustrate in dettaglio le varie tipologie di elettrolizzatori e le condizioni che ne regolano il funzionamento. Saranno quindi valutate le figure di merito che consentono di portare all’ottimizzazione del processo in termini di costo ed efficienza e verrà anche messa l’enfasi sul ruolo della geometria delle celle per lo sviluppo appropriato del processo desiderato. Inoltre, verranno illustrati i processi industrialmente più rilevanti – come i già citati cloro-soda e l’estrazione dell’alluminio – con particolare attenzione alle loro caratteristiche tecniche, senza però trascurare gli aspetti economici e ambientali.
Infine, saranno considerati processi di minor impatto industriale, ma pur sempre di rilevante interesse tecnologico, come il processo di elettrolisi dell’acqua, che attualmente assume un particolare interesse in vista del prospettato uso di idrogeno per l’economia energetica del futuro.
Elettrolizzatori
Le tecnologie elettrochimiche consistono nella progettazione e nella conduzione di celle elettrochimiche per l’avvio di processi di interesse industriale. A seconda della natura delle trasformazioni che in esse si verificano, le celle elettrochimiche possono essere classificate in elettrolizzatori e in celle galvaniche. Nei primi l’energia elettrica, fornita dall’esterno, viene trasformata in energia chimica con l’evoluzione del processo desiderato.
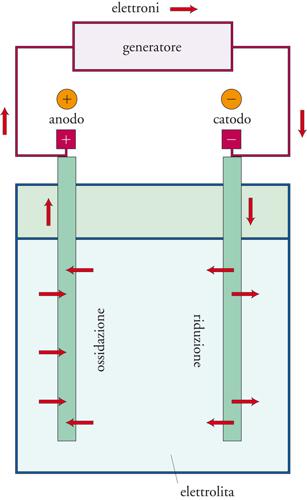
La fig. 2 mostra, in maniera schematica, la struttura di un elettrolizzatore: una cella elettrochimica formata da due elettrodi (per es., metallici) immersi in un elettrolita (per es., una soluzione acquosa di cloruro di sodio, NaCl), a cui è applicato dall’esterno un generatore di corrente. Gli elettroni fluiscono dal terminale negativo del generatore all’elettrodo negativo (catodo) dove promuovono la reazione di riduzione di una specie ionica, come nel caso della riduzione degli ioni idrogeno dell’acqua:
[1] 2H2O + 2e− → H2 + 2OH−.
All’elettrodo opposto positivo (anodo) si verifica una reazione di ossidazione, come l’ossidazione degli ioni cloro a cloro gassoso:
[2] 2Cl− → Cl2 + 2e−.
Il circuito è chiuso dal trasporto di carica da parte degli ioni nell’elettrolita in modo da pervenire al processo totale desiderato, quale, per esempio, quello che comporta la trasformazione di cloruro di sodio con la formazione di soda e cloro:
[3] 2NaCl + H2O → NaOH + Cl2 + (1/2)H2.
L’interesse industriale richiede l’ottimizzazione del processo in termini di costo ed efficienza. A tal fine devono venir rispettate alcune figure di merito. Le più significative sono elencate qui di seguito.
La resa del materiale, ϑ, costituisce la massima quantità di prodotto (per es., NaOH) che si ottiene da una mole di reagente (per es., NaCl), tenendo conto della stechiometria della reazione (per es., reazione [1]):
[4] ϑ= moli di reagente convertito
in prodotto/moli di reagente consumato %.
L’efficienza di corrente, ε, rappresenta la carica consumata nel processo faradico per dare il prodotto rispetto alla carica totale consumata:
[5] ε = carica usata per formare
il prodotto/carica totale %.
Da notare che un valore di ε inferiore al 100% indica il verificarsi di reazioni concomitanti non desiderate (parassite) come quelle derivanti dalla decomposizione dell’acqua (sviluppo di idrogeno e/o di ossigeno). Da notare, inoltre, che un’efficienza di corrente ε inferiore al 100% si riflette in una resa di materiale ϑ inferiore al 100%.
Il consumo energetico, ϕ, rappresenta il lavoro elettrico speso per mole o per kg di prodotto:
[6] ϕM = consumo energetico molare = − nFV/ϑ
[7] ϕkg = consumo energetico specifico = −nFV/ϑM
e si esprime rispettivamente in kWh∙mol−1∙e kWh∙kg−1. In queste relazioni M è il peso molecolare, n il numero di elettroni coinvolti nel processo (per es., 2 nel caso del processo [3]), F la costante di Faraday (96.498 coulomb) e V è la tensione di cella, a sua volta costituita dalla somma di termini:
[8] V = E + (ηa + ηc + iR)
dove E è il potenziale termodinamico associato alla reazione di cella ed espresso dalla somma del potenziale dell’elettrodo positivo (anodo) e del potenziale negativo (anodo). In condizioni reali, cioè a seguito del passaggio della corrente, la tensione di cella aumenta rispetto al valore termodinamico per la somma dei termini ηa + ηc + iR (sovratensioni). Come si rileva dalle [6] e [7], il consumo energetico aumenta all’aumentare di V e pertanto, le sovratensioni influiscono negativamente sull’economia del processo. Le sovratensioni ηa e ηc sono legate alle cinetiche dei processi anodici e catodici e dipendono dalle condizioni del processo di elettrolisi – tipo di elettrolita, pH, temperatura – e, soprattutto, dal materiale che costituisce gli elettrodi e che deve favorire, con azione catalizzante, solo la reazione di interesse. Per esempio, nel caso citato nella [2], il materiale elettrodico deve essere scelto in modo da catalizzare la reazione voluta, vale a dire l’ossidazione del cloro, inibendo le reazioni concorrenti, quali l’ossidazione dell’acqua con sviluppo di ossigeno. Il termine iR è la sovratensione ohmica, vale a dire la caduta di tensione sulla resistenza R di cella, principalmente riconducibile alla resistenza dell’elettrolita, Re. Poiché Re è legata alla costante di cella
[9] R = ϱl /s
dove ϱ è la resistenza specifica della soluzione elettrolitica, l il suo spessore (distanza tra gli elettrodi) e s la superficie (area degli elettrodi), la sovratensione ohmica può essere ridotta utilizzando elettroliti a bassa resistività (aumentando la concentrazione delle soluzioni), riducendo al massimo la distanza tra gli elettrodi (interponendo tra essi un sottile separatore per evitarne il contatto) e aumentando la superficie degli elettrodi. Quest’ultima condizione può essere soddisfatta con la scelta di elettrodi a morfologia altamente porosa, in cui la superficie attiva può eccedere quella geometrica anche di diversi ordini di grandezza.
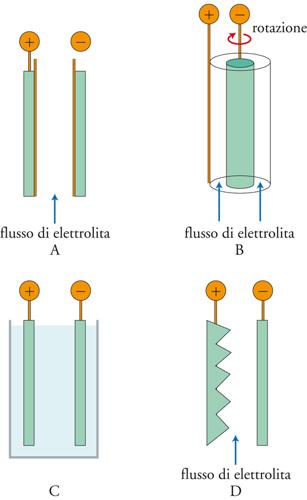
La geometria di cella è un altro fattore importante ai fini dell’ottimizzazione del processo per assicurare un’alta superficie attiva per unità di volume. La fig. 3 mostra alcuni esempi schematici che prevedono geometrie a elettrodi piani paralleli, concentrici con rotazione, piani in vasca e con superfici non parallele. La scelta della geometria più opportuna dipende dal tipo di processo di interesse.
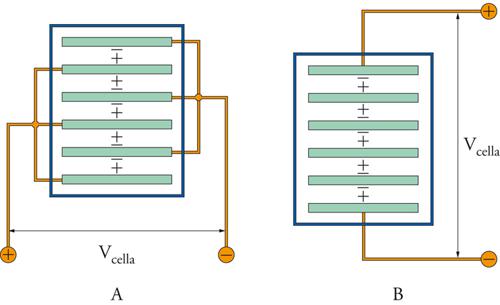
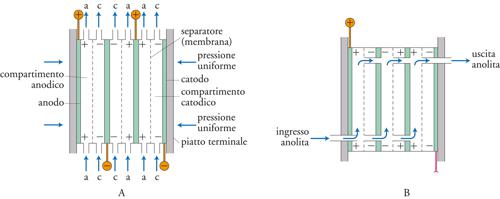
Risulta importante, per assicurare le condizioni ottimali per il processo, anche la disposizione, in serie o in parallelo, con cui le celle sono collegate tra loro. Sono previsti due sistemi di connessione al generatore esterno, uno monopolare e l’altro bipolare (fig. 4). Si nota come nella connessione monopolare vi sia un contatto elettrico su ciascun elettrodo con tensione di cella applicata tra ciascun anodo e catodo, che si alternano con entrambe le facce con la stessa polarità. Connessioni di questo tipo richiedono basse tensioni ed elevate correnti. Le configurazioni bipolari richiedono solo due connessioni elettriche agli elettrodi terminali della catena. La tensione è approssimativamente pari alla somma delle celle singole e le facce opposte di ciascun elettrodo hanno polarità differenti. Connessioni di questo tipo richiedono alte tensioni e basse correnti.
Infine, risulta importante anche la scelta del disegno delle celle elettrochimiche. La cella detta ‘a vasca’ è particolarmente adatta per processi che prevedono condizioni di esercizio aggressive o lo sviluppo di prodotti gassosi. La fig. 5, per esempio, mostra lo schema della cella utilizzata per l’elettrolisi dell’acqua in cui gli elettrodi sono posti verticalmente per favorire lo sviluppo dei gas.
Le celle a flusso a elettrodi piani in genere hanno una costruzione a piatti assemblati alla maniera di filtropressa dove gli elettrodi di tipo verticale, i telai isolati e le eventuali membrane o separatori sono pezzi singoli che vengono montati con opportune guarnizioni: si possono avere, così, fino a 100 celle in una singola unità. La fig. 6 mostra lo schema delle configurazioni monopolari e bipolari di questo tipo di configurazione di cella.
Processo cloro-soda
Il processo cloro-soda è un processo fondamentale data la rilevanza dei suoi prodotti, il cloro e l’idrossido di sodio, comunemente chiamato soda, che trovano impiego in vari settori produttivi. Il cloro e l’ipoclorito di sodio sono gli agenti più efficaci e più usati per la disinfezione dell’acqua per uso potabile. Inoltre, il cloro è usato per la preparazione di solventi clorurati, come il cloruro di metilene, il percloroetilene, la trielina e il metilcloroformio; sebbene il loro uso sia in discussione per la tossicità, questi solventi trovano ancora impiego per sgrassare i metalli, nella lavatura a secco e per la preparazione di composti farmaceutici. Importante è il ruolo del cloro nella preparazione di materie plastiche di largo uso, quali il cloruro di polivinile (PVC) come anche per la sbianca della cellulosa. Infine, il cloro trova applicazione nella preparazione di manufatti in medicina (per es., cateteri per flebo e cardiaci, lenti a contatto); nell’industria automobilistica (airbag, tappetini, cruscotti); nell’industria del tempo libero (palloni da calcio, tende, capi di vestiario impermeabili, racchette da tennis, sci, compact disk, televisori); nell’arredamento (tessuti e moquette, adesivi e vernici). L’altro prodotto, la soda, trova largo impiego nell’industria chimica, nella produzione del rayon, della carta, dei saponi e dei detergenti.
Nella pratica industriale, il cloro e la soda sono ottenuti simultaneamente tramite elettrolisi del cloruro di sodio che porta alla loro produzione nel rapporto stechiometrico di 1,13 t di soda per 1 t di cloro. Poiché il cloro e l’idrossido di sodio reagiscono tra loro per dare l’indesiderato ipoclorito, l’elettrolizzatore deve essere disegnato in modo da evitare il contatto diretto tra i due prodotti primari e, nello stesso tempo, da permettere di ottenerli nella forma più pura possibile. Inoltre, deve essere tenuto presente che questo processo di elettrolisi è influenzato dal fatto che le dissipazioni, e quindi il consumo energetico, aumentano con la produttività, il che richiede la definizione di un delicato bilancio tra costi di investimento e costi di esercizio.
Celle a mercurio
Per il processo cloro-soda si utilizzano tre tecnologie distinte: (a) le celle a mercurio, (b) le celle a diaframma e (c) le celle a membrana. Storicamente – e in particolare a cominciare dagli anni Settanta – le celle a mercurio hanno dominato il settore; nei tempi più recenti questa tecnologia viene utilizzata in maniera sempre più ridotta a causa delle problematiche legate alla contaminazione ambientale indotta dal mercurio.
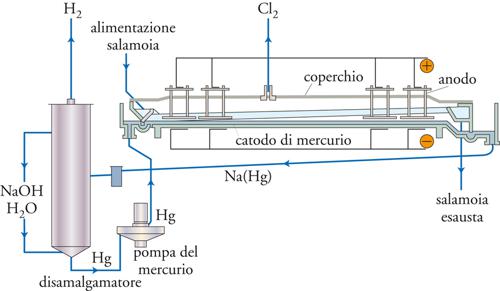
La fig. 7 mostra lo schema di funzionamento di una cella a mercurio. La cella, di tipo a flusso, è costituita da un cassone di acciaio di forma rettangolare, non molto profondo e inclinato di 1÷3 gradi, in modo da rendere possibile lo scorrimento di un film di mercurio (qualche millimetro di spessore) che funziona da catodo (quindi connesso al polo negativo del generatore). Il cassone è chiuso nella parte superiore da un coperchio di gomma e il suo fondo deve essere liscio senza presentare dislivelli che possano pregiudicare una perfetta copertura da parte del film di mercurio: l’eventuale presenza di parti di acciaio scoperte, infatti, può portare a reazioni indesiderate, quali la liberazione di idrogeno, e, quindi, a perdite di efficienza di corrente. Sopra al catodo, a una distanza costante di pochi millimetri, è posizionata una serie di anodi. Nei primi tempi di sviluppo di questa tecnologia, gli anodi erano costituiti da blocchi di grafite, a cui, però, era associata una serie di problemi che includevano un’elevata sovratensione per lo sviluppo di cloro (ca. 500 mV) e fragilità (con un consumo per sgretolamento di ca. 2÷3 kg di grafite per tonnellata di cloro prodotta) che richiedevano un disegno di cella tale da prevedere la sostituzione periodica degli anodi. Inoltre, la geometria di questo particolare tipo di anodi non si adatta bene allo sviluppo del cloro, in quanto il gas prodotto non può trovare uno sfogo adeguato verso la parte superiore della cella, condizione operativa fondamentale. Quindi, in alternativa, sono stati presi in considerazione anodi ricoperti di metalli quali platino o titanio, ottenendo così una drastica riduzione della sovratensione; beneficio però contrastato da un notevole aumento di costo. La svolta operativa si è verificata con la messa a punto dei cosiddetti anodi dimensionalmente stabili (DSA, Dimensionally stable anode) costituiti da una famiglia di materiali di titanio ricoperti di ossido di rutenio. Questi anodi sono caratterizzati da grande stabilità verso la corrosione e, quindi, da lunga vita operativa e da una bassa sovratensione per il cloro: per queste proprietà gli anodi DSA sono i più usati.
In riferimento alla fig. 7, si nota come il prodotto di partenza sia una soluzione concentrata (ca. 320 g/l) di cloruro di sodio, comunemente detta salamoia. Questa entra a circa 80 °C nella cella dallo stesso lato da cui entra il mercurio. Ai poli positivi (anodi) si ha l’ossidazione degli ioni cloruro a cloro gassoso:
[10] Cl− → (1/2) Cl2 + e−
mentre al polo negativo (catodo di mercurio in flusso) si ha la riduzione degli ioni sodio a sodio metallico che si amalgama con il mercurio:
[11] Na+ + x Hg + e− → Na(Hg)x.
Il cloro gassoso, uno dei prodotti primari che si sviluppa agli anodi, viene raccolto da una tubazione in leggera aspirazione posta sul coperchio della cella, mentre la salamoia esausta (ca. 270 g/l di NaCl) esce dal lato opposto al suo ingresso.
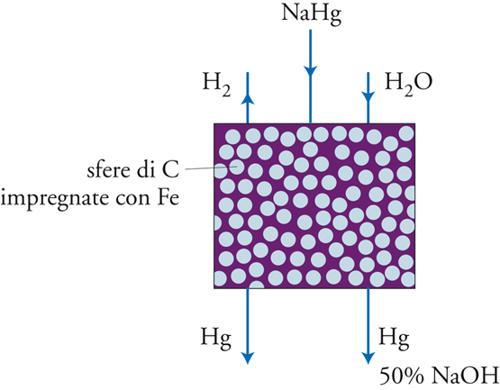
L’amalgama di sodio fluisce all’esterno della cella elettrochimica, dove subisce alcuni lavaggi con acqua (per rimuovere i residui di salamoia), e, quindi, entra in un disamalgamatore costituito da un cilindro riempito di sfere di grafite attivate per immersione in una soluzione di molibdato d’ammonio e successiva riduzione con idrogeno ed, eventualmente, addizionate con metalli catalizzatori quali il ferro o il nichel (fig. 8). Oltre all’amalgama, viene fatta fluire all’interno del disamalgamatore anche l’acqua, per dar luogo alla reazione:
[12] Na(Hg)x + H2O → NaOH + H2 + Hg
con la formazione dell’altro prodotto primario, NaOH, e di idrogeno come sottoprodotto. La reazione è esotermica e il calore liberato viene utilizzato per mantenere al valore di 80 °C la temperatura all’interno dell’elettrolizzatore. Il mercurio (contenente ca. lo 0,01% di Na) viene immesso nuovamente in testa alla cella elettrochimica per mezzo di una pompa.
I valori dei potenziali termodinamici del processo anodico di produzione del cloro (vedi la [10]) e di quello catodico di produzione dell’amalgama (vedi la [11]) sono rispettivamente pari a 1,23 V e –1,80 V nella scala con riferimento all’elettrodo a idrogeno. Tuttavia, per far procedere il processo anodico alla temperatura operativa di 80 °C e per vincere le sovratensioni, è necessario fornire una tensione più positiva rispetto al potenziale termodinamico, mentre per far avvenire quello catodico è necessario fornire una tensione più negativa rispetto al relativo potenziale termodinamico. Inoltre, è da tener presente che reazioni concorrenti, quali lo sviluppo di ossigeno all’anodo:
[13] 2H2O → O2 + 4H+ + 4e−
e quello d’idrogeno al catodo:
[14] 2H2O + 2e− → H2 + 2OH−
sono termodinamicamente favorite rispetto a quelle desiderate. Pertanto, per assicurare il procedere dei processi desiderati è necessario che in condizioni operative la tensione di sviluppo del cloro diventi inferiore a quella dell’ossigeno e la tensione della formazione di amalgama inferiore a quella dell’idrogeno. Questa condizione viene raggiunta con l’impiego di opportuni materiali anodici, quali i citati DSA, tali cioè da rendere l’evoluzione del cloro cineticamente favorita rispetto a quella dell’ossigeno. La stessa condizione si verifica nel comparto catodico, in quanto la reazione termodinamicamente favorita (in questo caso l’evoluzione dell’idrogeno) viene cineticamente impedita dalla sua elevata sovratensione su mercurio, così da permettere la formazione dell’amalgama per cui, invece, la sovratensione è trascurabile.
Sulla base dei potenziali termodinamici, la tensione di cella risulta di poco superiore a 3 V; tuttavia, in pratica, per far avanzare il processo è necessario fornire una tensione di ca. 4,5 V. Considerati i bassi valori delle sovratensioni anodiche e catodiche (dell’ordine di qualche decina di millivolt), si comprende come l’eccesso nella tensione di esercizio si renda necessario per vincere le cadute ohmiche iR (vedi la [8]) legate alla somma della resistenza della soluzione e di quella dei conduttori di corrente.
Celle a diaframma
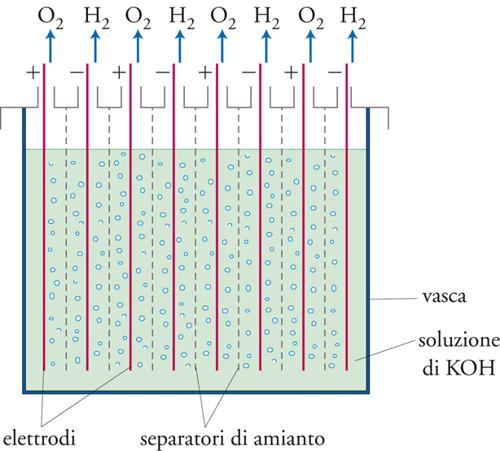
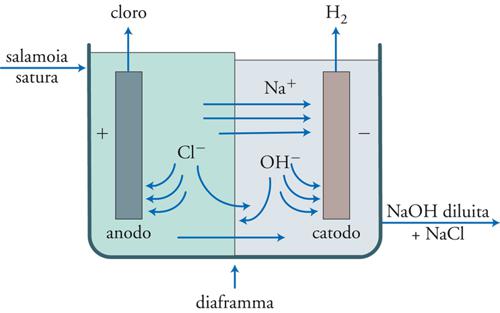
La fig. 9 mostra lo schema di funzionamento di una cella a diaframma. Questa cella, del tipo a vasca, utilizza un setto di amianto che separa la camera anodica da quella catodica. La cella è alimentata da una salamoia al 30%. Il processo anodico è lo stesso di quello che ha luogo nelle celle a mercurio, vale a dire lo sviluppo di cloro:
[15] Cl− → (1/2) Cl2 + e−
mentre al catodo si sviluppa idrogeno secondo la nota reazione:
[16] 2H2O + 2e− → H2 + 2OH−
e, a seguito della diffusione degli ioni Na+ attraverso il setto di amianto, si ha formazione in uscita del prodotto primario, NaOH.
Gli anodi sono del tipo DSA, mentre i catodi sono costituiti da reti metalliche opportunamente ricoperte da un deposito di nichel che agisce come catalizzatore abbassando la sovratensione di idrogeno. Le celle a membrana beneficiano di una struttura ecosostenibile, mentre soffrono di problemi operativi legati alle limitazioni specifiche del separatore. Esso, infatti, è una barriera puramente fisica e non ionoselettiva; quindi, oltre alla voluta diffusione di Na+, altri ioni, come Cl−, possono diffondere nel reparto catodico e gli ioni OH− in quello anodico, influendo così negativamente sulle rese del processo. Per limitare questi processi indesiderati si può ricorrere ad alcuni artifizi costruttivi come, per esempio, quello di convogliare il flusso dell’elettrolita dall’anodo verso il catodo cercando di mantenere nella camera catodica un livello di liquido inferiore rispetto a quello presente nella camera anodica. Però questo principio, anche se semplice in teoria, è di difficile realizzazione. Il problema maggiore consiste nel fatto che le dimensioni dei pori del separatore possono non essere uniformi. La differenza di pressione induce una bassa velocità di retrodiffusione degli ioni OH− solo nei pori più grandi mentre in quelli più piccoli il flusso si riduce, limitandone così la diffusione nel comparto anodico. Inoltre, il flusso dell’elettrolita non può essere aumentato oltre certi livelli per non incorrere in un’eccessiva diluizione della soda all’uscita dell’elettrolizzatore. Bisogna infatti ricordare che la soda prodotta con questa tecnologia è già di per sé di concentrazione abbastanza bassa (12%) e, quindi, necessita di uno stadio addizionale (evaporazione) per aumentarne il valore al 50%, un’operazione costosa dal punto di vista energetico. Infine, va considerato che i separatori di amianto hanno una vita limitata e devono essere periodicamente sostituiti per cui il disegno della cella deve permettere un’agevole manutenzione di routine. Comunque, nonostante questi problemi, la tecnologia delle celle a membrana rimane valida specie nei casi in cui risulti adeguata una produzione di soda al 10%, con tolleranza per contenuto in cloruri.
Celle a membrana
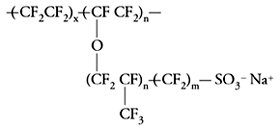
Le reazioni elettrodiche di questo tipo di cella sono identiche a quelle che si verificano nella cella a diaframma; la differenza è nel separatore, in questo caso costituito da una membrana a scambio cationico, basata su un polimero perflurosolfonico, tipo Nafion®:
dove gruppi solfonici SO3− Na+ assicurano le necessarie caratteristiche di idrofilicità e di scambio ionico.
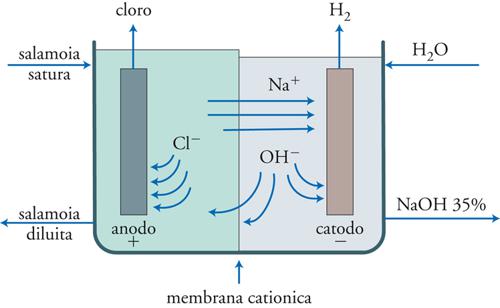
La fig. 10 illustra il principio di funzionamento delle celle a membrana. La camera anodica è separata da quella catodica dalla membrana Nafion® in grado di assicurare il passaggio desiderato degli ioni Na+ impedendo la diffusione degli ioni Cl− e la controdiffusione degli ioni OH−. La cella è alimentata con salamoia satura che viene immessa nel comparto anodico dove ha luogo lo sviluppo del cloro. Il sodio viene trasportato dalla membrana nel comparto catodico dove, a seguito della decomposizione dell’acqua con sviluppo di idrogeno, si combina con gli ioni OH− per dar luogo alla soda. Viste le caratteristiche di selettività della membrana, queste celle in teoria sono in grado di produrre soda concentrata al 50% e priva di cloruri. In pratica, le membrane non hanno la capacità di trasportare gli ioni sodio a una velocità sufficientemente elevata per ottenere soda al 50%, che pertanto si ottiene in concentrazione intorno al 35-40%. Tuttavia, l’energia per concentrarla al 50% è solo il 12% di quella necessaria nel processo delle celle a diaframma; inoltre, la contaminazione dei cloruri è notevolmente ridotta.
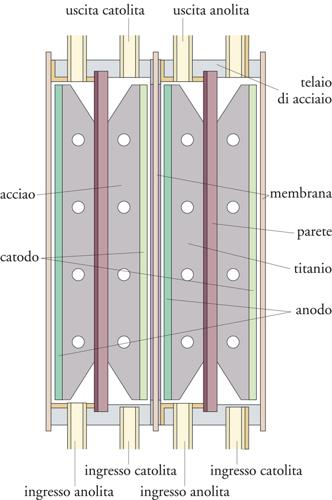
Al fine di abbattere le cadute ohmiche, sono state sviluppate opportune configurazioni di cella come quella detta ‘zero gap’, in cui gli elettrodi sono in contatto con le facce opposte della membrana, con strutture di tipo filtropressa sia monopolari sia bipolari. La fig. 11 mostra un tipico esempio. Gli elettrodi sono di tipo verticale e costituiti da metallo stirato in modo da permettere la formazione e l’evoluzione di gas dalla parte posteriore rispetto al contatto con la membrana. I compartimenti anodico e catodico sono alimentati, rispettivamente con salamoia al 25% e con una soluzione diluita di NaOH. Il flusso principale dell’elettrolita avviene nella parte posteriore dell’elettrodo ma l’elettrolisi avviene essenzialmente sulla faccia dell’elettrodo a contatto con la membrana.
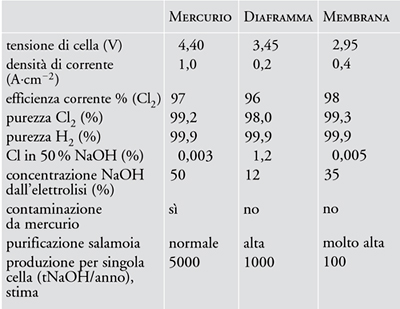
La tab. 1 riporta a confronto le caratteristiche delle tre tecnologie per il processo cloro-soda appena discusse. La scelta dipende dal tipo di applicazione e dalle condizioni desiderate dei prodotti finali, anche se la crescente preoccupazione per l’inquinamento e i miglioramenti raggiunti negli ultimi tempi per quanto riguarda le membrane ionoselettive, suggeriscono una preferenza per le celle a membrana.
Estrazione dell’alluminio
L’industria dell’alluminio, con una produzione annua di diversi milioni di tonnellate, è seconda di importanza solo a quella del cloro-soda. Anche questa industria si basa su una tecnologia elettrochimica preceduta da una fase chimica.
L’alluminio è normalmente prodotto dalla bauxite, un ossido di alluminio idrato contenente silicio e altri ossidi metallici, quali ferro e titanio. Nella prima fase della produzione la bauxite viene trattata in autoclave con idrossido di sodio in modo da portare gran parte dell’alluminio in soluzione come alluminato di sodio (processo Bayer):
[17] Al2O3 + 2OH− + 3H2O → 2 Al(OH)4−
mentre i componenti metallici rimangono nel corpo di fondo come precipitato costituito da TiO2, Fe2O3 e NaAlSi3O8 (fanghi rossi). Dopo filtrazione, la soluzione viene diluita per favorire lo spostamento verso destra della reazione:
[18] Al(OH)4− → Al(OH)3 + OH−
e la conseguente precipitazione dell’idrossido di alluminio, in genere in ragione di circa 2/3 di quello presente in soluzione; questa, quindi, viene concentrata per evaporazione a caldo e rimessa in ciclo.
L’idrossido di alluminio viene lavato e riscaldato ad alta temperatura per rimuovere l’acqua e formare allumina:
[19] 2Al(OH)3 → Al2O3 + 3H2O↑
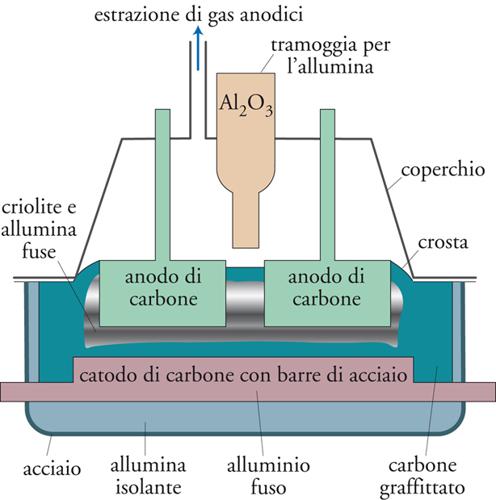
che è il prodotto di partenza per la produzione di alluminio metallico mediante elettrolisi. A tal fine, l’allumina viene sciolta ad alta temperatura (1030 °C) in un bagno di criolite (Na3AlF6) fusa. Il processo, detto di Hall-Héroult in onore degli scienziati che ne hanno per primi ideato la procedura, avviene in una cella a vasca, illustrata schematicamente nella fig. 12.
Il disegno della cella è in gran parte determinato dalla necessità di contenere la criolite fusa ad alta temperatura e resistere all’attacco dell’alluminio fuso e dei prodotti secondari che si formano agli elettrodi. A tal fine viene usato un contenitore d’acciaio molto robusto, ricoperto di alluminio, che funge da refrattario, e quindi di carbone. Il fondo della cella è costituita da blocchi di carbone pretrattato all’interno dei quali corrono barre di acciaio che operano come catodi. Gli anodi sono costituiti da blocchi mobili di carbone posti nella parte superiore della cella.
Poiché nel bagno di criolite l’alluminio è presente in miscela con specie diverse, la cui chimica è poco conosciuta, le reazioni di cella non sono del tutto certe; sembra, comunque, che il processo catodico porti alla riduzione dello ione alluminio a metallo fuso:
[20] Al3+ + 3e− → Al (l).
In teoria, il processo anodico dovrebbe essere l’ossidazione di O2− con produzione di O2, ma nelle condizioni operative di cella è praticamente impossibile trovare un materiale inerte su cui fare avvenire questa reazione; ne segue che il processo anodico viene condotto su anodi di carbone secondo la reazione:
[21] 2O2− + C → CO2 + 2e−
con un processo globale di cella:
[22] 2Al2O3 + 3C → 4Al + 3CO2.
A seguito del processo di elettrolisi, si forma, sia in superficie sia a contatto con le pareti laterali della cella, una crosta solida di criolite e allumina che agisce come elemento coibente e come barriera contro la corrosione. La cella presenta nella parte superiore una tramoggia per il rifornimento periodico di allumina e nel fondo un sistema per il prelievo di alluminio.
Come si rileva dalla [21], gli anodi di carbone vengono consumati nel corso della reazione elettrodica e quindi devono essere continuamente abbassati per mantenere costante la distanza interelettrodica per poi essere sostituiti alla fine della loro vita operativa. Per questa ragione, a cui si aggiunge un elevato consumo energetico associato al riscaldamento di cella e una bassa efficienza di corrente, il processo risulta costoso. Sono, quindi, sotto sperimentazione processi alternativi, come, per esempio, quello basato sull’elettrolisi del cloruro di alluminio disciolto in un fuso di cloruro di sodio e cloruro di litio.
Raffinazione dei metalli
Il processo di raffinazione si basa su una tecnologia elettrochimica in cui il metallo contenente impurezze, indicato generalmente con M, viene usato come anodo e disciolto in soluzione secondo la reazione:
[23] M → Mn+ + n e−
per poi deporlo in forma pura al catodo:
[24] Mn+ + n e− → M.
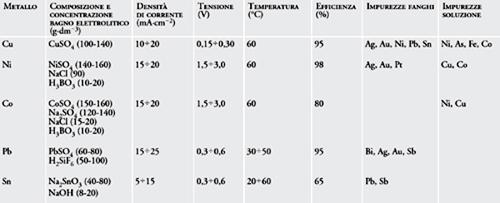
I metalli per i quali si utilizza questa procedura sono essenzialmente rame, nichel, cobalto, piombo e stagno con le caratteristiche operative riportate nella tab. 2.
Il processo di raffinazione del rame è tipico ed esemplificativo di questa tecnologia. In esso si utilizza una soluzione elettrolitica costituita da solfato di rame in acido solforico e le condizioni di elettrolisi dipendono dal tipo delle impurezze che si vogliono allontanare. Nel caso più generale, si verificano in sequenza i processi di seguito elencati: (a) metalli quali Au, Ag e Pt sono più nobili del Cu e, quindi, non si sciolgono anodicamente e si ritrovano nell’elettrodo di partenza; (b) metalli quali Sn, Bi e Sb si sciolgono all’anodo ma precipitano come ossidi o come idrossidi e si ritrovano nei fanghi anodici; anche il Pb, che si scioglie anodicamente, precipita poi come solfato insolubile; (c) metalli quali Fe, Ni, Co e Zn, che si dissolvono all’anodo, rimangono in soluzione in quanto non possono venire ridotti al catodo avendo un potenziale più catodico del Cu.
Ne segue che il catodo si arricchisce solo di rame, portando così alla raffinazione desiderata. In una fase separata, sia l’elettrolita sia i fanghi possono essere trattati per estrarre i materiali secondari.
In questa tecnologia di raffinazione l’aspetto tecnico di maggior importanza è la purezza del deposito, unita alla velocità di produzione e al consumo energetico che sono principalmente influenzati da una serie di fattori che includono la qualità dell’anodo di partenza, le condizioni dell’elettrolita e la densità di corrente catodica. L’elettrolisi viene condotta intorno ai 60÷65°C. L’elettrolita, che contiene additivi organici che servono a controllare l’elettrocristallizzazione al catodo in termini di omogeneità e brillantezza del deposito, viene fatto circolare tra gli elettrodi. La circolazione contribuisce a mantenere costante la temperatura, ad aumentare il trasporto di massa e a facilitare l’allontanamento delle impurezze. In tal modo si ottiene un’efficienza di corrente catodica e anodica dell’ordine del 90÷97%.
Elettrolisi dell’acqua
L’elettrolisi dell’acqua porta allo sviluppo di idrogeno e ossigeno con livelli di purezza molto elevata. Questo processo, già importante per i suoi risvolti industriali (semiconduttori, sintesi dell’ammoniaca), attualmente assume un interesse particolare in vista dell’uso dell’idrogeno come vettore per la produzione di energia rinnovabile in centrali pulite. Il potenziale termodinamico della reazione [25] è 1,23 V. In pratica la tensione di esercizio è più elevata in quanto i processi elettrodici risentono di elevate sovratensioni e questo influisce sostanzialmente sul costo energetico del processo.
Gli elettrolizzatori dell’acqua usufruiscono di celle a struttura a vasca o a filtropressa. La caratteristica comune è nella scelta delle condizioni operative e dei materiali elettrodici più opportuni per contenere i costi, le sovratensioni e per minimizzare i fenomeni di corrosione. Idealmente, i materiali elettrodici migliori sarebbero quelli formati da platino platinato; tuttavia, dato il costo elevato, essi sono di scarso uso. Una valida alternativa, che offre un buon compromesso tra costo ed efficienza, è costituita da elettrodi ad elevato sviluppo superficiale a base di nichel (ossidi o leghe). La temperatura di cella è portata intorno ai 70÷80 °C per facilitare ulteriormente l’uso di questi catalizzatori. In genere, l’elettrolita è una soluzione alcalina di idrossido di sodio o di potassio con concentrazioni che garantiscono il massimo di conducibilità alla temperatura di esercizio. In queste condizioni, la tensione minima per lo sviluppo gassoso è dell’ordine di 1,60÷1,80 V; tuttavia, per ottenere un’efficienza accettabile del 45÷65%, è necessario salire a 1,9÷2,6 V.
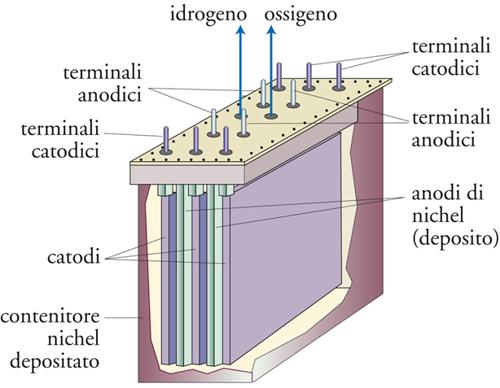
Gli elettrolizzatori, con celle del tipo a vasca, operano generalmente in connessione monopolare. La fig. 13 ne mostra un esempio (cella Stuart) costituito da un contenitore di acciaio ricoperto di nichel, all’interno del quale sono impacchettati, vicini gli uni agli altri, gli anodi e i catodi delle varie unità che compongono il sistema. Gli elettrodi con la stessa polarità sono connessi in parallelo mentre le varie unità di cella sono connesse in serie. Questa disposizione conferisce all’elettrolizzatore una grande flessibilità, in quanto un aumento di corrente (e quindi un aumento di idrogeno prodotto) si può ottenere semplicemente aumentando il numero di unità dell’impianto. Un elettrolizzatore di questo tipo opera a una temperatura di 70 °C con una tensione dell’ordine di 1,85V e con un’efficienza energetica che eccede l’80%.
Gli elettrolizzatori con celle a filtropressa sono strutturalmente più complessi e richiedono la circolazione forzata dell’elettrolita garantendo però una buona resa. In questa configurazione gli elettrodi sono costituiti da lamine di acciaio perforato in modo da lasciare passare attraverso i pori i gas nella parte posteriore. Tra gli elettrodi, posti molto vicini, è interposto un separatore di amianto sostenuto da un’anima costituita da rete di nichel. Un aumento del volume produttivo di idrogeno si ottiene aumentando sia l’area sia il numero degli elettrodi.
Sono anche utilizzati, per scopi speciali, elettrolizzatori ad alta pressione (ca. 30 atm), anch’essi con celle tipo filtropressa. Questi elettrolizzatori non offrono dal punto di vista energetico vantaggi significativi rispetto ai sistemi tradizionali; essendo però molto più compatti, essi trovano impiego in ambienti nei quali lo spazio rappresenta il fattore critico, come, per esempio, nei sottomarini dove vengono utilizzati per la produzione di idrogeno necessario per la vita a bordo.
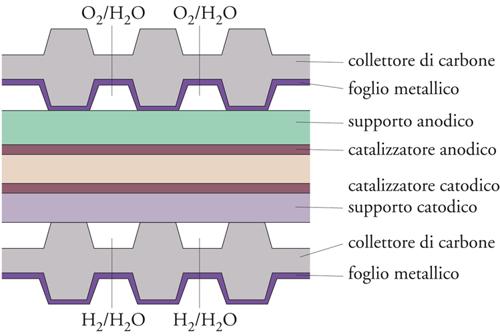
Questo tipo di elettrolizzatori sono però in via di sostituzione con sistemi ancora più compatti e più leggeri, che, utilizzando separatori polimerici selettivi, non necessitano di alte pressioni per il loro funzionamento; ne segue una semplicità del sistema di controllo e delle procedure di messa in marcia e di arresto. La fig. 14 mostra la struttura schematica di una cella a membrana. Essa è basata su un elettrolita polimerico costituito da una membrana tipo Nafion® in grado di assicurare il trasporto protonico, due elettrodi porosi con catalizzatore del tipo di quelli utilizzati nelle celle a combustibile e tre altri componenti: un collettore di corrente in carbone, un supporto anodico di titanio platinato e un supporto catodico costituito da un foglio di fibra di carbonio. Un foglio di titanio platinato ricopre il collettore anodico per evitarne l’ossidazione. La cella viene alimentata dal lato anodico in cui avviene la produzione di ossigeno. I protoni attraversano l’elettrolita polimerico a essi permeabile per raggiungere il catodo dove vengono ridotti per produrre idrogeno. Lo scomparto anodico è alimentato con un eccesso d’acqua per rimuovere il calore che vi si sviluppa nel corso del processo e l’assemblaggio di tutto il sistema è sviluppato orizzontalmente per assicurare la completa bagnabilità della membrana elettrolitica. Le celle a membrana hanno caratteristiche di funzionamento molto promettenti e sono in costante sviluppo.
Bibliografia
Palin 1969: Palin, George R., Electrochemistry for technologists, Oxford, Pergamon, 1969.
Pletcher 1990: Pletcher, Derek, Industrial electrochemistry, 2. ed., London, Chapman & Hall, 1990.