aggregazióne, stati di
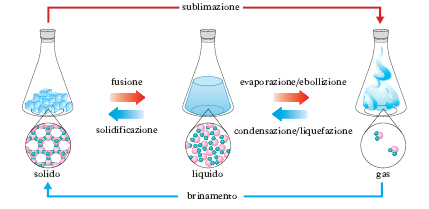
aggregazióne, stati di In fisica, modo di associarsi e d’interagire delle molecole costituenti un corpo o una sostanza, che determina parte delle proprietà macroscopiche del corpo stesso. L’esperienza quotidiana suggerisce la distinzione di tre stati di a.: solido, cui corrispondono un volume e una forma ben determinati; liquido, con volume invariabile ma forma indeterminata; aeriforme (o gassoso), con volume e forma indeterminati. Nello stato solido le molecole occupano, rispetto alle altre molecole vicine, una posizione media ben definita; nello stato liquido esse sono in movimento continuo ma ancora, per così dire, a contatto tra di loro; nello stato aeriforme, infine, le singole molecole vagano nello spazio in cui sono contenute, le une indipendentemente dalle altre, urtando le une contro le altre e contro le pareti del recipiente che le contiene. Per una definizione più precisa dello stato di a. è più opportuno considerare proprietà che siano in diretta relazione con la natura e con l’entità delle interazioni molecolari: l’elasticità, la viscosità, l’isotropia chimica e fisica, che permettono di delimitare gli stati di a. tra due condizioni estreme, solido ideale e gas ideale: infinitamente viscoso e generalmente anisotropo il primo; elastico, non viscoso, generalmente isotropo il secondo. Uno schema di classificazione degli stati di a. può essere pertanto, a grandi linee, il seguente: a) solido ideale, quello dei monocristalli; b) solido cristallino, aggregato di strutture cristalline; c) solido amorfo, quello delle sostanze prive di struttura cristallina; d) pastoso, quello delle sostanze che presentano notevole anelasticità; e) liquido cristallino mesomorfo, quello delle sostanze che, pur avendo consistenza e scorrevolezza di liquidi, presentano spiccate caratteristiche di anisotropia, specialmente ottica; f) liquido isotropo; g) stato di vapore, aeriforme al di sotto della temperatura critica; h) stato di gas reale, aeriforme al di sopra della temperatura critica; i) stato di gas ideale che segue rigorosamente la legge dei gas perfetti.