nervoso enterico, sistema
nervoso enterico, sistema
Sistema nervoso (in sigla SNE) presente nel tratto gastrointestinale dei mammiferi, in grado di regolare in maniera autonoma le funzioni digestive. La prima osservazione che ha aperto la strada allo studio dell’SNE fu condotta alla fine dell’Ottocento da William M. Bayliss ed Ernest H. Starling, i quali dimostrarono che una contrazione a monte (e un rilasciamento a valle) della sede di stimolazione di un’ansa di intestino tenue generava un riflesso di natura propulsiva (peristalsi). Con il progredire delle conoscenze la ricerca neurofisiologica sul cosiddetto ‘secondo cervello’ e stata intensa e si può considerare definitivamente superata l’idea che la regolazione delle attività digestive sia svolta dal sistema autonomo (parasimpatico e simpatico). La rete di neuroni enterici ha una struttura morfofunzionale autonoma e complessa; i neuroni enterici sono divisi in effettori, eccitatori e inibitori, sensori intrinseci, interneuroni: tramite connessioni con il sistema nervoso centrale e periferico questi neuroni regolano le funzioni digestive, come l’attività motoria del canale alimentare, le secrezioni gastroenterobiliopancreatiche, l’assorbimento intestinale di nutrienti e il circolo splancnico.
Aspetti morfofunzionali dell’SNE
I neuroni enterici costituiscono i plessi gangliari, il plesso mienterico di Auerbach, il plesso sottomucoso di Meissner e i plessi agangliari. La componente gliale gangliare è molto simile alla glia del sistema nervoso centrale: svolge funzioni di supporto alla componente neuronale e coadiuva la risposta infiammatoria intestinale, tramite il rilascio di interleuchine e l’espressione di antigeni di istocompatibilità di classe II. Il plesso mienterico di Auerbach, distribuito tra gli strati muscolari longitudinale e circolare, presiede all’innervazione motoria della tunica muscolare liscia e secretomotoria della mucosa, presentando numerose proiezioni verso i gangli sottomucosi e verso i plessi gangliari localizzati al di fuori del canale alimentare (gangli della parete della colecisti, del parenchima pancreatico e simpatici prevertebrali). Il plesso sottomucoso del Meissner, localizzato tra lo strato muscolare circolare e la muscularis mucosae, è ben sviluppato nel piccolo intestino: ne controlla la funzione secretoria tramite l’innervazione dell’epitelio ghiandolare, della muscularis mucosae, delle cellule endocrine e dei vasi sanguigni sottomucosi. Nella colecisti, nei dotti cistico e biliare comune, nello sfintere di Oddi e nel pancreas sono stati descritti plessi gangliari secondari. I plessi agangliari, formati solo da fasci di fibre, sono localizzati a livello sottosieroso (fibre di connessione tra nervi estrinseci e plessi intramurali), muscolare profondo (piccoli fasci nervosi connessi precipuamente al plesso mienterico) e mucoso (fine rete di fibre nervose che innervano le cellule epiteliali ed endocrine dello strato mucoso). I neuroni enterici sono di tre tipi:
• Tipo I: innervano la muscolatura liscia, sono altamente eccitabili e sono responsabili della trasmissione sinaptica nicotinica gangliare. Comportandosi da motoneuroni, regolano tramite stimoli o inibizione la muscolatura gastrointestinale, contraendola o rilasciandola.
• Tipo II: possono essere considerati come neuroni sensoriali, ricevendo stimoli meccanici, termici e chimici. Possiedono la caratteristica di essere spesso in stato iperpolarizzante (ossia elettrofisiologicamente ineccitabili) dopo uno stimolo.
• Tipo III: simili al tipo I, dopo essere stimolati generano potenziali postsinaptici eccitatori.
Neurotrasmissione dell’SNE
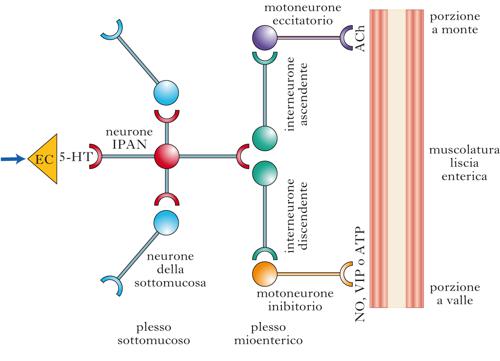
A oggi (2010) sono state individuate nell’SNE quasi cinquanta sostanze attive da un punto di vista neurochimico. Nei neuroni enterici sono presenti molecole peptidiche e non peptidiche (ammine, amminoacidi, purine) che possono agire come neurotrasmettitori o come neuromodulatori. Le sostanze non peptidiche agiscono come neurotrasmettitori (➔), mentre i peptidi agiscono direttamente sulla funzione dei neuroni o delle cellule epiteliali neurocrine bersaglio. Il profilo neurochimico associato a uno specifico neurone enterico rappresenta una sorta di carta d’identità delle popolazioni di cellule nervose dell’SNE. Per es., la sottopopolazione dei motoneuroni eccitatori contiene l’acetilcolina (ACh) e due tachichinine, la sostanza P (SP) e la neurochinina A (NKA); i motoneuroni inibitori utilizzano il monossido d’azoto (NO), il polipeptide intestinale vasoattivo (VIP), una ciclasi (PACAP, Pituitary-Adenilate Cyclase Activating Polypeptide), peptide strutturalmente simile al VIP, e l’ATP. Nel riflesso della peristalsi la distensione meccanica del lume intestinale indotta dal bolo stimola i neuroni sensoriali intrinseci i quali sono in contatto sinaptico, attraverso gli interneuroni, sia con motoneuroni eccitatori (a polarità ascendente) sia con quelli inibitori (a polarità discendente). I motoneuroni eccitatori rilasciano ACh, SP e NKA, determinando la contrazione dello strato muscolare circolare a monte dello stimolo; i motoneuroni inibitori rilasciano NO, VIP, ATP e PACAP, inducendo il rilasciamento della muscolatura a valle dello stimolo. Il risultato funzionale di questo controllo neuronale della muscolatura enterica è la progressione dei contenuti luminali in direzione ororettale.
Patologie dell’SNE
Numerose sono le patologie relative al controllo nervoso associate alla disfunzione del sistema enterico. Nell’acalasia, un’alterazione della motilità esofagea con ridotta peristalsi e conseguente ipertono dello sfintere esofageo inferiore, sembra che vi sia una riduzione della componente neuronale inibitoria che libera VIP e NO con conseguente aumento del tono colinergico. Il deficit dell’enzima ossido nitrico sintetasi (n-NOS) genera l’ipertrofia muscolare liscia del piloro, come se vi fosse una denervazione funzionale dei neuroni mienterici. La malattia di Hirschsprung, patologia genetica caratterizzata da assenza dei neuroni enterici nel retto o nel colon discendente (agangliosi), è dovuta a disfunzione dei processi di migrazione e sviluppo dei neuroblasti dalle creste neurali all’intestino; le conseguenze funzionali dell’agangliosi sono un aumento del tono muscolare con alterazioni a monte dell’ostruzione funzionale del colon. La condizione di adinamicità del colon sembra sia dovuta ad aumento della componente colinergica, con conseguente riduzione del controllo della noradrenalina sulla liberazione dell’acetilcolina e assenza dell’inibizione NO-mediata. Come prospettiva generale è stato scoperto recentemente (2009) che stimolando le pareti intestinali con la serotonina è possibile indurre la crescita di nuovi neuroni nell’SNE degli adulti; questa capacità rigenerativa dei neuroni enterici potrebbe aprire le porte a terapie per diverse malattie intestinali.