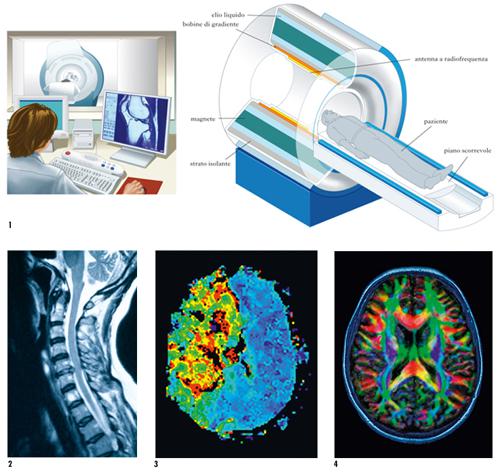
RMN (sigla di Risonanza Magnetica Nucleare)
RMN (sigla di Risonanza Magnetica Nucleare)
Tecnica di imaging basata sull’interazione fra un campo a radiofrequenza e momenti magnetici nucleari e sulla successiva elaborazione grafica dei segnali ottenuti dall’interazione.
I principi della tecnica
La tecnica è basata su un sistema emittente (bobine a radiofrequenza) e un sistema ricevente, rappresentato dai nuclei atomici, in partic. quelli di idrogeno, all’interno di un campo magnetico statico. I nuclei atomici sono masse con carica elettrica in movimento, che quindi generano campi magnetici attorno alla direzione del movimento. I nuclei sono caratterizzati da un movimento di rotazione attorno al proprio asse che crea un momento magnetico (detto di spin) che viene variato in modo significativo dalla interazione con radiofrequenze: in partic., la modifica crea una variazione (precessione) nell’asse di rotazione dei nuclei. Particolarmente intensi sono i campi magnetici generati dal protone (atomo di idrogeno privo dell’unico elettrone, ossia lo ione H). L’idrogeno è presente in tutti i composti biologici dell’organismo (dagli zuccheri, alle proteine, ai grassi). Nella tecnica RMN i nuclei di idrogeno presenti nell’organismo in esame, immersi in un campo magnetico ed eccitati con una opportuna radiofrequenza (RF), detta di risonanza (che amplifica il segnale della interazione), emettono energia che contiene informazioni sia sull’abbondanza della specie nucleare sia sulla struttura delle molecole in cui i nuclei sono contenuti. L’immagine RMN si ricava dalla elaborazione di un segnale elettrico ottenuto dalla misurazione delle variazioni di campo magnetico generate dal moto di precessione degli atomi di idrogeno. La sequenza, ossia il particolare succedersi degli eventi che porta all‘eccitazione e alla generazione del segnale e la loro valutazione temporale determinano il contenuto informativo dell’immagine.
Il ruolo dei nuclei di idrogeno
Dato che i nuclei di idrogeno sono assemblati in ambienti molecolari diversi, diverse sono anche le modalità di cessione di tale energia. Ciò comporta che ogni tessuto si differenzi sia nell’assorbimento energetico che nella cessione dell’energia. I nuclei di idrogeno sono inizialmente immersi in un campo magnetico esterno costante e omogeneo; il successivo invio di un’onda di RF specifica, cioè con la stessa frequenza di eccitazione dei nuclei, porta questi dal loro stato di equilibrio dinamico a uno stato di eccitazione che termina alla cessione dell’energia erogata, quando il sistema protonico restituisce energia (diseccitamento o rilassamento dei nuclei) all’ambiente circostante, ritornando allo stato energetico iniziale ed emettendo il segnale che viene captato sotto forma di onde radio analizzabili. Il principio della produzione e della raccolta del segnale alla base della RMN è dovuto (1946) al fisico statunitense di origine svizzera Felix Bloch (1905-1983) e all’altro fisico statunitense Edward Mills Purcell (1912-1997). Per questa scoperta i due ricercatori vennero insigniti congiuntamente del premio Nobel per la medicina o la fisiologia nel 1952.
Il tomografo a RMN
I componenti di un tomografo a RMN sono il magnete, le bobine di RF, i gradienti di campo magnetico e un computer. Il magnete, il componente principale, genera un campo magnetico statico di intensità omogenea e stabile che serve a differenziare i livelli energetici degli spin in modo da renderli capaci di produrre un segnale. Il più utilizzato è un magnete superconduttivo che si basa sul principio secondo il quale alcuni materiali (superconduttori), a temperature molto basse, trasportano corrente elettrica senza resistenza. Per ottenere i valori ottimali di temperatura (circa 4 K, ossia – 269 °C) si usano gas criogeni quali elio e azoto. Le bobine a radiofrequenza sono antenne che emettono i segnali di RF per perturbare i protoni e ricevono i deboli segnali emessi da questi nella fase di rilassamento. I gradienti sono bobine che generano campi magnetici variabili che modulano il campo magnetico principale permettendo un più fine riconoscimento del segnale. Il computer calcola, rielabora e controlla tutte le operazioni necessarie alla produzione dell’immagine e necessita di grande potenza di calcolo e di capacità di memoria. Qui si concentrano le operazioni di ricostruzione delle immagini e le funzioni di analisi delle immagini già acquisite.
Le applicazioni
La RMN è impiegata soprattutto per lo studio del cranio, della colonna, del midollo spinale, dell’apparato muscolo-scheletrico e degli organi interni, al fine di individuare malformazioni, processi morbosi di natura vascolare, tumorale e traumatica. Rispetto alle altre metodiche diagnostiche presenta inoltre dei vantaggi: assenza di artefatti dovute alle strutture ossee, possibilità di ottenere sezioni a vario orientamento (sagittale, trasversale, ecc.), invasività nulla e impiego di radiazioni non ionizzanti.
RMN
Le frontiere applicative
Nel corso dei decenni la RMN ha sviluppato potenzialità di indagine sempre più sofisticate. Eccone un quadro.
Apparato scheletrico
La RMN ha trovato amplia applicazione nello studio dell’apparato muscolo-scheletrico, per es. fornendo informazioni sulle più comuni alterazioni che interessano i tendini, quali la degenerazione mixoide, le tenosinoviti e le lacerazioni parziali e complete. Anche le alterazioni muscolari, spec. quelle indirette, quali gli strappi che si verificano in corrispondenza della giunzione muscolotendinea (correlati all’attività sportiva), sono ben documentate con la RMN.
Imaging senologico
Nel corso degli ultimi anni la RMN mammaria ha assunto un ruolo importante nell’ambito dell’imaging senologico. L’elevata risoluzione spaziale e di contrasto con le sequenze dinamiche permette una valutazione accurata delle diverse lesioni focali, fermo restando il ruolo di imaging di primo livello per la mammografia e l’ecografia. L’indagine sembra essere il metodo elettivo anche nella valutazione dell’integrità delle protesi in silicone.
RMN cardiaca
Anche la RMN cardiaca è oggi utile nello studio miocardico dopo un evento ischemico potendo identificare la vitalità miocardica, in partic. dopo mezzo di contrasto. La RMN consente di identificare correttamente le complicanze dell’infarto, quali la trombosi endocavitaria, la perforazione del setto e la presenza di aneurismi o pseudoaneurismi pseudoventricolari, e di acquisire informazioni di tipo quali-quantitativo sul flusso transvalvolare.
Tumori cerebrali
La diagnosi neuroradiologica dei tumori cerebrali è oggi affidata alla RMN per il suo maggior potere informativo rispetto alla TC, eseguita in genere come primo esame per la maggiore disponibilità sul territorio. La RMN permette di ottenere informazioni riguardo dimensioni, sede e struttura macroscopica del processo espansivo; tuttavia, il recente sviluppo delle tecniche di diffusione, perfusione, spettroscopia e imaging funzionale, aggiunge elementi preziosi per una caratterizzazione migliore della neoplasia e per la definizione di un planning chirurgico. La diffusione permette il riconoscimento di componenti cistiche intralesionali e la diagnosi differenziale con lesioni benigne. La perfusione consente informazioni sulla microvascolarizzazione tessutale in termini di volume ematico, flusso e tempo di transito del mezzo di contrasto, tenuto conto che la componente angiogenetica è uno dei criteri più informativi per il grading tumorale.
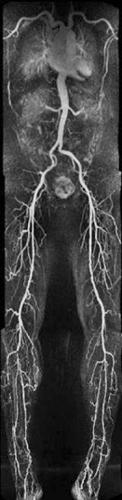
RMN con magneti ad alta intensità di campo
La comparsa in commercio di apparecchiature RMN con magneti ad alta intensità di campo (a 3 tesla) ha permesso di rispondere a esigenze di ricerca e cliniche sempre più sofisticate, soprattutto in campo neuroradiologico con valutazioni anche in campo molecolare. Il principale vantaggio di un sistema RM ad alta intensità di campo è rappresentato dall’aumento del rapporto segnale-rumore (S/R) con aumento della risoluzione spaziale e conseguente miglioramento della qualità dell’imaging in tempi ridotti. In ambito pediatrico, per es., si possono ricercare con maggiore affidabilità i focolai epilettogeni a livello encefalico, considerando che i bambini non presentano lesioni visibili a un esame RM standard, con importanti ricadute terapeutiche. Studi recenti inoltre segnalano la possibilità di una maggiore detezione di placche demielinizzanti, in pazienti affetti da sclerosi multipla, corrispondenti a differenti fasi del danno a carico del sistema nervoso centrale, e per tale motivo predittive dell’evoluzione clinica. In campo oncologico l’elevata risoluzione spaziale dovrebbe migliorare il riconoscimento delle lesioni metastatiche anche con diametro inferiore al centimetro, così come lo studio delle lesioni primitive gliali che, rispetto all’esame standard, può essere migliorato con l’utilizzazione sistematica degli studi di diffusione, perfusione e spettroscopia. In partic., la valutazione dell’imaging pesato in perfusione a 3 T risulta dirimente sia nella stadiazione (lesioni di basso grado da quelle di alto grado) sia nella caratterizzazione della eterogeneità dei gliomi, differenziando la necrosi dalla massa tumorale e questa dall’edema dei tessuti circostanti. È inoltre possibile ottenere informazioni riguardo la localizzazione delle aree eloquenti corticali (area del linguaggio, aree motorie e sensitive) e dei tratti di sostanza bianca adiacenti le masse tumorali, associando l’impiego del tensore di immagine di diffusione, che misura il movimento diffusivo delle molecole di acqua in sei direzioni. È possibile così ottenere risultati più attendibili nella pianificazione preoperatoria dei tumori, consentendo una maggiore estensione dei margini di resezione. Un altro vantaggio di tali apparecchiature è l’elevata risoluzione in ambito angiografico, con miglior contrasto vasi-tessuto e conseguente esaltazione di vasi arteriosi di piccolo calibro anche superficiali, altrimenti non identificabili. I risultati sono paragonabili a quelli ottenuti con metodiche invasive di cateterismo arterioso dei vasi epiaortici, con applicazioni nella patologia dell’aterosclerosi, degli aneurismi e della malformazione artero-venosa. Anche una elevata risoluzione spettroscopica è peculiare del 3 T, con la possibilità di ottenere una separazione di diverse specie molecolari difficilmente dissociabili ai campi inferiori. L’imaging neurologico si avvantaggia inoltre di metodiche di risonanza funzionale che consentono l’acquisizione veloce di un gran numero di immagini dinamiche per una mappatura delle aree corticali (sensitivo-motorie e del linguaggio), con applicazioni cliniche nello studio delle demenze e di patologie psichiatriche. Gli studi con magneti a 3 T hanno permesso di visualizzare dinamiche neuronali a livello di strutture corticali molto piccole, con possibilità di localizzare peculiari funzioni cerebrali tramite mappature di aree corticali anche millimetriche.