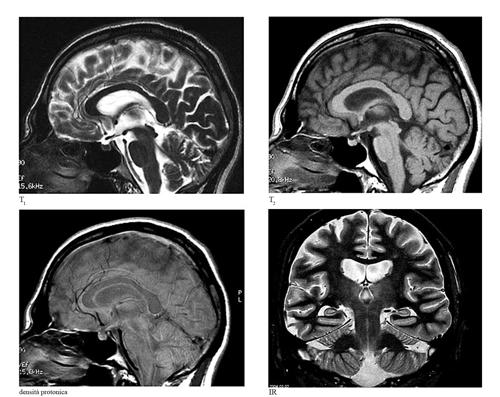
risonanza magnetica nucleare
risonanza magnetica nucleare
Tecnica diagnostica strumentale di imaging (in sigla RMN o, più brevemente, RM) ampiamente utilizzata nella diagnosi di patologie cerebrali e nella ricerca delle funzioni a esse correlate. Il fenomeno fisico su cui si basano le immagini RMN è legato alle proprietà magnetiche dei nuclei atomici: la grandezza fisica che descrive tali proprietà è il momento angolare μ (detto comunemente spin) che, secondo le regole della meccanica quantistica, può assumere solo valori interi o seminteri (½): lo spin di un nucleo è la somma degli spin di tutte le particelle costituenti. La RM può essere eseguita solo su isotopi con uno spin nucleare diverso da zero: tra questi il nucleo dell’idrogeno è quello più diffusamente applicato per immagini RM in vivo, considerata la sua abbondanza biologica. In realtà, grazie ai progressi tecnici delle apparecchiature RM, è attualmente possibile sfruttare anche altri nuclei (31P, 23Na, 14N, 13C, 19F), specialmente nel campo della spettroscopia.
Produzione del segnale
Quando un nucleo interagisce con un campo magnetico statico (B0), μ tende ad allinearsi a esso con un moto detto di precessione, caratterizzato da una frequenza angolare ben precisa, detta frequenza di Larmor o di risonanza, che dipende esclusivamente dal tipo di nucleo e dall’intensità del campo magnetico B0. Poiché la RM non osserva un singolo nucleo, ma deriva statisticamente dall’effetto combinato dei nuclei presenti entro il campione in esame, viene definita una risultante della somma di tutti i momenti magnetici μ dei singoli nuclei (rappresentata da un vettore di magnetizzazione M), ciascuno dei quali può avere un allineamento parallelo o antiparallelo a B0. In base alle leggi della meccanica quantistica, vi è un leggero eccesso di momenti magnetici lungo una direzione rispetto a un’altra, e questo fa sì che il vettore M risultante non sia mai nullo e perciò possa essere misurato. Per rilevare M occorre perturbare lo stato di equilibrio del sistema, per es. con un impulso a radiofrequenze (impulso di eccitazione, RF). Al termine dell’impulso si ristabilisce l’equilibrio di partenza tra spin e B0, detto processo di rilassamento: si hanno un rilassamento longitudinale, caratterizzato dalla costante T1, che riguarda i trasferimenti di energia tra gli spin e l’ambiente che li circonda, e un rilassamento trasversale, caratterizzato dalla costante T2, che coinvolge i trasferimenti di energia tra i singoli spin. Il ritorno all’equilibrio del vettore di magnetizzazione di un sistema di spin che ha assorbito un impulso RF genera un segnale RM, chiamato FID (Free Induction Decay), che può essere rilevato come corrente elettrica da un’antenna o da una bobina. L’andamento temporale della corrente generata ha la forma di una sinusoide che decade naturalmente secondo una costante del tempo T2 *. Una volta generato il segnale RM è necessario definirlo spazialmente, così da localizzare la regione anatomica in esame. Questo avviene utilizzando le cosiddette bobine di gradiente di campo magnetico. L’intensità di tali gradienti è misurata in T/m (tesla per metro: i valori tipici degli scanner attualmente in commercio sono dell’ordine di decine di mT/m), che rappresenta un parametro importante del dispositivo. L’elemento fondamentale di un apparecchio RM è il magnete, che produce il forte campo magnetico statico (B0), dalla cui intensità (misurata in T) dipendono le prestazioni dell’apparecchio. A seconda del modo in cui viene generato B0, si parla di magneti permanenti (capaci d’intensità limitate, fino a circa 0,4 T) o superconduttivi (che consentono intensità di campo per uso clinico anche molto elevate, da 1,5 a 3,0 T, fino a 7,0 T).
Tecnica di indagine
Esponendo il sistema da studiare a una sequenza d’impulsi RF di opportuna intensità e tempo di attivazione è possibile produrre un segnale RM con specifiche caratteristiche. Nel corso degli anni sono state sviluppate moltissime sequenze per visualizzare i vari tipi di tessuti, basandosi sulle diverse caratteristiche di T1 e T2 di ciascuno di essi. Ogni sequenza è costituita da numerosi parametri, di cui i più importanti sono il tempo di ripetizione (TR, intervallo di tempo tra due impulsi di eccitazione successivi) e il tempo di eco (TE, tempo tra l’impulso di eccitazione e il momento della lettura del segnale). Le sequenze con un breve TR non permettono al sistema di tornare all’equilibrio: la magnetizzazione longitudinale non recupera del tutto il suo valore iniziale e di conseguenza il segnale raccolto dipende dal valore T1 (sequenze T1-dipendenti), per cui, per es., il grasso appare bianco. L’influenza di T1 è minimizzata con l’aumentare del TR: un TR lungo permette di esaltare il contrasto T2 dei tessuti (sequenze T2-dipendenti), come il segnale del liquor e quello del tessuto cerebrale. Ottimizzando i valori di TR e TE per minimizzare l’influenza sia di T1 sia di T2, si possono ottenere immagini pesate in densità protonica. Tra le prime sequenze utilizzate, ancora oggi quella più importante per l’imaging morfologico, è la spin-eco, capace di determinare un alto contrasto tra i differenti tessuti e dotata di una relativa insensibilità alle disomogeneità del campo magnetico. Un’altra sequenza fondamentale sotto il profilo diagnostico è l’inversion recovery (IR), che permette di esaltare il contrasto di particolari regioni anatomiche, come l’interfaccia tra sostanza bianca e sostanza grigia encefalica.
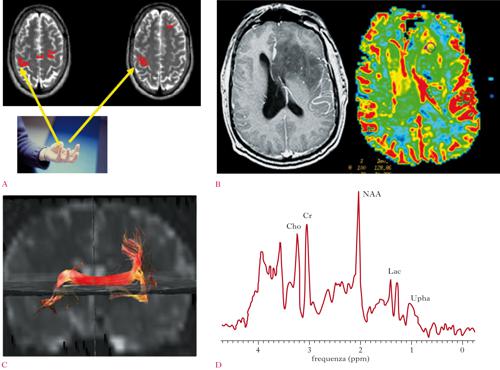
Problemi legati al tempo di acquisizione delle immagini
Uno dei limiti della RM è l’eccessiva durata del tempo di acquisizione delle immagini, legata alla necessità di campionare più volte lo stesso segnale RM. Per ridurre questi tempi di acquisizione sono state sviluppate sequenze cosiddette rapide, tra le quali la gradient-eco, che però ha lo svantaggio di un’alta sensibilità alle disomogeneità del campo magnetico causate, per es., dalla presenza di materiale ad alta suscettibilità magnetica (protesi dentarie, clip metalliche e varie protesi cerebrali e craniche di metallo, ecc.). Nel corso degli anni Novanta del 20° sec. sono state introdotte sequenze ultrarapide (eco planari, EPI), che consentono di acquisire immagini nell’ordine di pochissime centinaia di millisecondi (un unico impulso di eccitazione in un unico TR). Grazie a esse, è possibile acquisire dati RM durante processi fisiologici rapidi, come quelli legati all’attività cerebrale, consentendo così di descrivere alcuni aspetti funzionali del cervello. Per es., nelle sequenze in diffusione (DWI, Diffusion Weighted Imaging) è possibile avere un indice del movimento browniano delle molecole d’acqua all’interno delle fibre di sostanza bianca dell’encefalo, descrivendole anatomofunzionalmente (fiber tracking) e caratterizzandole nei confronti di eventuali barriere dovute a tessuto patologico; oppure si possono descrivere alcuni aspetti della perfusione cerebrale (PWI, Perfusion Weighted Imaging) mediante l’iniezione di un mezzo di contrasto (MDC) paramagnetico per endovena e la rilevazione sequenziale rapida delle modificazioni della suscettibilità magnetica indotte dal passaggio dell’MDC attraverso i vasi del cervello. Inoltre, le sequenze EPI sono alla base della RM funzionale vera e propria (fMRI), che consente di registrare variazioni vascolari locali (effetto BOLD, Blood Oxygen Level-Dependent) in risposta a specifici eventi funzionali (➔ imaging cerebrale funzionale, aspetti tecnici). La spettroscopia con RM (MRS) rappresenta una particolare applicazione della sequenza spin-eco. Essa offre la possibilità di ottenere indici relativi ai processi biochimici cerebrali e si basa su un fenomeno chiamato chemical shift: la particolare microstruttura molecolare a cui sono legati i singoli protoni determina una variazione della frequenza di risonanza locale rispetto a quella di molecole vicine, rilevabile con sequenze RM dedicate e rappresentabile sotto forma di curve (spettri). Eseguendo campionamenti spettroscopici nel tessuto encefalico, in particolari frequenze di risonanza si registrano specifici metaboliti le cui variazioni possono essere strumento estremamente utile nell’inquadrare eventi patologici particolari, per es. nel distinguere tumori cerebrali in base alla loro aggressività biologica.