pH
In chimica, notazione che significa propriamente ‘potenza (nel significato matematico, cioè esponente) d’idrogeno (simbolo H)’; si usa per indicare la grandezza che misura l’acidità o la basicità di una soluzione acquosa, espressa dal cologaritmo decimale della concentrazione (o, più propriamente, dell’attività) degli ioni idrogeno. Pertanto: pH =−log[H+]. Questa relazione analitica deriva dalla tecnica potenziometrica (introdotta da S.P.L. Sörensen nel 1909) con cui sono state effettuate le prime accurate misure della concentrazione idrogenionica, per la quale il valore misurato del potenziale è funzione del logaritmo delle concentrazioni. Nell’acqua pura e nelle soluzioni neutre, in cui la concentrazione degli ioni idrogeno è uguale a quella degli ioni idrossido, dal prodotto ionico dell’acqua [H+][OH−]=10−14 si ha che [H+]=10−7; di conseguenza il pH è uguale a 7, mentre nelle soluzioni acide, in cui [H+]>10−7, il pH risulta minore di 7 e in quelle basiche maggiore di 7. Per es., a una soluzione di acido cloridrico 10−3 N, acido forte, completamente dissociato, corrisponde un pH uguale a 3. Il pH di una soluzione si può determinare in modo approssimativo facendo uso di indicatori o, in modo più accurato, utilizzando un tipo di potenziometro (pH-metro) avente di norma la scala graduata direttamente in valori di pH.
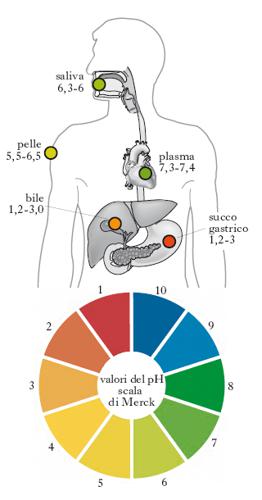
Il pH determina molte caratteristiche della struttura e dell’attività delle macromolecole (enzimi, proteine, DNA) e influenza direttamente la respirazione, l’attività renale, la funzionalità eritrocitaria ecc. Le attività vitali sono compatibili solo con minime variazioni del pH dei liquidi biologici intra- ed extracellulari (v. fig.). Questi fluidi posseggono particolari sistemi, detti sistemi-tampone (➔ tampone), che operano attenuando le brusche variazioni di pH dovute ad alterazioni metaboliche, o respiratorie, o al contatto diretto con acidi e basi. Ne è un chiaro esempio il sangue, il cui valore di pH (in individui sani) è strettamente mantenuto a 7,4 da vari sistemi-tampone; quando questo valore è più basso si dice che l’organismo si trova in uno stato di acidosi, quando è più alto si parla di alcalosi. Il pH influenza le reazioni enzimatiche (➔ enzima).