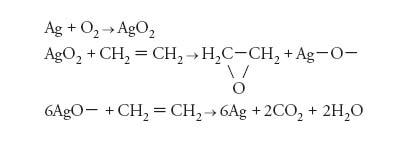Ossigeno
Ossigeno
Oltre a essere indispensabile per la vita degli organismi e per molte attività umane, quali il riscaldamento e la produzione di energia elettrica e termica, l’ossigeno è un reagente utilizzato in numerose attività industriali in alternativa all’uso diretto dell’aria. In questo caso esso proviene in gran parte dall’aria, ma può essere anche prodotto commercialmente con varie tecnologie.
La scoperta dell’ossigeno viene fatta risalire al 1773-1774 ed è attribuita al lavoro indipendente di un farmacista di Uppsala, Carl Wilhelm Scheele, e del chimico inglese Joseph Priestley. Scheele preparò l’ossigeno diverse volte tra il 1771 e il 1773, riscaldando KNO3, Mg(NO3)2, Ag2CO3, HgO e una miscela di H3AsO4 e MnO2. Egli chiamò il gas così ottenuto ‘aria vetriolica’ e lo descrisse come incolore, inodore e insapore, riferendo che alimentava la combustione meglio dell’aria. Nel 1774 Priestley riuscì a isolare l’ossigeno mediante un esperimento che prevedeva la calcinazione, mediante l’uso di una lente ustoria, di HgO racchiuso in un cilindro rovesciato su mercurio liquido; l’anno successivo, dopo aver dimostrato che si trattava di un gas diverso dall’ossido nitrico, pubblicò i risultati. Fu però il chimico francese Antoine-Laurent Lavoisier che nel 1777 riconobbe l’ossigeno quale elemento distinto, ne accertò il ruolo fondamentale nella combustione e gli diede il nome attuale (dal greco oxýs, acido, e génos, generazione) ritenendo erroneamente che fosse un costituente essenziale di tutti gli acidi. Questa scoperta contribuì in maniera decisiva al rigetto della teoria del flogisto e alla nascita di una nuova chimica.
L’ossigeno si trova nell’acqua, nell’aria, nei tessuti vegetali e animali e in quasi tutte le rocce e nei minerali. È l’elemento più abbondante sulla superficie terrestre e il terzo nell’Universo (dopo l’idrogeno e l’elio) si trova in innumerevoli composti e costituisce il 23% in peso dell’atmosfera, il 46% della litosfera e più dell’85% dell’idrosfera (ca. l’85,8% degli oceani).
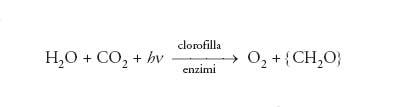
Praticamente tutto l’ossigeno terrestre è di origine biologica, essendo stato generato mediante fotosintesi da parte delle piante verdi a partire da acqua e anidride carbonica. La reazione totale si può rappresentare nel seguente modo:
[1] formula
dove con {CH2O} si indicano in generale le sostanze nutritive (carboidrati) prodotte. Oltre che nell’atmosfera e disciolto nelle acque superficiali, l’ossigeno si trova combinato con altri elementi, sia nell’acqua sia come costituente di moltissimi terreni, rocce e minerali, principalmente silicati, silicoalluminati, carbonati e fosfati.
Nel 1901 Carl von Linde mise a punto il primo metodo pratico per la produzione industriale di ossigeno mediante distillazione dell’aria liquida, ottenuta per effetto Joule-Thompson. Essendo inefficiente termodinamicamente – e quindi costoso – questo metodo è stato soppiantato nel 1902 da quello di Georges Claude, in cui l’aria liquida viene ottenuta per espansione isoentropica in un motore da cui si ottiene lavoro meccanico, portando così a un raffreddamento dell’aria molto più spinto di quello ottenuto dal solo effetto Joule-Thompson.
Produzione
Le diverse tecniche di produzione dell’ossigeno si differenziano fra loro essenzialmente per le dimensioni dell’impianto, ossia per la quantità di ossigeno prodotta al giorno, per la purezza dell’ossigeno ottenuto, per la possibilità di generarlo in situ e per la facilità di mettere immediatamente in marcia la produzione. Le metodiche utilizzate sono le seguenti: (a) distillazione frazionata dell’aria a bassa temperatura; (b) separazione dall’aria per adsorbimento su solidi; (c) separazione dall’aria con membrane; (d) decomposizione di ossidi e sali; (e) elettrolisi dell’acqua. In genere si suole introdurre una bipartizione in metodi criogenici, che sono quelli operanti a bassa temperatura, come la distillazione frazionata dell’aria, e metodi non criogenici, che sono tutti gli altri, operanti a temperatura ambiente. La distillazione frazionata e l’elettrolisi dell’acqua al momento sono le uniche tecniche che possono produrre grandi quantità di ossigeno di elevata purezza, ma la seconda non è ancora economicamente conveniente. Tutte le altre tecniche sono adatte per produrre piccole e medie quantità di ossigeno in situ, di purezza non elevata, e hanno il vantaggio di poter essere messe in marcia in poche ore.
L’ossigeno è uno dei prodotti chimici industriali più importanti, ma è commercializzato solo a livello locale, non internazionale. Comunque, sono poche le aziende che producono in proprio l’ossigeno di cui hanno bisogno. In genere la produzione è affidata a poche aziende specializzate. L’ossigeno viene fornito con pipeline, con vagoni o camion criogenici e con produzioni in situ. Attualmente il 40% dell’ossigeno viene distribuito mediante pipeline, il 44% con impianti criogenici in situ, il 10% allo stato liquido con vagoni o camion criogenici, il 5% prodotto in situ con impianti non criogenici e l’1% allo stato gassoso in bombole.
Separazione criogenica dall’aria
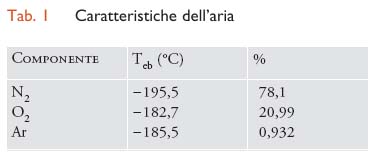
Con questa tecnica l’ossigeno può essere ottenuto per liquefazione e distillazione frazionata dell’aria, sfruttando la diversità dei punti di ebollizione dell’azoto, dell’ossigeno e dell’argon, i suoi tre componenti più abbondanti (tab. 1). Oltre a questi componenti principali, nell’aria sono presenti CO2 e, a concentrazione più bassa, gli altri gas nobili (neon, elio, kripton e xenon), l’idrogeno e piccole quantità di metano (CH4), monossido di carbonio (CO), biossido di zolfo (SO2), monossido di azoto (NO), ozono (O3), acqua (H2O).
Nel processo criogenico, dapprima viene liquefatta l’aria portandola a bassa temperatura e poi, mediante due colonne di distillazione, vengono separati i diversi componenti. Questa tecnologia è quella che attualmente fornisce l’ossigeno più puro ed è anche la più economica per impianti di medie e grandi dimensioni, ossia per produzioni superiori a 200 t/giorno e fino a 3000 t/giorno o per portate da 8000 a 30.000 Nm3/ora. Oltre all’ossigeno, nel processo vengono prodotti anche azoto e argon. L’ossigeno ottenuto ha una purezza che va dal 95 al 99,9%.
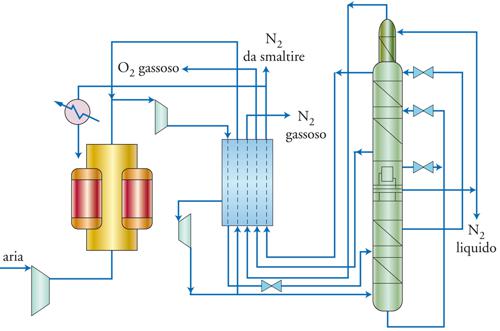
La distillazione frazionata dell’aria avviene in sei stadi schematizzati nella fig. 2 e osservabili in maniera più dettagliata nella fig. 3. Nel primo stadio si realizzano la filtrazione e la compressione dell’aria fino a 65 bar, con successivo raffreddamento, in genere a temperatura ambiente, e con la contemporanea eliminazione di una parte dell’acqua presente. In un secondo stadio si realizza la purificazione, ossia la completa eliminazione di acqua e CO2 e di eventuali altre impurezze presenti, come gli idrocarburi, che negli stadi successivi, condotti a bassa temperatura, diventerebbero solidi, intasando così le linee. La loro eliminazione viene ottenuta con due tecnologie alternative: l’adsorbimento su solidi o la condensazione in scambiatori di calore reversibili. Nella tecnica di adsorbimento, una colonna viene riempita con allumina per eliminare l’acqua e con zeoliti per eliminare CO2 e le altre impurezze; dopo un ciclo di circa 2-8 ore, il letto adsorbente viene rigenerato mediante deadsorbimento. Nell’impianto sono presenti due colonne uguali (in rosso nella fig. 3) che lavorano alternativamente una in adsorbimento e l’altra in deadsorbimento, per consentire una depurazione continua. Nella tecnica con scambiatori di calore reversibili, lo scambio di calore avviene attraverso una parete fra le correnti calde di aria e quelle fredde di azoto: nel condotto dove passa l’aria, a seguito del raffreddamento condensano le impurezze. A intervalli regolari viene invertita la corrente dei gas: l’azoto viene fatto passare nel condotto dove in precedenza era passata l’aria (e viceversa), desorbendo così le impurezze solide. La tecnica per adsorbimento è la più utilizzata negli impianti moderni, soprattutto quando si devono recuperare grandi quantità di azoto, che nella tecnica con gli scambiatori viene utilizzato per desorbire le impurezze (che vengono immesse nell’atmosfera). Il terzo stadio è lo scambio termico, che serve per raffreddare l’aria compressa e riscaldare i prodotti in uscita, recuperando così le frigorie. Il quarto stadio è la refrigerazione, che viene realizzata mediante conversione di energia in lavoro per espansione del gas compresso in turbina con abbassamento della pressione e della temperatura. Il quinto stadio è la distillazione criogenica, condotta utilizzando due colonne di distillazione (in verde nella fig. 3) per separare l’aria nei diversi prodotti; una colonna opera ad alta pressione (in basso), l’altra a bassa pressione (in alto). Dalla testa della prima colonna, che opera a 6 bar, esce l’azoto liquido insieme a eventuali impurezze volatili come idrogeno ed elio, mentre dal basso esce un liquido ricco in ossigeno (30-47%), che viene inviato alla seconda colonna, operante a pressione atmosferica. In questa colonna viene recuperato dal basso ossigeno puro liquido e dall’alto azoto al 99%. L’argon viene recuperato in questa seconda colonna in un punto intermedio. Le due colonne, disposte una sopra l’altra, sono inserite in un contenitore isolante per evitare le dispersioni di calore. L’ultimo stadio è la ricompressione dei prodotti gassosi ottenuti.
Attualmente vengono usati diversi tipi di processo che si differenziano per il rapporto ossigeno/azoto prodotto e per la possibilità di ottenere ossigeno liquido e/o gassoso.
Separazione dall’aria mediante adsorbimento
Questa tecnica, introdotta industrialmente nel 1970 allo scopo di produrre ossigeno per il trattamento delle acque, si basa sull’utilizzo di solidi adsorbenti, le zeoliti, che hanno la proprietà di trattenere l’azoto e lasciare passare l’ossigeno. Le zeoliti, anche note come setacci molecolari, sono alluminosilicati cristallini con strutture reticolari a base di unità tetraedriche AlO4 e SiO4 che determinano la formazione di cavità occupate da cationi. La loro formula chimica generale è Mx/n(AlO2)x(SiO2)yzH2O dove n è la valenza del catione M. Le cavità all’interno del reticolo sono connesse da canali, o pori, con diametri ben definiti e compresi tra 3 e 10 Å. La presenza di questi pori conferisce selettività molecolare, in quanto le loro dimensioni sono tali da permettere il passaggio, e quindi l’adsorbimento nelle cavità, solamente alle molecole aventi un diametro più piccolo di questi valori. Le zeoliti utilizzate come adsorbenti sono le calcio-zeoliti tipo A (Ca6[Al12Si12O48]27H2O)8 e le litio- o sodio-zeoliti tipo X (M58[Al58Si134O348]240H2O, con M=Na, Li). L’azoto si adsorbe per interazioni elettrostatiche con i cationi presenti all’interno delle cavità.
Gli impianti di separazione dell’ossigeno dall’aria per adsorbimento sono costituiti da tre recipienti identici contenenti allumina, che serve per adsorbire acqua e CO2, e zeolite per adsorbire l’azoto. In ogni recipiente si realizzano tre fasi successive: una prima fase di adsorbimento, nella quale viene introdotta aria ed esce ossigeno; una fase di decompressione, che ha luogo quando si arriva a saturazione, ossia quando la zeolite non è più in grado di adsorbire l’azoto, durante la quale escono le molecole adsorbite e viene rigenerato il materiale; una terza fase di ricompressione per preparare la successiva fase di adsorbimento. Nella fig. 4 si possono osservare i tre recipienti che si trovano rispettivamente in una delle tre fasi appena descritte. La ricompressione viene condotta con una parte dell’ossigeno ottenuto nella prima fase, per eliminare l’azoto presente in fase gassosa e non contaminare quello ottenuto nella fase successiva. Questi cicli durano circa 30 s l’uno e in ogni istante c’è sempre un recipiente che produce ossigeno per garantirne una produzione continua. I tre recipienti sono perciò uguali e i flussi vengono spostati da un recipiente all’altro mediante un sistema di valvole.
Le diverse tecniche attualmente disponibili operano tutte a temperatura ambiente e si differenziano per la metodologia utilizzata per desorbire l’azoto. La VSA (Vacuum swing adsorption) realizza l’adsorbimento a pressione leggermente superiore a quella atmosferica (1,2 bar), mentre il desorbimento avviene per trattamento sotto vuoto. Il processo PSA (Pressure swing adsorption) opera a 3-6 bar e realizza il desorbimento per semplice abbassamento della pressione. Nella VPSA (Vacuum pressure swing adsorption), infine, il desorbimento avviene per abbassamento della pressione e per introduzione del vuoto. Tutte e tre le tecniche producono ossigeno con purezza del 93-95% e argon come principale impurezza. La VSA viene realizzata per capacità da 20 a 150t/giorno, mentre la PSA per capacità da 5 a 20 t/giorno. I vantaggi di questa tecnica sono i bassi costi energetici e la possibilità di realizzare impianti in situ, cioè nel luogo dove deve essere impiegato l’ossigeno, e di mettere in marcia la produzione velocemente.
Queste tecnologie di produzione sono utilizzate nell’industria chimica, nella produzione dell’acciaio e della carta, nella depurazione delle acque e nelle biotecnologie. Allo scopo di aumentare la purezza dell’ossigeno ottenuto e quindi ampliare l’uso di questa tecnologia anche a settori quali quello medicale, del taglio dei metalli e delle celle a combustibile, sono stati messi a punto nuovi tipi di zeoliti, del tipo Ag-Li-LSX (LS sta per low silica), che possono arrivare a produrre ossigeno con purezza del 99%.
Separazione dall’aria mediante membrane
Il principio di separazione con membrane si basa sulla diversa velocità di permeazione di gas come ossigeno, biossido di carbonio e acqua rispetto all’azoto attraverso speciali membrane polimeriche. Facendo passare una corrente d’aria all’interno di un tubo le cui pareti sono costituite da una membrana polimerica, l’ossigeno, il biossido di carbonio e l’acqua passano velocemente attraverso la membrana, mentre l’azoto e l’argon, più lenti, fuoriescono dal tubo in elevate concentrazioni. Con questa tecnologia si ottiene essenzialmente ossigeno al 50% in impianti che possono avere una capacità da 1 a 500 t/giorno. Le membrane con le prestazioni migliori sono costituite da polimeri derivati da gomme siliconiche. Il vantaggio dell’utilizzo di membrane sta nella possibilità di mettere in funzione il processo immediatamente. In campo medico le membrane vengono utilizzate per soddisfare la domanda di ossigeno di singoli pazienti; questi sistemi, commercializzati con successo, arrivano a erogare flussi da 1 a 10 l/min con concentrazioni di ossigeno tra il 30 e il 40%. Per aumentare la potenzialità degli impianti si aumentano il numero dei moduli, che operano così in parallelo. L’utilizzo di questa tecnologia è attualmente molto limitato per la bassa purezza dell’ossigeno prodotto che contiene, oltre all’azoto, anche CO2 e H2O e per la bassa produttività offerta, generalmente inferiore alle 10 t/giorno. Recentemente sono state messe a punto membrane a base di ossidi che separano azoto e ossigeno ad alta temperatura (700-800 °C) e permettono di ottenere ossigeno a elevata purezza.
Generatori chimici di ossigeno
L’ossigeno può essere prodotto per decomposizione di composti inorganici quali clorati, perclorati, perossidi e superossidi. Questa tecnologia è utilizzata per la produzione di ossigeno in situ in sistemi di respirazione utilizzati, per esempio, in sottomarini, in aeroplani in caso di decompressione, in rifugi antibombe e in sistemi di respirazione d’emergenza.
I clorati e i perclorati sottoposti a riscaldamento si decompongono rilasciando ossigeno. Nel caso del clorato di sodio, che è il composto più utilizzato, le reazioni coinvolte sono le seguenti:
2Fe + 3/2O2 →-Fe2O3
[2] NaClO3 →-2NaCl + 3/2O2
4NaClO3 →-2Na2O + 2Cl2 + 5O2.
L’ossidazione del ferro libera il calore necessario per decomporre il clorato, mentre la formazione di cloro (terza reazione), estremamente tossico, è una reazione non desiderata, che però non può essere evitata. Per questo motivo nel sistema viene aggiunto anche del perossido di bario, che elimina il cloro formato.
Tra i perossidi, il più utilizzato è quello di litio; le reazioni di decomposizione e produzione di ossigeno sono le seguenti:
Li2O2 + 2H2O →-2LiOH + H2O2
[3] H2O2 →-H2O + 1/2O2
Li2O2 + CO2 →-Li2CO3 + 1/2O2.
Allo scopo di facilitare la decomposizione del perossido è necessario utilizzare dei catalizzatori a base di nichel.
Nel caso vengano utilizzati superossidi, come KO2, le reazioni coinvolte sono le seguenti:
[4] 2KO2 + H2O →-2KOH + 3/2O2
2KOH + CO2 →-K2CO3 + H2O.
In questi sistemi la presenza di tracce d’acqua innesca la reazione di decomposizione e quindi la produzione di ossigeno.
Elettrolisi dell’acqua
L’elettrolisi dell’acqua è una tecnologia attualmente utilizzata per produrre idrogeno di elevata purezza. Sono possibili diversi processi, dall’elettrolisi in ambiente alcalino, ben collaudata, a quelli più moderni che utilizzano membrane a scambio protonico PEM (Proton exchange membrane) e che sono interessanti per i minori volumi coinvolti.
Quando una corrente continua passa attraverso due elettrodi immersi in una soluzione acquosa di un elettrolita, in genere 30% KOH, all’anodo si scarica l’ossigeno e al catodo l’idrogeno. Le reazioni chimiche principali che avvengono agli elettrodi sono le seguenti:
all’anodo 2H2O →-O2 + 4H+ + 4e−
[5] al catodo 4H+ + 4e− →-2H2
reazione globale 2H2O →-2H2 + O2.
I costi dell’elettrolisi sono attualmente troppo elevati sia dal punto di vista energetico sia da quello dei materiali (elettroliti) e perciò al mondo esistono solo alcuni piccoli impianti di produzione.
Secondo uno scenario fortemente auspicato, l’idrogeno, il combustibile ideale per celle a combustibile, in futuro dovrà essere prodotto da sorgenti rinnovabili per evitare il consumo di combustibili fossili e diminuire le emissioni di gas serra. In tal caso, l’elettrolisi dell’acqua con tecnologia PEM potrebbe essere considerata adatta a tale scopo, e di conseguenza l’ossigeno diventerebbe un coprodotto della produzione di idrogeno.
Usi
In molte applicazioni che richiedono ossigeno si preferisce utilizzare l’aria. I vantaggi di questa scelta risiedono nel suo basso costo, nella più facile reperibilità, nella grande disponibilità e nella maggiore sicurezza. I vantaggi dell’utilizzo dell’ossigeno commerciale, invece, consistono nella riduzione dei volumi in gioco, nell’aumento delle velocità di reazione nei processi che dipendono dalla concentrazione di ossigeno, nell’assenza di eventuali contaminazioni o reazioni parassite da parte dell’azoto (formazione di ossidi di azoto), nella riduzione delle emissioni in aria dell’azoto residuo, che il più delle volte deve essere depurato dai contaminanti del processo con elevati costi addizionali, e, infine, nel risparmio energetico legato alla mancata perdita del calore latente associata all’emissione di azoto. Inoltre, ci sono diversi vantaggi specifici – settore per settore – che saranno esaminati nel seguito.
Le prime utilizzazioni dell’ossigeno commerciale sono state la fiamma ossiacetilenica e la medicina. Solamente dagli anni Cinquanta del XX sec. si è assistito al forte sviluppo di altre applicazioni.
Attualmente gli utilizzi dell’ossigeno sono i seguenti: (a) in processi chimici per introdurre ossigeno nelle materie prime, per realizzare più in generale reazioni di ossidazione e per aumentare l’efficienza nella distruzione dei rifiuti; (b) nella produzione del vetro; (c) in medicina per rianimare e per trattare pazienti con problemi respiratori; (d) nel taglio dei metalli; (e) nella produzione dei metalli; (f) in raffineria nella rigenerazione di catalizzatori; (g) nella produzione della cellulosa e della carta; (h) in acquicoltura; (i) nella produzione di acciaio; (l) nella depurazione dell’acqua e dei fanghi; (m) in biotecnologia, nei processi di fermentazione; (n) nella propulsione di missili.
Tuttavia, il maggiore utilizzo dell’ossigeno si ha nella produzione di acciaio e nella chimica, settori che consumano circa il 30% della produzione globale, mentre per ognuna delle altre applicazioni il consumo è di ca. il 5%. I diversi utilizzatori dell’ossigeno si differenziano per la diversa purezza richiesta, per la quantità richiesta e per la necessità o meno di produrlo in situ. Ossigeno ultrapuro è necessario nella produzione di acciaio, in alcuni settori della chimica, nella propulsione di missili e nel taglio dei metalli, mentre negli altri settori si può utilizzare aria arricchita di ossigeno od ossigeno di bassa purezza.
Produzione di acciaio
L’acciaio viene prodotto in due stadi: nel primo avviene la riduzione degli ossidi di ferro con carbone negli altiforni con produzione di ghisa, nel secondo si produce l’acciaio per purificazione (affinazione) di quest’ultima nei convertitori. Alcune reazioni esemplificative che avvengono nei due stadi sono le seguenti:
[6] nell’altoforno
C + 1/2O2 →-CO
Fe2O3 + 3CO →-2Fe + 3CO2
Fe2O3 + 3C →-2Fe + 3CO
C + CO2 →-2CO
nel convertitore
C + 1/2O2 →-CO
2P + 5/2O2 →-P2O5
Si + O2 →-SiO2.
Nell’altoforno viene utilizzata aria sia per bruciare il carbone allo scopo di fornire il calore per raggiungere le temperature richieste di 1800-2000 oC, sia per produrre CO che, insieme al carbone, agisce come riducente degli ossidi di ferro. Nel convertitore la ghisa viene trasformata in acciaio attraverso una parziale o totale eliminazione per ossidazione del carbonio, del silicio, del manganese presenti e delle altre impurezze come azoto, zolfo e fosforo. A partire dalla metà del XX sec., nei convertitori viene utilizzato solo ossigeno puro al 99,5% in alternativa all’aria. Il vantaggio di tali procedure sta nel fatto che, eliminata la presenza di azoto, il processo diventa termicamente bilanciato e non serve aggiungere combustibile addizionale per raggiungere i 1600 °C richiesti. Altri vantaggi dell’impiego dell’ossigeno puro sono la possibilità di utilizzare, a differenza del processo con aria, qualsiasi composizione di ghisa (per es. anche a basso contenuto di Si e P), di ottenere ghisa di elevata qualità, in particolare a maggiore contenuto di carbonio, e di utilizzare elevate quantità di rottami (anche più del 30%) insieme alla ghisa fusa. L’ossigeno viene insufflato nella ghisa fusa, raggiungendo così la temperatura di 1600 °C. Oltre all’acciaio fuso si formano scorie a base di ossidi e inoltre vengono emessi CO e polveri, costituite in gran parte da FeO, che richiedono l’inserimento di impianti di depurazione e di captazione. I convertitori a ossigeno più importanti sono quelli denominati LD (dalle iniziali di Lienz e Donawitz, le prime città dove è stato realizzato il processo) e OBM (Oxygen Bottom Maximilianhutte, dal nome della ditta che per prima ha realizzato il processo).
Nel processo LD, anche chiamato BOS (Basic oxygen steelmaking) o BOF (Basic oxygen furnace), l’ossigeno entra dall’alto attraverso il letto di scorie e il soffiaggio dura circa 20 minuti; l’entrata del getto crea una certa agitazione del bagno e questo facilita la formazione degli ossidi SiO2, MnO2 e FeO che danno origine alle scorie.
Il processo OBM, chiamato anche BOP (Basic oxygen process), si differenzia da quello LD perché l’ossigeno viene insufflato direttamente all’interno del bagno metallico dal basso, creando una maggiore uniformità della temperatura e aumentando perciò le rese e la qualità del prodotto.
Produzioni chimiche
L’ossidazione con aria o con ossigeno è uno dei processi più importanti per la sintesi di intermedi per l’industria chimica e viene utilizzata per le seguenti tre tipologie di reazioni: (a) introduzione dell’ossigeno in una molecola per la produzione di aldeidi, chetoni, anidridi, epossidi, acidi, composti inorganici come H2O2, H2SO4, HNO3, O3 e per la purificazione di TiO2; (b) deidrogenazione ossidativa, come la sintesi di olefine da paraffine, di diolefine da olefine e la trasformazione di alcoli ad aldeidi, con contemporanea coproduzione di acqua; (c) altre reazioni di ossidazione, come le ammonossidazioni con ammoniaca e ossigeno o le ossiclorurazioni con acido cloridrico e ossigeno, usate per introdurre rispettivamente azoto e cloro in molecole organiche.
Dal punto di vista del processo, è possibile individuare le tre seguenti tipologie che utilizzano aria od ossigeno commerciale per realizzare le sopracitate reazioni: (a) processi in fase vapore eterogenei che operano ad alta temperatura con catalizzatore solido a base di ossidi o di metalli, in gran parte di transizione; (b) processi in fase liquida omogenei che operano a bassa temperatura con catalizzatori omogenei a base di sali di metalli di transizione o di PdCl2 e CuCl2; (c) processi in fase liquida eterogenei che operano a bassa temperatura con catalizzatori solidi a base di metalli di transizione.
La sintesi di aldeidi, acidi, idroperossidi, epossidi e chetoni deve essere realizzata a bassa temperatura in fase liquida, perché si tratta di prodotti instabili; fanno eccezione i primi della serie, la formaldeide e l’ossido di etilene, che sono sufficientemente stabili da poter essere sintetizzati ad alta temperatura. La sintesi di anidridi, acidi e aldeidi alfa-insature, che sono relativamente più stabili, viene realizzata in fase vapore ad alta temperatura. Infine, reagenti con gruppi funzionali instabili, come per esempio gli zuccheri, sono ossidati a bassa temperatura con catalisi omogenea oppure eterogenea.
L’ossidazione è caratterizzata dalla presenza di diversi problemi connessi alla sicurezza, come l’esistenza di limiti di infiammabilità in aria (Tavola II), la possibilità di esplosione del reattore (run away) per la forte esotermicità delle reazioni e la possibile autoaccensione dei reagenti e dei prodotti ad alta temperatura nelle linee che li trasportano. Per tutte le sostanze utilizzate industrialmente sono noti e riportati nelle relative schede di sicurezza i limiti di infiammabilità in aria. Per composizioni interne a questo intervallo, in presenza di un innesco, i reagenti possono infiammarsi e quindi è necessario realizzare i processi con concentrazioni fuori da questi limiti. Il secondo aspetto della sicurezza è il run away del reattore, che consiste in un innalzamento incontrollato della temperatura, causato dall’innesco di reazioni consecutive di ossidazioni più esotermiche di quella principale. Il run away viene tenuto sotto controllo con una opportuna scelta del reattore, per asportare in maniera efficace il calore di reazione. Il terzo aspetto della sicurezza è l’autossidazione delle molecole organiche in presenza di ossigeno ad alta temperatura, in genere sopra i 250 °C. Questo pericolo viene scongiurato raffreddando immediatamente i prodotti all’uscita del reattore ed evitando di preriscaldare i reagenti a temperature superiori ai 250 °C in presenza di ossigeno in tubi vuoti; il preriscaldamento deve essere condotto solo in presenza del catalizzatore, che blocca le reazioni di combustione radicaliche.
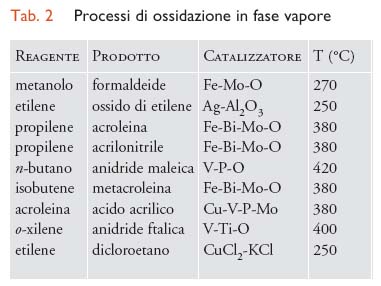
Processi in fase vapore. - Nei processi catalitici eterogenei che avvengono in presenza di un catalizzatore solido ad alta temperatura superiore ai 250 °C, l’aria è l’ossidante più utilizzato. I processi di ossidazione eterogenei più importanti sono riportati nella tab. 2.
Nei processi di ossidazione eterogenei, allo scopo di evitare il run away, si utilizzano reattori a fascio tubiero, costituti da tubi di piccole dimensioni (ca. 3,5 cm di diametro) riempiti di pasticche di catalizzatore e immersi in un liquido refrigerante per asportare in maniera efficace il calore di reazione, oppure reattori a letto fluido, nei quali il calore di reazione viene asportato da un refrigerante ad acqua immerso nel letto catalitico costituito dal catalizzatore in polvere.
Sono stati ipotizzati tre meccanismi di ossidazione nei quali l’ossigeno molecolare gioca un ruolo diverso nel processo catalitico. Nel meccanismo redox il reagente viene ossidato dal catalizzatore e l’ossigeno molecolare interviene solo per riossidare il catalizzatore ridotto. Questo è il meccanismo proposto per molte reazioni selettive; come esempio è riportata qui di seguito l’ossidazione del metanolo:
[7] CH3OH + MoO3 →-CH2O + MoO2 + H2O
MoO2 + 1/2O2 →-MoO3.
Nel meccanismo Rideal, ipotizzato per l’ossidazione dell’etilene a epossido, l’ossigeno interagisce prima con la superficie del catalizzatore dando origine a specie perossidiche molto attive, che interagiscono successivamente con l’etilene formando l’epossido, e altre specie radicaliche di ossigeno responsabili di reazioni parassite a CO2. Il meccanismo proposto è illustrato qui di seguito:
[8] formula.
Nel meccanismo Langmuir-Hinshelwood, ipotizzato per l’ossidazione degli idrocarburi a CO2, sia l’ossigeno che il reagente vengono attivati dal catalizzatore per formare specie radicaliche, che successivamente interagiscono fra loro portando all’ossidazione totale. Un esempio di questo meccanismo è riportato qui di seguito, dove si vede l’attivazione dell’ossigeno molecolare a specie atomiche radicaliche e l’attivazione dell’etilene con apertura del doppio legame:
[9] CH2 = CH2 + Pt → CH2CH2Pt
2Pt + O2 → 2PtO−
−CH2−CH2Pt + 6Pt−O− → 2CO2 + 2H2O + 6Pt.
È possibile, inoltre, individuare processi industriali diversi che si differenziano per la metodologia utilizzata allo scopo di evitare l’infiammabilità dei reagenti. Ci sono processi come l’ossidazione del propilene ad acroleina che utilizzano aria come ossidante e operano in reattori a fascio tubiero con una concentrazione dei reagenti più bassa del limite inferiore di infiammabilità. Il vantaggio dell’utilizzo dell’aria è il basso costo dell’ossidante, mentre gli svantaggi sono connessi alla scarsa produttività, dovuta alla bassa concentrazione di reagenti utilizzata, e alla presenza di elevate quantità di azoto nelle emissioni in atmosfera che devono essere depurate. Alcuni processi, come l’ossidazione del n-butano ad anidride maleica, utilizzano aria come ossidante, ma operano in reattori a letto fluido che consentono di lavorare con concentrazioni all’interno dell’intervallo di infiammabilità e quindi maggiori di quelle utilizzabili nei letti fissi a fascio tubiero. In un letto fluido i reagenti si incontrano con l’ossigeno solo all’interno del letto catalitico dove, grazie alla presenza del catalizzatore in polvere, non ci sono problemi di infiammabilità come nei tubi vuoti. Ci sono poi processi che operano con elevate concentrazioni di reagente e, al fine di rimanere fuori dai limiti di infiammabilità, operano con aria diluita con azoto. Per esempio, nei vecchi processi in aria per l’ossidazione del metanolo si operava con 5,7% di metanolo, mentre nei processi moderni si opera con O2 al 10% utilizzando 9% di metanolo, aumentando così notevolmente la produttività del processo. Altri processi utilizzano due reattori a letto mobile: nel primo, il catalizzatore ossida il reagente puro e nel secondo il catalizzatore ridotto viene riossidato dall’aria per essere di nuovo trasportato al primo reattore. Questo processo era stato realizzato per l’ossidazione di n-butano ad anidride maleica, ma recentemente è stato abbandonato per problemi connessi alla movimentazione di grandi quantità di catalizzatore. Il principale vantaggio di questo processo era l’intrinseca sicurezza, dovuta al fatto che l’idrocarburo e l’ossigeno non si incontravano mai, e quindi non c’erano problemi di infiammabilità; altri vantaggi erano l’elevata produttività e la concentrazione del prodotto a valle del reattore, che facilitava la sua separazione.
Ci sono, infine, processi che operano con ossigeno commerciale, come l’ossidazione di etilene a epossido e l’ossiclorurazione dell’etilene. L’ossidazione di etilene a ossido di etilene viene oramai realizzata nella quasi totalità dei casi con ossigeno. Questo processo opera con una concentrazione di etilene del 25-30% e con una concentrazione di ossigeno del 7%; come inerte per il completamento a 100 è utilizzata la CO2 che si forma durante la reazione. Un processo in aria dovrebbe operare con concentrazioni di idrocarburo inferiori al 5% per collocarsi fuori dai limiti di infiammabalità inferiore, mentre quello attuale opera con concentrazioni di idrocarburo più elevate rispetto al limite superiore di infiammabilità. I motivi che hanno spinto a operare in eccesso di etilene e difetto di ossigeno sono legati al fatto che la selettività in ossido di etilene diminuisce fortemente per una conversione dell’etilene superiore al 60%; dovendo quindi operare a bassa conversione, rimane una elevata quantità di etilene non reagito che deve essere riciclato. La presenza di azoto, se si utilizzasse aria, renderebbe costosissimo il riciclo dell’etilene, dal quale è difficilmente separabile, e per questo motivo si opera con ossigeno commerciale ultrapuro.
L’ossiclorurazione è attualmente realizzata sia con aria che con ossigeno commerciale ultrapuro. Diversi sono i motivi che spingono a utilizzare ossigeno, che potrebbero risultare validi anche per altri processi ancora realizzati con aria. La reazione di ossiclorurazione è la seguente:
[10]
CH2=CH2 + 2HCl + 1/2O2 → ClCH2−CH2Cl + H2O.
Attualmente sono impiegati due tipi di processi di ossiclorurazione: quelli a letto fisso a fascio tubiero e quelli a letto fluido. Entrambi utilizzano sia l’aria che l’ossigeno, ma per quelli a letto fisso prevale l’utilizzo dell’ossigeno, che in questo caso presenta maggiori vantaggi. Questa reazione è un esempio emblematico dei vantaggi dell’utilizzo dell’ossigeno in alternativa all’aria. I processi con ossigeno operano con eccesso di etilene, perché la sua conducibilità termica è molto superiore a quella dell’azoto, il gas presente in maggiori quantità nei processi ad aria, e questo facilita lo scambio termico contribuendo a diminuire i picchi di temperatura all’interno del letto catalitico, aumentando la selettività in dicloroetano e la vita del catalizzatore. Questo vantaggio non esiste nel letto fluido, dove il controllo della temperatura è già molto efficace. Il motivo per il quale i processi che utilizzano etilene in eccesso operano con ossigeno puro è che il riciclo dell’etilene non convertito è in questo caso più agevole, come già osservato nel caso della ossidazione dell’etilene a epossido. Nella fig. 5 è riportato il flow sheet di un processo di ossiclorurazione di etilene in un reattore a letto fluido. Si può notare che dopo la separazione del prodotto e dei sottoprodotti l’etilene non reagito viene riciclato al reattore. Un ulteriore vantaggio nell’uso dell’ossigeno, che si manifesta sia nei processi a letto fisso che in quelli a letto fluido, risiede nella forte diminuzione del gas da scaricare in atmosfera, essenzialmente costituito da azoto, che deve essere trattato, con elevati costi, per eliminare le tracce dei composti alogenati altamente tossici in esso presenti. La riduzione dei volumi nei processi con l’ossigeno può risultare di 20-100 volte rispetto ai processi in aria.
Processi in fase liquida. - I processi più importanti che operano in fase liquida sono riportati nella tab. 3. I processi di ossidazione del n-butano e dell’isobutano operano solo con ossigeno, quelli di ossidazione del cicloesano e dell’etilbenzene solo con aria, mentre gli altri processi possono operare sia con aria che con ossigeno. Nei processi in fase liquida, il problema del controllo della temperatura e del run away viene risolto in maniera efficace operando alla temperatura di ebollizione del solvente o del reagente o del prodotto. I problemi di infiammabilità non esistono in fase liquida, ma si incontrano a valle del reattore in fase gassosa, in genere nel condensatore. È sufficiente comunque lavorare con ossigeno con 3% di azoto per essere certi di operare fuori dai limiti di infiammabilità in fase gassosa, oppure operare con aria o con aria arricchita di ossigeno. In questi processi, l’aria è utilizzata come ossidante quando la reazione è sotto controllo chimico e la sua velocità non dipende dalla pressione parziale di ossigeno. Nel caso, invece, in cui lo stadio lento sia il trasferimento di massa, e quindi la velocità di reazione dipende dalla pressione parziale di ossigeno, è più conveniente operare con ossigeno o con aria arricchita di ossigeno.
I principali meccanismi di ossidazione per processi in fase liquida sono quello radicalico, quello radicalico-redox e quello redox. L’ossidazione radicalica avviene con il seguente meccanismo:
In2 → 2In· stadio di iniziazione
In· + RH → InH + R· stadio di iniziazione
R· + O2 → RO2· stadio di propagazione
[11] RO2· + RH → RO2H + R· stadio di propagazione
ROOH → RO· + OH· stadio di ramificazione
R· + R· → R2 stadio di terminazione
R· + RO2· → ROOR stadio di terminazione
In2 è un iniziatore che può essere costituito dallo stesso reagente o da tracce di prodotto riciclato, mentre RO2H è un idroperossido. Nel caso sia questo il prodotto desiderato, la sua formazione non necessita di un catalizzatore. Lo stadio di ramificazione è da evitare perché potrebbe portare al run away del reattore; a questo scopo si tiene bassa la conversione, ossia la concentrazione dell’idroperossido, e anche la temperatura per evitare la sua decomposizione. Anche gli stadi di terminazione sono da evitare, perché portano alla formazione di sottoprodotti; ciò si realizza mantenendo sempre una presenza di ossigeno in fase liquida, in maniera che esso possa reagire con i radicali idrocarburici. Nel caso in cui il prodotto desiderato sia non l’idroperossido, ma un chetone o un acido, si introducono catalizzatori che inducono la decomposizione dell’idroperossido formatosi per via radicalica, per esempio sali di cobalto o di altri metalli di transizione, che agiscono come catalizzatori redox secondo il seguente schema:
[12] Co2+ + ROO H-→-RO· + OH− + Co3+
Co3+ + ROOH-→-RO2· + H+ + Co2+.
Le reazioni che avvengono con meccanismo redox utilizzano come sistema catalitico PdCl2-CuCl2. La reazione più comune è l’ossidazione di etilene ad acetaldeide, che avviene con il seguente meccanismo:
[13] CH2 = CH2 + Pd(II)Cl2 + H2O → CH3CHO +
+ Pd(0) + 2HCl
Pd(0) + 2CuCl2 → Pd(II)Cl2 + 2CuCl
2CuCl + 1/2O2 + 2HCl → 2CuCl2 + H2O.
Questo sistema catalitico viene utilizzato anche per la produzione di metiletilchetone da 1-butene e di acetato di vinile da etilene e acido acetico. Questi processi possono essere realizzati con un solo reattore utilizzando ossigeno puro (nel qual caso avvengono contemporaneamente tutte le reazioni sopra riportate), per permettere il riciclo dell’etilene non convertito, oppure con un processo a due reattori utilizzando aria. In quest’ultimo caso, nel primo reattore viene fatto interagire l’etilene puro con il catalizzatore per dare l’acetaldeide e il catalizzatore ridotto, riciclando l’etilene non reagito, e nel secondo reattore viene riossidato con aria il catalizzatore ridotto, con produzione di azoto come coprodotto.
Produzione di idrogeno e gas di sintesi. - I processi di ossidazione del metano, del carbone e di biomasse per ottenere H2 o gas di sintesi (CO+H2) sono sempre realizzati con ossigeno puro per evitare di contaminare i prodotti gassosi con l’azoto residuo, di difficile separazione.
Il processo di ossidazione parziale più conosciuto è la conversione del gas naturale, contenente principalmente metano e altri idrocarburi leggeri, in gas di sintesi secondo la reazione:
[14] CH4 + 1/2O2 → -CO + 2H2.
Mentre tutte le reazioni di combustione (cioè di ossidazione totale) forniscono calore come prodotto di principale interesse e vapore acqueo e anidride carbonica come sottoprodotti da smaltire, le reazioni di ossidazione parziale producono principalmente gas di sintesi, il quale ha diversi utilizzi. Per esempio, esso può essere bruciato in una turbina a gas per la produzione di energia. L’applicazione che più valorizza il gas di sintesi è però, come dice il nome, il suo uso come sostanza di partenza per la produzione di intermedi chimici essenziali (metanolo, dimetiletere, paraffine). Nei processi industriali occorre operare una distinzione tra due tipi di ossidazione parziale: quella termica e quella catalitica. La prima viene condotta a temperature superiori ai 1200 °C, mentre nella seconda si impiega un catalizzatore che permette di ottenere lo stesso rendimento lavorando a temperature inferiori (intorno a 800-900 °C). La scelta sulla tecnologia da impiegare è fortemente vincolata dal contenuto di zolfo nel gas naturale. Al di sotto di 50 ppm può essere utilizzato il processo catalitico, mentre un contenuto di zolfo più elevato rende il processo catalitico impraticabile perché lo zolfo avvelenerebbe i catalizzatori commerciali a base di nickel supportato su ossidi misti di magnesio e alluminio; in questi casi, pertanto, deve essere impiegato il processo termico.
La gassificazione è un processo termochimico di ossidazione parziale a temperature superiori a 700 °C, nel quale composti carboniosi (combustibili fossili, biomasse) vengono convertiti in gas di sintesi mediante reazione con un agente ossidante (ossigeno, aria o loro miscele con vapore acqueo) in difetto stechiometrico. Idealmente, dalla gassificazione si dovrebbe ottenere solo una corrente gassosa e ceneri (residui inorganici). In realtà, si ottengono anche carbone incombusto e peci (composti aromatici refrattari e idrocarburi pesanti) che, trasportati assieme al gas, condensano nelle linee di impianto causando seri problemi di intasamento. La nascita della tecnologia di gassificazione risale alla fine del XVIII sec., quando il gas prodotto nelle fornaci di carbon fossile (‘gas d’aria’ se l’agente ossidante era aria, ‘gas d’acqua’ nel caso l’ossidazione fosse condotta con vapore acqueo) veniva utilizzato sia per il riscaldamento cittadino che per l’illuminazione pubblica (il ‘gas illuminante’ scoperto da Philippe Lebon nel 1786 e utilizzato ampiamente nei decenni successivi fino all’era della lampadina e dell’energia elettrica). La gassificazione del carbon fossile è quindi oggi ben nota e adattabile all’utilizzo di carbonio rinnovabile, anche se la biomassa presenta una densità energetica inferiore e contiene più acqua, fattori che ne riducono il rendimento energetico.
Il processo di gassificazione per la produzione simultanea di calore ed energia (cogenerazione) ha un’efficienza superiore al processo di combustione, ma complicazioni impiantistiche ne limitano l’utilizzo. Gli impianti più diffusi utilizzano cicli combinati integrati di gassificazione (IGCC, Integrated gasification combined cycle). Questa tecnologia, nata negli anni Settanta, è divenuta commerciale solo negli anni Novanta. Il sistema consiste nella produzione di gas di sintesi mediante gassificazione in un reattore a letto fluido, ottimale per grandi economie di scala. Tale gas – dotato di un alto potere calorifico, soprattutto se la gassificazione è condotta con ossigeno e vapore –viene bruciato in una turbina a gas operante a circa 1000 °C producendo energia elettrica. Nella configurazione a ciclo combinato, il calore uscente dalla turbina a gas viene utilizzato per riscaldare del vapore a circa 400 °C, che alimenta una seconda turbina per una ulteriore produzione di energia elettrica. Il vapore uscente dalla seconda turbina, a una temperatura di circa 100 °C, viene convogliato per il riscaldamento degli edifici vicini (teleriscaldamento). Impianti di questo tipo possono raggiungere una efficienza energetica complessiva del 90%, con una efficienza elettrica del 40-45%, laddove le moderne centrali elettriche a combustione e cogenerazione non superano una efficienza complessiva del 70% con una efficienza elettrica non superiore al 35%. Negli ultimi anni, la ricerca sui processi di gassificazione si è orientata da un lato verso l’impiego di biomassa e di rifiuti plastici in alternativa ai combustibili fossili, dall’altro verso la produzione di idrogeno per pile a combustibile e di idrocarburi liquidi per autotrazione (aggiungendo un impianto di Fischer-Tropsch a valle del gassificatore) al posto della produzione di energia elettrica.
Produzione di inorganici. - Nell’ambito della preparazione di materiali inorganici, l’ossigeno commerciale è utilizzato nella produzione del biossido di titanio, TiO2, mentre in tutti gli altri processi è utilizzata aria. TiO2 puro, utilizzabile come pigmento bianco, può essere preparato da TiO2 contaminato da altri elementi quali V, Si, Ca, Mg e Zr sfruttando le seguenti reazioni:
[15] TiO2 + C + 2Cl2 →-TiCl4 + CO2
TiCl4 + O2 →-TiO2 + 2Cl2.
In presenza di cloro tutte le impurezze presenti nel-l’ossido a temperature di 800-1200 °C si trasformano in cloruri, che si possono poi eliminare facilmente a bassa temperatura per precipitazione e distillazione frazionata. Il TiCl4 ultrapuro cosí ottenuto viene ossidato di nuovo con ossigeno a TiO2 ultrapuro a una temperatura fra 900 e 1400 °C e il cloro formato viene riciclato al primo reattore per interagire ancora con nuovo TiO2 da purificare. L’utilizzo dell’ossigeno puro al posto dell’aria è necessario perché in presenza di azoto sarebbe difficile riciclare il cloro.
L’acqua ossigenata, H2O2, si produce in grandi quantità per reazione di antraidrochinone con aria, con formazione di antrachinone, che, successivamente, viene ridotto di nuovo ad antraidrochinone in presenza di catalizzatori a base di Pd. L’ozono, O3, viene prodotto facendo passare aria attraverso un arco elettrico. L’ossidazione di SO2 a SO3 per produrre successivamente l’acido solforico, H2SO4, viene realizzata per ossidazione in aria in presenza di catalizzatori a base di V2O5 mediante reattori a strati adiabatici di largo diametro, con raffreddamento intermedio fra i diversi strati. Questi reattori sono utilizzati solo in questo processo, nel quale non sono presenti problemi di run away perché non c’è possibilità di reazioni consecutive, come avviene invece in tutte le reazioni organiche, dove è sempre possibile la formazione di CO2.
L’ossidazione di ammoniaca, NH3, a monossido di azoto, NO, per la produzione successiva di acido nitrico, HNO3, viene condotta con aria utilizzando reti di Pt-Rh, sulle quali si opera a bassissimi tempi di contatto (molto inferiori a quelli dei processi di ossidazione di molecole organiche), per evitare la formazione di azoto.
Sbiancamento della cellulosa
Esistono diversi metodi di lavorazione del legno per fabbricare la carta, il più semplice dei quali è quello termomeccanico che fornisce però un prodotto qualitativamente scadente. Il metodo più utilizzato, invece, che combina buona qualità e prezzo contenuto, è quello generalmente conosciuto come metodo Kraft.
In questo processo il legno viene tagliato in pezzi e cotto in soda caustica a una temperatura inferiore ai 100 °C, in modo da eliminare la maggior parte della lignina che con il tempo tenderebbe a ingiallirsi se posta a diretto contatto con la luce del Sole. Lo sbiancamento successivo viene effettuato in seguito col cloro, al fine di dissolvere eventuali residui della stessa lignina.
Nell’ottica di un miglioramento delle problematiche dello sbiancamento tradizionale legate all’inquinamento dell’acqua si è esplorata la possibilità di utilizzare ossigeno. La specie attiva nel processo di delignificazione con ossigeno è l’anione idroperossido: la reazione inizia con l’estrazione da parte dell’ossigeno di un atomo di idrogeno dalla lignina con la conseguente formazione di un radicale organico che può in seguito generare un perossido:
[16] RH + O2 →-R∙ + HOO∙
RH + HOO∙ →-R∙ + H2O2.
Il risultato è che le catene laterali della lignina contenenti le strutture α-carbonile e α-carbinolo vengono eliminate per conversione rispettivamente ad acidi liberi e ad aldeidi; inoltre si verifica l’apertura dell’anello, con concomitante formazione dei gruppi acidi dicarbossilici che rendono i voluminosi frammenti della lignina solubili in un mezzo alcalino acquoso. I prodotti di reazione vengono in seguito sciacquati via dalle fibre di cellulosa, ed essendo liberi da cloro vengono inviati al sistema di recupero chimico.
Trattamento delle acque
Il processo del fango attivato è un processo biologico di depurazione dei liquami che, mediante l’attività di una flora batterica attiva, permette di convertire la materia organica solubile in biomassa solida e removibile mediante filtrazione o gravità. L’aerazione artificiale continua rifornisce ossigeno ai microrganismi, sottoponendo il liquame a una intensa agitazione artificiale in modo che la massa flocculante non possa accumularsi sul fondo del bacino, dove i microrganismi morirebbero per mancanza di ossigeno.
Attualmente è utilizzato ossigeno puro nel processo UNOX (Union Carbide) in tutto il mondo per il trattamento delle acque di rifiuto urbane e industriali. Si tratta di un sistema a ossidazione in multistadio: le acque reflue e il fango attivato vengono a contatto in una serie di stadi di miscelazione gas-liquido in equicorrente. Il sistema opera essenzialmente a pressione ambientale con ossigeno gassoso ad alta purezza: le acque di scarico e il fango riciclato vengono alimentati al primo stadio e fluiscono in contatto continuo in equicorrente per tutti gli stadi successivi.
Acquicoltura
L’ossigeno è usato con profitto in acquicoltura per ottenere acqua di elevata qualità, risultando efficace contro batteri, virus, funghi e spore, ed è quindi una buona alternativa all’utilizzo del cloro e dell’ozono. In acquicoltura l’acqua, il cibo e l’ossigeno sono tre fattori essenziali, ma la concentrazione di ossigeno è quello più critico, perché la sua solubilità è bassa e dipendente dall’agitazione, e inoltre l’ossigeno è consumato dai pesci, dal placton e dagli altri organismi. Occorre quindi introdurre continuamente ossigeno e misurarne la concentrazione, per non scendere sotto i valori minimi di 5 ppm, requisito minimo per il nutrimento dei pesci, e non oltrepassare quelli massimi, circa 15 ppm, oltre i quali l’ossigeno diventa tossico. Aumentando il contenuto in ossigeno aumenta il rapporto di conversione del cibo nei pesci e diminuiscono le malattie. L’aggiunta di ossigeno, quindi, contribuisce a diminuire il tasso di mortalità e ad aumentare la densità di popolazione.
Medicina
L’ossigeno trova ampio uso in medicina per finalità terapeutiche, in rianimazione e, in associazione con altri gas, nell’anestesia. Le problematiche di respirazione sono associate ai disturbi che si possono verificare nello scambio gassoso, O2-CO2, tra gli alveoli e il sangue nei capillari polmonari. La concentrazione di ossigeno nell’aria inspirata può essere ottimizzata mediante cannule nasali e cateteri, soluzioni che rendono in maniera ottimale anche nel caso in cui il paziente respiri con la bocca. Nell’eventualità in cui si renda necessaria un’ossigenazione più spinta delle arterie, con un flusso di 3-5 l/min, si preferisce optare per altre tecniche in quanto in questo caso l’ossigenazione diretta senza umidificazione avrebbe un effetto disidratante e irritante sulle membrane della mucosa nasale. La maschera di Venturi permette la somministrazione di una miscela di aria e ossigeno a concentrazioni costanti (24, 28, 35, 40% di O2): si tratta, però, di una soluzione poco confortevole in quanto la maschera deve essere rimossa per mangiare e bere. Nella necessità di somministrare quantità di ossigeno elevate (40-80%) a pazienti non intubati si utilizzano generalmente maschere con bombola annessa: anche in questo caso, però, la necessità di indossare al meglio la maschera per evitare perdite ne rende l’uso difficoltoso per periodi lunghi. Nel caso la terapia debba essere condotta domiciliarmente, si hanno tre possibilità: l’uso di bombole di ossigeno compresso utilizzabili mediante lunghe cannule nasali che permettono un minimo di deambulazione in casa; l’uso di piccole bombole che per il peso ridotto possono essere trasportate mediante un apposito zaino, soluzione economicamente più onerosa; il ricorso a concentratori di ossigeno, che rappresentano sicuramente l’opzione più economica.
Combustioni diverse
Come si è già detto, in molte combustioni industriali – utilizzate per la produzione di vetro, metalli non ferrosi (quali rame, zinco e piombo) e cemento, in raffineria per rigenerare i catalizzatori di cracking e nel taglio dei metalli – come agente ossidante viene solitamente scelto, al posto dell’aria, l’ossigeno commerciale o l’aria arricchita di ossigeno. Ciò consente di evitare la produzione di NOx , di aumentare la temperatura di fiamma, di diminuire il consumo di combustibile e la dimensione degli impianti. Per esempio, nella produzione del vetro l’ossigeno commerciale contribuisce alla riduzione del consumo di energia per il 30-50%, poiché una gran parte dell’energia viene assorbita dall’azoto in uscita. L’uso di aria arricchita di ossigeno permette, inoltre, di ottenere un vetro di migliore qualità e determina anche un aumento della vita degli impianti.
Bibliografia
Arpentinier 2001: Arpentinier, Philippe - Cavani, Fabrizio - Trifirò, Ferruccio, The technology of catalytic oxidations, Paris, Technip, 2001.
Franz, Sheldon 2000: Franz, Gerhard - Sheldon, Roger A., Oxidation, published online: 15 june, 2000 (anche in: Ullmann’s Encyclopedia of industrial chemistry, 7. ed., Weinheim, Wiley-VCH, 2008
http://mrw.interscience.wiley.com/emrw/9780471238966/home/, last updated: 22 april 2008).
Hansel 2005: Hansel, James G., Oxygen, updated by staff, published online: 13 may, 2005 (anche in: Kirk-Othmer Encyclopedia of chemical technology, Hoboken [N.J.], Wiley, 2001
http://mrw.interscience.wiley.com/emrw/9780471238966/home/, last updated: 17 march 2008).
Mausteller 2000: Mausteller, John W., Oxygen-generation systems, published online: 4 december, 2000 (anche in: Kirk-Othmer Encyclopedia of chemical technology, Hoboken [N.J.], Wiley, 2001
http://mrw.interscience.wiley.com/emrw/9780471238966/home/, last updated: 17 march 2008).
Rajendren 2007: Rajendren, Richard B., Water treatment, Aeration, published online: 5 january, 2007 (anche in: Kirk-Othmer Encyclopedia of chemical technology, Hoboken [N.J.], Wiley, 2001
http://mrw.interscience.wiley.com/emrw/9780471238966/home/, last updated: 17 march 2008).
Singley, Robinson 2006: Singley, J. Edward - Robinson, James, Water treatment, updated by staff, published online: 15 september, 2006 (anche in: Kirk-Othmer Encyclopedia of chemical technology, Hoboken [N.J.], Wiley, 2001
http://mrw.interscience.wiley.com/emrw/9780471238966/home/, last updated: 17 march 2008).
Tavola I
Proprietà chimico-fisiche
L’ossigeno è un elemento non metallico, ha come simbolo O, appartiene al sedicesimo gruppo della tavola periodica degli elementi e ha numero atomico 8. In condizioni standard è un gas biatomico, inodore, incolore e insapore; ha peso atomico 15,9994 e densità 1,326 kg/m3 (a 21,1 °C). Si scioglie nella misura di 3,08 cm3 in 100 cm3 di acqua a 20 °C, valore che scende a 2,08 cm3 a 50 °C. A pressione atmosferica condensa a -183 °C, dando un
liquido mobile blu e paramagnetico, la cui viscosità è 1/5 di quella dell’acqua, e solidifica a -218,78 °C in un solido blu chiaro ancora formato da molecole paramagnetiche O2.
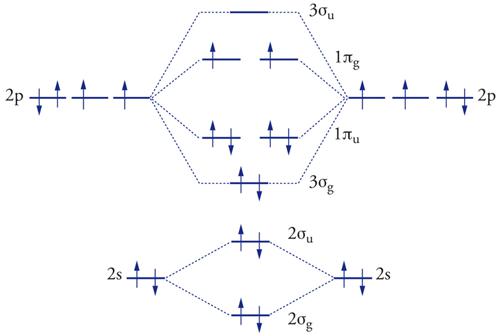
La configurazione elettronica dell’atomo di ossigeno è 1s22s22p4. È, dopo il fluoro, l’elemento della tavola periodica con più elevate elettronegatività e affinità elettronica. Secondo la descrizione degli orbitali molecolari, la configurazione elettronica della molecola biatomica O2 è 1σg2 1σu22σg22σu23σg21πu41πg2 , dove gli orbitali molecolari 1σ e 2σ sono il risultato della combinazione lineare degli orbitali atomici 1σ e 2σ, l’orbitale molecolare 3σg è la combinazione in fase degli orbitali 2p dell’ossigeno atomico in direzione s, gli orbitali molecolari 1πg e 1πu sono le combinazioni fuori fase e in fase degli orbitali atomici 2p con simmetria π.
La molecola di O2 ha tre diversi stati energetici. Lo stato energetico fondamentale 3∑g- è uno stato di tripletto e prevede 1 legame σ a 2 elettroni (3σg )2 e 2 legami π a 3 elettroni (1πu)2 (1πg)1; dunque, 2 elettroni con lo stesso spin occupano uno ciascuno i 2 orbitali πg (fig. 1). Il comportamento paramagnetico dell’ossigeno è spiegato dalla presenza di questi 2 elettroni spaiati. Per descrivere questa situazione la teoria del legame di valenza prevede la risonanza tra 2 strutture, una a singolo e l’altra a triplo legame, entrambe con elettroni non accoppiati.
Si conoscono 3 strutture allotropiche dell’ossigeno: biatomica, O2, che si trova normalmente nell’aria; triatomica, O3, nota come ozono; la rara e instabile struttura tetratomica, O4, che degrada molto rapidamente a ossigeno bimolecolare. Dei 3 isotopi stabili dell’ossigeno (numero di massa 16, 17, 18) quello con numero di massa 16 costituisce il 99,759 % dell’ossigeno presente in natura; si conoscono, inoltre, altri 4 isotopi (14, 15, 19, 20), instabili, con tempi di decadimento inferiori ai tre minuti.
Tavola II
Aspetti legati alla sicurezza
L’ossigeno reagisce con tutti gli elementi eccetto l’elio, l’argon e il neon. Polveri metalliche e organiche, gas, vapori, liquidi e nebbie possono infiammarsi in presenza di ossigeno e di un innesco (scintilla, fiamma, punti caldi, scariche elettriche ed elettrostatiche, onde d’urto, reazioni chimiche con impurezze) reagendo in maniera esplosiva,
attraverso reazioni di ossidazione radicaliche ramificate a catena. La facilità a infiammarsi dipende principalmente dal tipo di sostanza e dalla concentrazione di ossigeno. I gas e i vapori si infiammano in presenza di un innesco se la composizione del sistema cade all’interno di un intervallo di concentrazioni compreso tra una concentrazione
minima, chiamata limite di infiammabilità inferiore (Li), e una massima, chiamata limite di infiammabilità superiore (Ls), espressi in % in volume della sostanza combustibile rispetto all’ossidante (per es. l’aria). Questi limiti dipendono dal tipo di gas o vapore, dalla concentrazione dell’ossigeno, dalla temperatura e dalla pressione, dalla
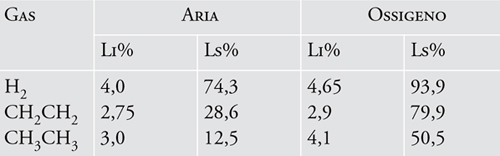
eventuale presenza di un inerte (e dalla sua natura) e di altri combustibili. L’energia necessaria per l’innesco dipende dal tipo di molecola; posto pari a 1 il valore per l’idrogeno, esso è 10 per il benzene e 100 per l’ammoniaca (l’idrogeno si infiamma più facilmente del benzene e questo più facilmente dell’ammoniaca). Nella tab. 1 sono riportati i limiti di infiammabilità nell’aria e nell’ossigeno per alcuni gas. Il limite inferiore in aria ha generalmente un valore compreso tra 1% e 6 %, mentre quello superiore è più variabile, con valori tipici che cadono tra 7 % e 60 %e punte fino al 100 %. Dalla tabella si può osservare che mentre il limite inferiore non varia molto passando dall’aria
all’ossigeno puro, quello superiore aumenta in maniera significativa, allargando in tal modo l’intervallo di infiammabilità. In un diagramma triangolare (fig. 1) ai cui vertici corrisponde una concentrazione del 100 % rispettivamente del combustibile, dell’ossigeno e dell’inerte (N2), esiste una vasta zona, a forma di campana (chiamata campana di infiammabilità), al cui interno il combustibile si può infiammare in presenza di un innesco.
L’infiammabilità di un liquido è dovuta ai suoi vapori, che in presenza di aria possono formare miscele che si infiammano a seguito di un innesco. Viene chiamata temperatura di flash point Tfp (o semplicemente flash point o ancora punto di infiammabilità) la temperatura alla quale i vapori emessi in aria hanno una concentrazione tale da infiammarsi in presenza di un’innesco; questa concentrazione, in genere, coincide con il limite inferiore di infiammabilità dei vapori. Il punto di infiammabilità si ottiene sperimentalmente misurando la temperatura alla quale, ponendo una fiamma sopra la superficie di un liquido e riscaldando quest’ultimo gradualmente, si osserva un flash, ossia avviene l’accensione. Sono utilizzati due metodi: il metodo con tazza chiusa e quello con tazza aperta. Il primo evita che i vapori sfuggano e, quindi, porta a misurare un flash di qualche grado inferiore al secondo. Dato che i due
metodi forniscono risultati diversi, bisogna sempre specificare con quale metodo è stato ottenuto un dato valore di flash point, e questo viene fatto generalmente usando le abbreviazioni cc (closed cup) e oc (open cup). Per esempio, i flash point cc del metanolo e dell’acetone sono, rispettivamente, 12 °C e -17 °C, mentre i corrispondenti
oc sono 16 °C e -9 °C. Questi valori possono essere confrontati
con i rispettivi punti di ebollizione, pari a 8,5 e -22 °C.
Sono definiti liquidi altamente infiammabili all’aria quelli che hanno un punto di infiammabilità inferiore a 0 °C e un punto di ebollizione inferiore o uguale a 35 °C, facilmente infiammabili quelli il cui punto di infiammabilità è fra 0 °C e 21 °C e infiammabili quelli il cui punto di infiammabilità è compreso tra 21 °C e 55 °C. Liquidi non infiammabili possono diventare pericolosi se formano nebbie a causa di turbolenze nelle apparecchiature e possono esplodere, come i vapori e i gas, in presenza di aria e di un innesco quando le dimensioni delle gocce sono inferiori a 0,5-10 micron e le concentrazioni sono superiori a un valore minimo (per gocce piccole il valore minimo coincide con quello dei vapori) e inferiori a un valore massimo. Le nebbie si formano nei processi di nebulizzazione
di liquidi o di condensazione di vapori (che hanno luogo per esempio nelle colonne di distillazione).
Sospensioni gassose di polveri di metalli, di sostanze organiche, di resine o di polimeri possono infiammarsi in presenza di ossigeno mediante un innesco, a condizione che la loro concentrazione cada in un certo intervallo. Anche in questo caso esistono un limite inferiore e un limite superiore di infiammabilità, che dipendono dalle
dimensioni delle particelle solide e dalla porosità di queste, dalla turbolenza del sistema e dall’umidità. In ogni caso, una polvere per infiammarsi deve avere una granulometria inferiore ai 500 mm. I limiti inferiori nell’aria sono in genere compresi tra 15 e 60 mg/l, quelli superiori oltre i 2,6 g/l. L’umidità diminuisce l’infiammabilità delle polveri, perché ne favorisce l’agglomerazione, mentre il campo d’infiammabilità si allarga all’aumentare della temperatura, della pressione e della concentrazione di ossigeno. La presenza di diluenti e di polveri inerti restringe il campo di infiammabilità, mentre la presenza di gas infiammabili lo rende più ampio. Esplosioni di polveri si possono verificare nell’industria farmaceutica e in quella chimica, alimentare e mangimistica, in quella della lavorazione del legno, nella produzione di energia da carbone, nella metallurgia. L’ossidazione delle polveri avviene per adsorbimento dell’ossigeno molecolare sulle loro superfici con formazione di specie radicaliche.