Orologio biologico
Orologio biologico
La vita sulla Terra si è evoluta in un contesto caratterizzato da imponenti variazioni ambientali, alcune di natura ciclica. È il caso, per fare un esempio, dell'alternanza del giorno e della notte e dei moti di rivoluzione della Luna attorno alla Terra e della Terra attorno al Sole che generano variazioni cicliche ambientali, come maree e stagioni. La maggior parte degli organismi viventi ha prodotto adattamenti a oscillazioni di parametri su diversa scala temporale (per es., i fenomeni migratori stagionali, la maturazione delle gonadi, il raggiungimento della fertilità) in gran parte regolati da o. b. endogeni che 'dettano' il tempo agli organismi e consentono loro di anticipare variazioni periodiche dell'ambiente esterno, modificando il loro metabolismo e il loro comportamento. In relazione alla frequenza che caratterizza l'oscillazione generata da questi orologi endogeni, essi vengono classificati come orologi ultradiani (periodo della oscillazione compreso tra alcuni millisecondi e alcune ore), circadiani (periodo che approssima le 24 ore) e infradiani (periodo di settimane, mesi o anni). La cronobiologia si occupa dello studio di questi oscillatori endogeni e del loro significato a livello genetico, molecolare e fisiologico.
Ritmi circadiani
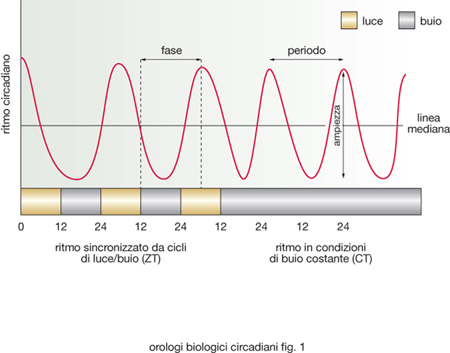
Gli o. b. circadiani (dal latino circa diem) oscillano con periodo che approssima la durata di un giorno astronomico e regolano una grande varietà di fenotipi ritmici che caratterizzano metabolismo, fisiologia e comportamento della maggior parte degli organismi. Un ritmo circadiano può essere descritto definendone il periodo che lo caratterizza, l'ampiezza del carattere che oscilla e la fase, ossia lo stato dell'oscillazione in un determinato momento rispetto a un punto di riferimento nel ciclo (fig. 1). I ritmi circadiani generati da un oscillatore biologico persistono in condizioni costanti, vale a dire in assenza di stimoli ambientali, come l'alternanza del giorno e della notte. Inoltre, gli oscillatori circadiani endogeni che generano ritmicità biologica, in natura vengono continuamente sincronizzati con il periodo di 24 ore della rotazione terrestre, grazie agli effetti di segnali esterni come la luce e la temperatura.
Caratteristiche generali degli orologi circadiani
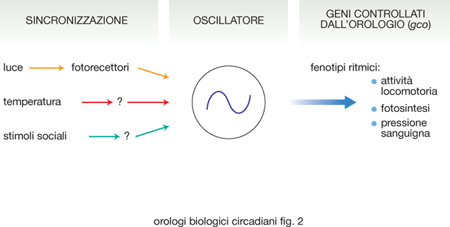
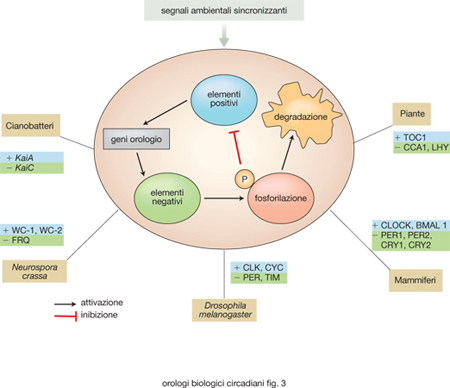
Studi condotti in diversi organismi modello, come il cianobatterio Synechococcus elongatus, il fungo unicellulare Neurospora crassa (la comune muffa del pane), il moscerino della frutta Drosophila melanogaster, la pianta Arabidopsis thaliana e il topo Mus musculus, hanno permesso, nonostante la grande eterogeneità che esiste tra queste specie, di identificare alcune proprietà generali che caratterizzano l'organizzazione degli orologi circadiani (fig. 2). In essi, infatti, l'orologio è costituito da un core (l'oscillatore) che rappresenta il meccanismo centrale, cioè l'insieme degli 'ingranaggi' che producono l'oscillazione molecolare circadiana. Questo core è tuttavia permeabile a informazioni provenienti dall'ambiente, i segnali definiti Zeitgeber, che sincronizzano in continuazione l'oscillazione endogena e la mantengono in fase con le variazioni ambientali prodotte dalla rotazione terrestre, impedendo quindi che l'orologio e i ritmi biologici da esso controllati si sfasino con conseguenze negative per l'organismo. Infine, l'oscillatore endogeno regola una serie di fenotipi metabolici, fisiologici e pure comportamentali, trasmettendo in uscita le informazioni che provengono dalla sua oscillazione. Ciò avviene prevalentemente mediante la regolazione a cascata di numerosi geni implicati nella genesi di questi fenotipi. I meccanismi che caratterizzano la trasduzione delle informazioni ambientali al core dell'orologio (via di ingresso), quelli che operano nel core e quelli che sono responsabili del controllo, in uscita, dell'attività di numerosi geni controllati dall'orologio (gco) non sono tuttavia da considerare componenti dell'orologio nettamente distinte tra loro e quindi autonome, bensì componenti interdipendenti, capaci di influenzare reciprocamente alcune loro caratteristiche. Gli o. b. circadiani possiedono alcune proprietà fondamentali: a) la ritmicità endogena da loro generata e i fenotipi ritmici da essa evocati persistono anche in assenza di stimoli ambientali sincronizzanti; b) sono permeabili a stimoli sincronizzanti provenienti dall'esterno (luce, variazioni di temperatura o stimoli sociali); c) sono temperatura-compensati: il periodo che caratterizza l'oscillazione endogena non è influenzato significativamente da variazioni di temperatura comprese entro intervalli compatibili con la vita dell'organismo in questione, e ciò anche nel caso di organismi eterotermi come insetti e rettili. Le conoscenze circa l'organizzazione molecolare e il funzionamento degli o. b. circadiani sono il risultato di una straordinaria accelerazione della ricerca in questo settore, che si è prodotta a partire dalla metà degli anni Novanta e che, in pochissimi anni, ha portato la cronobiologia molecolare a conquistare una posizione di primaria importanza nel panorama delle diverse attività sperimentali che sono caratteristiche della moderna biologia. L'analisi molecolare dei geni coinvolti nella organizzazione degli oscillatori circadiani dei batteri, funghi, piante e animali ha messo in evidenza come essi non derivino da geni ancestrali comuni e suggerisce di conseguenza che, nel corso dell'evoluzione, gli o. b. circadiani si siano organizzati più volte e in modo indipendente; e ciò anche se la loro organizzazione generale appare in sostanza la stessa. Gli oscillatori endogeni di tutti questi organismi sono infatti costituiti da 'geni orologio' e dalle corrispondenti 'proteine orologio' che si possono classificare in elementi positivi e negativi sulla base dell'azione che esercitano sul core dell'orologio e che formano cicli di autoregolazione mediante fenomeni di retroazione che generano circuiti temporali caratterizzati da una periodicità di circa 24 ore (Bell-Pedersen, Cassone, Earnest et al. 2005). In fig. 3 è riassunto un modello generale di funzionamento degli orologi circadiani. Gli elementi positivi identificati finora in diversi organismi modello sono: KaiA, White Collar-1 (WC-1), White Collar-2 (WC-2), Clock (CLK), Cycle (CYC), Brain and Muscle Arnt-like protein 1 (BMAL1) e Timing of Cab expression 1 (TOC1); gli elementi negativi: KaiC, Frequency (FRQ), Period (PER), Timeless (TIM), Cryptochrome ½(CRY), Circadian Clock Associated 1 (CCA 1) e Late Helongated Hypocotyl (LHY). La persistenza della ciclicità e della periodicità circadiana a livello molecolare, anche in condizioni ambientali costanti, dipende da modificazioni posttraduzionali a carico di alcune di queste proteine orologio, che introducono nel sistema, a ogni ciclo, un ritardo fra trascrizione, sintesi proteica e retroazione negativa, che impedisce al sistema il raggiungimento di condizioni di equilibrio e determina condizioni indispensabili per sostenere l'oscillazione nel tempo. Queste modificazioni posttraduzionali sono per lo più dovute all'attività di proteine con azione enzimatica del tipo delle chinasi, enzimi che catalizzano la fosforilazione di residui aminoacidici specifici nelle proteine bersaglio, e delle fosfatasi, che svolgono invece un'azione opposta, ossia catalizzano la rimozione dei gruppi fosfato. Questi processi di fosforilazione e defosforilazione regolano le dinamiche di stabilizzazione, mobilità intracellulare e degradazione di componenti fondamentali degli o. b. circadiani.
Orologi circadiani in organismi unicellulari
A dispetto della loro apparente semplicità, se confrontati con la complessità degli organismi pluricellulari, gli organismi unicellulari per i quali sono oggi disponibili informazioni, Synechococcus elongatus e Neurospora crassa, mostrano entrambe un'organizzazione dell'o. b. circadiano piuttosto complessa. Nel procariote S. elongatus il meccanismo che genera l'oscillazione è basato sull'interazione tra le proteine codificate dai geni orologio kaiA, kaiB e kaiC, il cui assemblaggio ritmico, che è mediato da fosforilazioni transienti a formare un complesso a elevato peso molecolare, il periodosoma, genera una ritmicità circadiana (Iwasaki, Kondo 2004). L'oscillazione regola, a cascata, il funzionamento dell'intero trascrittoma batterico (vale a dire l'insieme dei RNA messaggeri trascritti da tutti i geni presenti sul cromosoma batterico) e fenomeni quali la divisione cellulare e la collocazione temporale distinta di processi fondamentali e però tra loro incompatibili, quali la fotosintesi e la fissazione dell'azoto. Nell'eucariote Neurospora crassa, la ritmicità endogena del più importante è generata dall'interazione dei prodotti dei geni orologio frequency (frq), white collar1 (wc1) e white collar2 (wc2) che sono componenti di quello che viene definito oscillatore FWO (Frequency-White collar Oscillator), che svolge un ruolo importante nel controllo circadiano dell'attività di numerosi geni e della maturazione delle spore asessuali o conidi (Dunlap, Loros 2004). Le proteine White Collar-1 (WC-1) e White Collar-2 (WC-2) funzionano da elementi positivi che promuovono la trascrizione del gene orologio frq, mentre WC-1 funziona anche da fotorecettore della luce blu e media quindi la sincronizzazione dell'oscillatore circadiano con le informazioni che provengono dall'ambiente. È stata dimostrata l'esistenza in Neurospora di un altro oscillatore, indipendente dall'azione della proteina orologio Frequency (FRQ) e perciò definito FLO (Frequency Less Oscillator), che risponde, con meccanismi ancora ignoti, all'azione sincronizzante indotta da variazioni di temperatura o da molecole implicate nella sintesi di alcuni steroli, dirigendo l'espressione ritmica di specifici geni. Gli oscillatori FWO e FLO formano un sistema accoppiato, nel quale FWO svolge un ruolo guida nei processi di sincronizzazione dell'intero organismo con le variazioni ambientali, mentre FLO concorre, in modo subordinato, a rafforzare la ritmicità biologica circadiana esibita da Neurospora.
Orologio circadiano delle piante
Nonostante gli organismi vegetali siano stati tra i primi nei quali sono stati identificati e studiati fenotipi che esibiscono una ritmicità circadiana, le informazioni relative all'organizzazione molecolare dell'oscillatore circadiano dell'organismo modello Arabidopsis thaliana sono piuttosto limitate. Sono stati identificati finora tre geni orologio: LHY (Late Elongated Hypocotyl), CCA1 (Circadian Clock Associated 1) e TOC1 (Timing Of Cab Expression 1), che codificano componenti del core dell'oscillatore circadiano coinvolte nell'organizzazione di un ciclo di autoregolazione a retroazione negativa, in cui le proteine CCA1 e LHY svolgono il ruolo di elementi negativi, mentre TOC1, probabilmente in associazione con altre proteine, attiva la trascrizione dei geni CCA1 e LHY (Salome, McClung 2004). Sono stati anche identificati numerosi geni controllati direttamente dall'orologio che modulano in uscita, con periodicità circadiana, alcune importanti modificazioni fisiologiche e metaboliche, e alcuni fotorecettori coinvolti nella fototrasduzione del segnale luminoso e nella sincronizzazione dell'orologio circadiano.
Orologio circadiano degli insetti
Il primo gene che è implicato nell'organizzazione di un o. b. circadiano, period, è stato identificato nell'anno 1972, in Drosophila melanogaster clonato e caratterizzato dal punto di vista molecolare nell'anno 1985. La dissezione genetica e molecolare dell'architettura degli oscillatori endogeni degli insetti ha da allora compiuto notevoli progressi e le informazioni disponibili sulla organizzazione e il funzionamento dell'orologio circadiano in D. melanogaster sono dettagliate e integrate. Ciò è particolarmente importante in quanto gli o. b. circadiani degli animali sono costruiti in massima parte con proteine omologhe prodotte da geni evolutisi a partire da geni ancestrali comuni. Comprendere il funzionamento dell'orologio di un moscerino è quindi di enorme utilità al fine di indagare, per es., sul funzionamento dell'orologio circadiano dell'uomo.
L'oscillatore circadiano di Drosophila è costituito da due cicli sovrapposti di autoregolazione, nei quali la trascrizione ritmica di particolari geni orologio viene controllata dalla retroazione che è esercitata dai loro stessi prodotti proteici (Hardin 2005). Nel primo ciclo, l'eterodimero costituito dalle proteine CLK e CYC riconosce delle brevi sequenze E box (E) nei promotori dei geni orologio period (per) e timeless (tim) e ne attiva la trascrizione. I RNA messaggeri vengono poi tradotti nelle corrispondenti proteine PER e TIM a livello del citoplasma. PER viene fosforilata da chinasi come doubletime (DBT) e la Casein-chinasi2 (CK2) e degradata. Tuttavia, quando TIM raggiunge una concentrazione critica, sottrae PER alla degradazione e forma un complesso PER/TIM/DBT che entra nel nucleo, dove PER inibisce la trascrizione dei geni per e tim. A questo ciclo di autoregolazione se ne sovrappone un secondo, in cui l'eterodimero CLK/CYC attiva la trascrizione dei geni vrille (vri) e pdp-1. La proteina Vrille (VRI) si accumula rapidamente, trasloca nel nucleo e inibisce la trascrizione del gene clock (clk), mentre la proteina PDP-1 si accumula più lentamente, trasloca nel nucleo in ritardo rispetto a VRI e attiva la trascrizione del gene clk. L'espressione dei geni per, tim e clk è quindi ciclica, mentre quella del gene cyc è costitutiva. Questi cicli sovrapposti generano una ritmicità con un periodo di circa 24 ore. L'abbondanza delle proteine orologio e la loro localizzazione subcellulare sono inoltre controllate da modificazioni post traduzionali quali fosforilazioni e defosforilazioni, che stabilizzano l'oscillazione su un periodo circadiano e collocano le retroazioni trascrizionali in momenti opportuni nel corso della giornata. In Drosophila sono stati identificati numerosi oscillatori circadiani periferici, presenti nei tubuli malpighiani, nel cardium, nelle antenne, nell'apparato boccale, oltre all'oscillatore centrale costituito da gruppi di neuroni localizzati nel cervello, implicati nella genesi di fenotipi ritmici come l'attività locomotoria del moscerino. In Drosophila, gli orologi circadiani periferici sembrano essere sostanzialmente autonomi dall'oscillatore centrale per quanto riguarda la loro sincronizzazione con l'ambiente esterno. Negli insetti l'evoluzione avrebbe quindi favorito l'organizzazione di specializzazioni tessuto specifiche degli oscillatori circadiani. La sincronizzazione dell'orologio a opera della luce è mediata dal fotorecettore per la luce blu Cryptochrome (CRY), una proteina della famiglia delle fotoliasi, che, attivata dalla luce, forma un complesso con la proteina TIM (fotolabile) e ne avvia la degradazione. Tale interazione CRY/TIM è alla base del meccanismo di sincronizzazione dell'orologio con l'ambiente. Gli effetti della luce sulla fase della ritmicità endogena sono in relazione all'abbondanza di TIM e a quella del suo messaggero nel momento in cui, durante le 24 ore, viene fornito lo stimolo luminoso. Impulsi luminosi somministrati nella prima parte della notte si traducono in un ritardo dell'orologio; se forniti nella parte terminale della notte, essi causano un avanzamento, di contro non producono effetti se somministrati durante il giorno, quando la proteina TIM risulta virtualmente assente.
Orologio biologico circadiano dei mammiferi
Nei mammiferi, a differenza rispetto agli insetti, l'organizzazione degli oscillatori circadiani è gerarchica, e consiste di numerosi oscillatori periferici distribuiti in organi come il fegato, i polmoni, la milza, il cuore, e di un o. b. circadiano centrale che è localizzato a livello dei nuclei suprachiasmatici dell'ipotalamo, svolge un ruolo importante di coordinamento delle attività degli oscillatori periferici ed è essenziale per convertire segnali di natura luminosa, provenienti dal tratto retino-ipotalamico, in segnali a cascata che sincronizzano gli oscillatori periferici, benché non necessariamente tutti con la stessa fase (Antle, Silver 2005; Sernagor 2005). Si ritiene che ciò avvenga sia mediante proiezioni nervose dirette dai nuclei suprachiasmatici dell'ipotalamo verso altre regioni bersaglio nel cervello, sia mediante segnali di natura umorale.
I geni la cui espressione viene controllata e dall'orologio centrale dei mammiferi e dagli oscillatori periferici costituiscono una parte significativa del genoma e sono in gran parte differenti nei diversi oscillatori. Infatti, analisi sulla natura dei trascrittomi in diversi tessuti di mammifero hanno evidenziato come la frazione di RNA messaggeri trascritta con una cinetica circadiana rappresenti fino al 10% dei messaggeri totali; i trascritti invece la cui oscillazione avviene in più di un tessuto non raggiungono generalmente l'1%. Queste informazioni, suggeriscono indirettamente, che oscillatori periferici diversi contribuiscono nel mammifero alla regolazione di fenotipi ritmici tessuto specifici, che riflettono probabilmente la peculiarità delle funzioni esplicate da organi diversi. Se nel corso dell'evoluzione la natura sia dei geni sia delle proteine orologio si è conservata negli animali, nei mammiferi eventi di duplicazione genica hanno prodotto delle copie multiple di numerosi geni orologio (Per1, Per2 e Per3 e Cry1 e Cry2), facendo aumentare nei mammiferi la complessità nell'organizzazione degli oscillatori circadiani. Alcune proteine orologio sembrano avere assunto ruoli diversi all'interno del congegno molecolare che genera l'oscillazione. È il caso della proteina CRY, che in Drosophila è il fotorecettore per la luce blu ed è coinvolta nella sincronizzazione dell'orologio, mentre nei mammiferi stabilizza le proteine PER nel citoplasma (al pari di TIM in Drosophila), formando complessi che entrano nel nucleo e regolano, mediante retroazione negativa, i geni orologio Per e Cry. Si ritiene che la fotorecezione circadiana dipenda da altri fotopigmenti presenti nella retina. Inoltre, è in discussione il ruolo del gene Timeless nell'orologio circadiano proprio del mammifero.
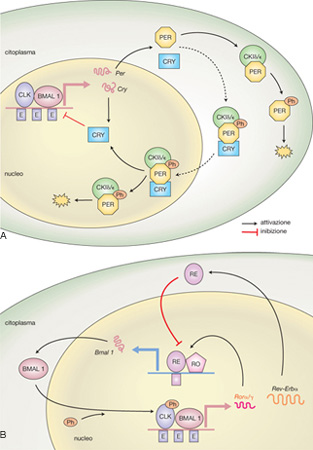
In fig. 4 è descritto un modello di funzionamento dell'orologio di mammifero nel quale, per semplicità, non viene considerata la ridondanza genica. L'eterodimero proteico CLK/BMAL 1 attiva la trascrizione dei geni orologio Per e Cry. PER viene fosforilata dalle Casein-chinasi Iε (CKIε) e dalle Casein-chinasi Iδ (CKIδ) e avviata alla degradazione. Tuttavia, quando CRY raggiunge una concentrazione critica, sottrae PER alla degradazione e forma un complesso PER/CRY/CKIε/δ che entra nel nucleo dove CRY inibisce la trascrizione dei geni Per e Cry (fig. 4 A). In fig. 4 B è illustrato lo schema di un secondo ciclo di autoregolazione che si sovrappone al precedente, in cui l'eterodimero CLK/BMAL 1 attiva la trascrizione dei geni orphan nuclear receptor (Rev-Erbα) e retinoic acid receptor-related orphan receptors (Rorα/γ). La proteina REV-ERBα (RE) si accumula rapidamente, trasloca nel nucleo e inibisce la trascrizione del gene Bmal 1, mentre le proteine RORα/γ (RO) si accumulano più lentamente, traslocano in ritardo rispetto a REV-ERBα e attivano la trascrizione del gene. L'espressione dei geni Per, Cry e Bmal 1 è quindi ciclica, mentre quella del gene Clk è costitutiva. Questi cicli sovrapposti generano una ritmicità con un periodo di circa 24 ore e vengono sincronizzati principalmente da Zeitgeber di natura luminosa provenienti dal tratto retino-ipotalamico.
Alterazioni dell'orologio circadiano nell'uomo. - Alterazioni significative della funzionalità dell'orologio circadiano nell'uomo possono determinare cronopatologie. Attività occupazionali che prevedono variazioni sistematiche dei turni di lavoro possono comportare sfasamenti cronici dell'orologio endogeno rispetto alle variazioni circadiane ambientali e produrre effetti negativi per la salute dei lavoratori e costi economici e sociali importanti. Situazioni di jet lag cronico possono essere sperimentate anche da piloti d'aereo e personale di bordo, se impegnati con continuità e per lunghi periodi su rotte transmeridianiche: in questi casi possano manifestarsi addirittura alterazioni anatomiche a livello del sistema nervoso centrale e deficit cognitivi (Cho 2001). Disturbi stagionali dell'umore caratterizzati da stati depressivi (Seasonal Affective Disorder o SAD) sono correlati all'attenuarsi dell'effetto sincronizzante della luce naturale, che accompagna l'avvento dell'autunno e dell'inverno, specie a latitudini elevate. Infine, la funzionalità dell'o. b. circadiano nell'uomo può subire alterazioni a opera di mutazioni che si verificano a livello dei geni orologio responsabili della genesi dell'oscillazione circadiana. Una mutazione a livello di un particolare sito nucleotidico nel gene Per2, per es., determina una variazione nella composizione aminoacidica della proteina corrispondente PER2, abolendo un importante sito di fosforilazione (Toh, Jones, He et al. 2001). Ciò causa profonde modificazioni della cinetica di accumulo e successiva traslocazione nel nucleo del complesso PER/CRY, coinvolto nella regolazione per retroazione negativa dell'attività degli stessi geni Per e Cry. Come risultato, i soggetti che portano questa mutazione autosomica dominante sono affetti da una vera e propria sindrome (sindrome familiare di avanzamento della fase del sonno o FASPS) che accorcia il periodo dell'oscillazione endogena anticipando l'inizio della fase del sonno al tardo pomeriggio e il risveglio durante la notte. Il trattamento delle disfunzioni dell'orologio circadiano si basa in larga misura sulla luce terapia e sull'adozione di tabelle temporali di attività fisiche e di attività sociali adatte a rafforzare la ritmicità endogena e a sincronizzarla con l'ambiente esterno.
Un approccio cronofarmacologico è in una fase ancora sperimentale e basato sulla melatonina (ormone particolarmente abbondante durante il sonno) e i suoi analoghi. La comprensione dei meccanismi d'azione degli orologi circadiani e dei loro effetti fisiologici e metabolici riveste un'importanza sempre maggiore nei trattamenti farmacologici di molte malattie, permettendo di aumentare l'efficacia dei farmaci e ridurne gli effetti tossici per l'organismo.
bibliografia
K. Cho, Chronic jet lag produces temporal lobe arthrophy and spatial cognitive deficits, in Nature neuroscience, 2001, 4, 6, pp. 567-68.
K.L. Toh, C.R. Jones, Y. He et al., An hPer2 phosphorylation site mutation in familial advanced sleep phase syndrome, in Science, 2001, 291, pp. 1040-43.
J.C. Dunlap, J. Loros, P. DeCoursey, Chronobiology - Biological timekeeping, Sunderland (MA) 2003.
J. Hall, Genetics and molecular biology of rhythms in Drosophila and other insects, London 2003.
J.C. Dunlap, J.J. Loros, The Neurospora circadian system, in Journal of biological rhythms, 2004, 19, 5, pp 414-24.
H. Iwasaki, T. Kondo, Circadian timing mechanisms in the procaryotic clock system of cyanobacteria, in Journal of biological rhythms, 2004, 19, 5, pp. 436-44.
P.A. Salome, C.R. McClung, The Arabidopsis thaliana clock, in Journal of biological rhythms, 2004, 19, 5, pp. 425-35.
M.C. Antle, R. Silver, Orchestrating time: arrangements of the brain circadian clock, in Trends in neurosciences, 2005, 28, 3, pp 145-51.
D. Bell-Pedersen, V.M. Cassone, D.J. Earnest et al., Circadian rhythms from multiple oscillators: lessons from diverse organisms, in Nature reviews. Genetics, 2005, 6, 7, pp. 544-56.
R.G. Foster, S. Peirson, D. Whitmore, Rhythmic temporal processes in biology, in Encyclopedia of molecular cell biology and molecular medicine, 12° vol., Weinheim 20052, pp 413-82.
P.E. Hardin, The circadian timekeeping system of Drosophila, in Current biology, 2005, 15, 17, pp. R714-R722.
U. Schibler, F. Naef, Cellular oscillators: rhythmic gene expression and metabolism, in Current opinion in cell biology, 2005, 17, pp. 223-29.
E. Sernagor, Retinal development: second sight comes first, in Current biology, 2005, 15, 14, p. R556.