transgenico, organismo
transgenico, organismo
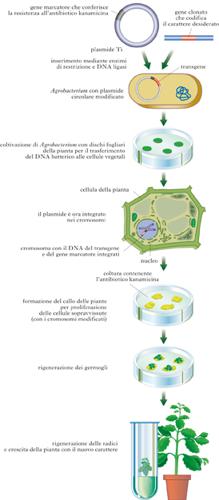
Organismo nel quale sono stati inseriti, per mezzo di tecniche di biologia molecolare, geni provenienti da un altro organismo di specie diversa, o eterologo. Il materiale genetico così modificato è definito DNA ricombinante. Si chiama invece transgene la sequenza nucleotidica di DNA esogeno che viene introdotta ed espressa nelle cellule dell’organismo ospite. Gli organismi t. possono essere sia Procarioti sia Eucarioti, appartenenti al regno animale e vegetale.
Organismi transgenici e OGM
Gli organismi t. fanno parte degli OGM (Organismi Geneticamente Modificati) ossia piante, animali e microrganismi che possiedono una nuova combinazione di materiale genetico ottenuta artificialmente. Anche se molti autori usano le due espressioni come sinonimi c’è da dire che sono considerati OGM anche organismi, nei quali il materiale genetico endogeno è stato modificato per sottrazione o alterazione di alcuni elementi, oppure per inserzione di geni provenienti da organismi della stessa specie, che non possono per questo essere considerati transgenici.
Effetti della modificazione genica
In alcuni casi l’introduzione di materiale genetico esogeno causa l’annullamento dell’espressione di un gene endogeno (gene knock-out). Il prodotto che si desidera venga espresso dal transgene può essere: una proteina; un elemento genetico regolativo; nel caso dei vegetali, un RNA che non viene tradotto in proteina, ma che serve a modulare l’espressione di un gene già presente nella pianta, o per indurre la degradazione di uno specifico RNA, per es. il genoma di un virus. Il transgene di solito è costituito dalla regione codificante il gene strutturale, e da sequenze regolative che gli permettono di essere incorporato nel genoma dell’ospite, e di essere espresso correttamente nelle sue cellule. Negli organismi t. il gene estraneo è presente non solo nelle loro cellule somatiche, ma anche in quelle riproduttive, e può quindi essere ereditato dai discendenti come gli altri geni. La modificazione genetica degli organismi t. può essere ottenuta sia in modo mirato, interessando regioni specifiche del genoma, sia casuale, con l’inserzione del frammento ricombinante nel cromosoma dell’ospite in una posizione non prevedibile, e determinante per l’espressione del gene; viene poi selezionato il clone in cui l’espressione genica è migliore.
I topi transgenici come modello di malattie
Fra gli animali ingegnerizzati, il topo da laboratorio (Mus musculus) è il modello maggiormente utilizzato per lo studio delle malattie dell’uomo. Sebbene l’uomo e il topo si siano differenziati nell’evoluzione della loro vita 75 milioni di anni fa, hanno mantenuto un notevole grado di somiglianza genetica e fisiologica. Il mappaggio dei mutanti murini è facilitato dalla possibilità di effettuare i reincroci interspecifici, e dalla disponibilità di numerosi marcatori polimorfici (ne sono stati mappati ca. 9.000). Il sequenziamento del genoma del topo è stato completato nel 2002, subito dopo quello umano (2001). Grazie al livello relativamente alto di conservazione fra le sequenze codificanti umane e murine, quasi tutti i geni umani (ca. il 98%) hanno un omologo murino facilmente identificabile. Ciò è particolarmente importante per la ricerca medica, perché i mutanti di geni ortologhi murini e umani spesso mostrano fenotipi simili, per cui il clonaggio di un gene patogeno in una specie può avere grande importanza per l’altra specie. La tecnologia del trasferimento genico consente di ottenere specifici genotipi mutanti negli animali, nell’intento di riprodurre la patologia dell’uomo, a livello sia genetico sia fenotipico. Il genoma dell’organismo ricevente può essere modificato in modo preciso e predeterminato, per cui è possibile progettare e introdurre in vivo mutazioni o modificazioni specifiche in geni particolari. In generale, si procede aggiungendo nuove sequenze di DNA preparate artificialmente. Una volta identificato un gene correlato a una malattia, questo si può ingegnerizzare e poi costruire un modello murino geneticamente modificato. Se la malattia deriva dalla perdita di una funzione, si può utilizzare la mutagenesi mirata per produrre nella linea germinale di topo una mutazione knock-out nel gene ortologo che viene così eliminato. Se invece la patologia è determinata da un’acquisizione di una nuova funzione, l’allele responsabile dovrà essere introdotto nella linea germinale del topo.
Transgenesi per microiniezione di DNA nell’oocita fecondato
La tecnica più efficiente e comunemente adottata per produrre topi transgenici consiste nell’introdurre il DNA direttamente nel pronucleo maschile dell’embrione subito dopo la fecondazione. Con un sistema di microiniezione applicato a un microscopio, si immobilizza l’embrione e si introduce il DNA nel pronucleo maschile. Il transgene iniettato si integra a caso nel DNA cromosomico, di solito in un sito unico e in più copie. Gli embrioni che restano vitali vengono poi trasferiti negli ovidotti di femmine pseudogravide, simulando la fecondazione naturale: nell’ovidotto avviene la fertilizzazione degli oociti da parte degli spermatozoi durante la fase dell’estro e successivamente all’accoppiamento, simulato con maschi sterili. Nei topi della progenie ottenuta dagli embrioni così impiantati, si controlla la presenza della mutazione indotta attraverso tecniche di biologia molecolare. Se il transgene si integra immediatamente, il topo risultante è transgenico e il gene è presente in tutte le sue cellule; se però il gene si integra solo dopo una o due divisioni cellulari, il topo che ne risulta sarà un ‘mosaico’, ossia conterrà cellule sia trasformate sia non trasformate. Se le cellule trasformate contribuiscono alla linea germinale, il transgene viene trasmesso alla successiva generazione.
Mutagenesi mirata o gene targeting e target mutation: knock-in e knock-out
L’inserzione di un frammento di DNA in un sito predeterminato del genoma dell’ospite si chiama modificazione genica mirata (gene targeting). Se lo scopo è quello di inattivare un gene endogeno, si interrompe la regione codificante con l’inserzione di una sequenza estranea, ottenendo la soppressione dell’espressione genica di uno degli alleli, o addirittura di entrambi; in questo caso l’animale mutante viene detto knock-out per lo specifico gene inattivato. Questa tecnologia è stata sviluppata principalmente per lo studio della funzione genica nel topo; il primo topo knock-out fu creato da M. Capecchi, M. J. Evans e O. Smithies alla fine degli anni Ottanta del secolo scorso, e per questo è stato loro assegnato nel 2007 il premio Nobel per la medicina o la fisiologia. Mediante l’analisi del fenotipo di topi knock-out è possibile studiare la funzione di un grande numero di geni diversi. Se lo scopo è quello di modificare un gene endogeno, senza inattivarlo, si possono introdurre alterazioni mirate che modificano ma non sopprimono l’espressione genica. Infine si può effettuare un’inserzione knock-in, ossia una mutazione mirata che sostituisce l’attività di un gene con quella di un altro gene introdotto sperimentalmente. In questo approccio si usa la ricombinazione omologa per sostituire la sequenza di un gene endogeno con una sequenza correlata, introducendo così una mutazione definita in un sito preselezionato del genoma. Modifiche di questa strategia consentono forme più sofisticate di manipolazione, tra cui l’introduzione di piccole mutazioni e la sostituzione di un gene con un altro.La mutagenesi mirata si realizza attraverso l’uso di cellule staminali (ES) nelle quali la ricombinazione omologa si verifica con frequenza particolarmente elevata. Le cellule ES possono essere coltivate in vitro e transfettate per potervi introdurre materiale genetico esogeno. Le cellule ES sono pluripotenti e possono produrre tutti i tipi cellulari compresi i gameti; vengono pertanto reiniettate in una blastocisti che a sua volta viene reimpiantata in una femmina pseudogravida di topo. L’embrione che si sviluppa è una chimera, ossia contiene due popolazioni di cellule derivate da zigoti differenti, quelle originarie della blastocisti, e le cellule ES integrate nella blastocisti. Nel caso in cui le cellule ES abbiano contribuito alla linea germinale, parte della progenie sarà eterozigote per l’allele transgenico.
Nicoletta Rossi
Marcello Raspa