nocicettore
nocicettore
Neurone sensoriale dotato di sensibilità agli stimoli dolorifici. I neuroni nocicettivi hanno il loro corpo cellulare all’interno dei gangli spinali (gangli delle radici dorsali) situati in prossimità della colonna vertebrale. Questi neuroni sono tipiche cellule a T, in quanto possiedono una branca diretta in periferia (responsabile della trasduzione dello stimolo doloroso) e una branca che si dirige centralmente, e stringe contatti sinaptici con i neuroni delle lamine superficiali delle corna dorsali del midollo spinale. I neuroni dei gangli spinali mediano la sensibilità dolorifica proveniente da tutte le parti del corpo, a parte il distretto facciale, che è innervato da n. situati alla base del cranio, nei nuclei del trigemino. I n. inviano le loro terminazioni a cute, muscoli, articolazioni, meningi e tessuti somatici profondi.
Tipi di nocicettore
I n. si possono suddividere a seconda delle loro proprietà funzionali in n. meccanici, termici, polimodali e silenti.
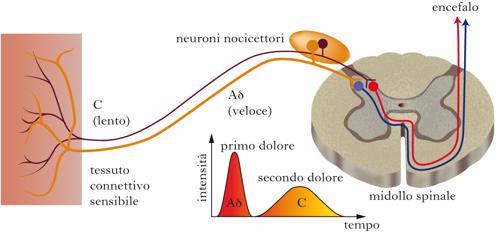
Nocicettori meccanici. Rispondono a stimoli cutanei intensi (pizzicotto, puntura, schiacciamento) e danno una sensazione di dolore vivo. Il segnale è raccolto da terminazioni nervose nude ed è trasportato all’snc da fibre mielinizzate, dette Aδ, con velocità di conduzione di 5÷30 m/s.
Nocicettori termici. Sono eccitati da temperature estreme (maggiori di 45 °C o minori di 5 °C); anch’essi trasmettono il segnale attraverso fibre mielinizzate Aδ.
Nocicettori polimodali. Sono attivati da una varietà di stimoli (meccanici, termici e segnali chimici, come i mediatori dell’infiammazione), e producono una sensazione di dolore sordo; conducono il segnale al sistema nervoso centrale mediante fibre non mielinizzate e di basso diametro (fibre C; velocità di trasmissione minore di 1 m/s).
Nocicettori silenti. Sono presenti soprattutto nei visceri e risultano relativamente insensibili nei confronti di stimoli in grado di essere percepiti dai n. cutanei, mentre risultano sensibili alla torsione, alla distensione e all’ischemia di un viscere; presentano generalmente campi di ricezione ampi e sovrapposti. I vari tipi di n. spesso agiscono in maniera coordinata nella recezione del segnale dolorifico: per es., a seguito di uno stimolo nocivo (meccanico o termico), l’attivazione delle fibre mielinizzate Aδ è responsabile di un dolore iniziale, pungente e localizzato, seguito da un dolore più diffuso e persistente, generato dall’arrivo dello stimolo portato dalle fibre C.
Meccanismo d’azione
Vari studi hanno messo in luce alcuni dei meccanismi attraverso i quali gli stimoli dolorosi depolarizzano le terminazioni dei n. e generano impulsi nervosi (potenziali d’azione). È noto che le terminazioni nocicettive possiedono recettori specifici che convertono l’energia associata a stimoli meccanici, termici o chimici in una variazione del potenziale di membrana. Uno di questi recettori è il vanilloide, un canale non selettivo per cationi, di natura eccitatoria, che viene attivato da diversi stimoli, quali il calore e gli agonisti vanilloidi (come il principio attivo del peperoncino, la capsaicina). Diversi mediatori chimici possono attivare i n.; questi sono tipicamente rilasciati in seguito a una lesione tissutale, e comprendono ioni potassio, serotonina e bradichinina. Queste molecole causano una attivazione diretta dei terminali nocicettivi e l’insorgenza di potenziali d’azione, tramite cui il segnale viene trasmesso alle strutture centrali. La depolarizzazione dei n. a seguito di una lesione periferica può anche causare il rilascio di neuropeptidi (quali la sostanza P e il peptide associato al gene per la calcitonina, CGRP) dalle stesse terminazioni nocicettive; i neuropeptidi sono sintetizzati a livello del soma neuronale e poi trasferiti per trasporto assonale a livello del terminale. La liberazione di questi neuropeptidi conduce alla degranulazione dei mastociti, che rilasciano istamina, la quale è in grado di causare una ulteriore attivazione dei terminali nocicettivi. Inoltre le fibre nocicettive possono essere sensibilizzate, cioè rese più eccitabili, da mediatori dell’infiammazione, quali le prostaglandine (➔ iperalgesia). Il segnale dolorifico, una volta generato a livello della branca periferica del n., viene codificato in potenziali d’azione (generati da canali sodio voltaggio-dipendenti), che consentono la trasmissione dell’informazione a livello centrale. In partic., i n. localizzati nei gangli spinali formano sinapsi (tramite la loro branca assonale centrale) con neuroni localizzati nelle lamine superficiali delle corna dorsali del midollo spinale, specie nella lamina I e nella lamina II (detta anche sostanza gelatinosa). La trasmissione sinaptica tra i n. e le cellule delle corna dorsali è garantita dal rilascio di glutammato e di neuropeptidi. In partic., le fibre C afferenti al midollo sono in grado di corilasciare glutammato e sostanza P. Il glutammato ha un’azione depolarizzante molto rapida (mediata da recettori postsinaptici di tipo AMPA), mentre la sostanza P potenzia e prolunga l’effetto del glutammato. L’attivazione della via nocicettiva non conduce di necessità all’esperienza del dolore; infatti la percezione del dolore è un processo di elaborazione centrale, che coinvolge anche aspetti emozionali (➔ dolore, Rappresentazione interna del dolore).