Nihonio e i suoi fratelli
Nihonio e i suoi fratelli
La tavola periodica degli elementi è uno dei pilastri della scienza e, nonostante il secolo e mezzo di vita, è ancora in fase di completamento, perché il numero degli elementi chimici conosciuti continua ad aumentare...
L’espressione tavola periodica ricalca l’analoga affermatasi nell’inglese. Ne sta sempre più soppiantando un’altra, che nelle menti dei non più giovani riaffiora dai ricordi di liceo. Per gli amanti della buona narrativa, Il sistema periodico (così appunto si diceva) è il libro in cui Primo Levi prende spunto via via da un elemento chimico per tratteggiare aspetti della vita. Cerchiamo di rispondere a un paio di domande. Perché inserire in quest’opera destinata a un pubblico vario, e non a un consesso di scienziati, qualche pagina sulla tavola periodica degli elementi? Perché in questa rassegna del 2016?
Alla prima domanda potrà rispondere nel modo forse migliore quanto all’alba del 2000 ebbe a dire Oliver Sacks: secondo il celebre scrittore, che era neurologo e non chimico, la tavola periodica era stata l’invenzione più grande in tutto il millennio che stava concludendosi.
In effetti non è facile trovare rappresentazioni così concise, eppure di portata così vasta: i mattoni dell’universo condensati in un cartoncino, da cui perfino uno studentello minorenne può estrarre, su due piedi e con deduzioni semplici, molte notizie a proposito del sodio e del cloro, così diffusi nei mari, o del carbonio, dell’azoto, dell’ossigeno, che costituiscono gran parte del suo organismo, o del ferro, che gli permette di respirare.
La risposta all’altra domanda è allusivamente contenuta nel titolo di questo articolo. Infatti, ai primi del 2016 l’International union of pure and applied chemistry ha annunciato che l’esistenza di 4 nuovi elementi chimici era riconosciuta ufficialmente. L’8 giugno lo stesso ente internazionale si esprimeva favorevolmente sui nomi proposti dagli scopritori, e li sottoponeva alle osservazioni dei chimici di tutto il mondo, in attesa dell’approvazione definitiva in novembre.
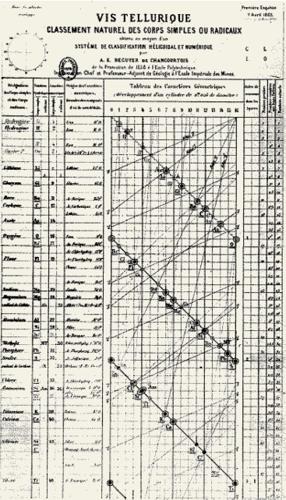
La tavola periodica non è qualcosa d’immutabile, visto che continua a estendersi. Ciò è già successo molte volte: nei primi tempi sono stati addirittura colmati i buchi che aveva alla sua nascita. A proposito di nascita: la tavola non ha un padre solo. Il tedesco Johann Wolfgang Döbereiner, chimico molto stimato da Goethe, nel 1829 raggruppò in ‘triadi’ alcuni elementi con proprietà simili. Trentatré anni dopo, il parigino Alexandre-Émile Béguyer de Chancourtois notò regolarità nelle somiglianze: si presentavano periodicamente, nell’ordine crescente dei pesi atomici. Ebbe l’idea di piazzare i simboli degli elementi sulla superficie laterale d’un cilindro: a spirale, come sul filetto d’un bullone. Su ogni verticale si trovavano allineati elementi dal comportamento simile. Il suo studio uscì senza disegni. Lui poi volle rimediare, ma ne ebbe la possibilità solo su una rivista letta più che altro da geologi e non da chimici. Oggi sappiamo bene quanto valgano le immagini nel trasmettere le idee: in effetti quelle del parigino passarono inosservate.
Così si fece notare per prima la proposta di un britannico reduce dall’impresa dei Mille nelle Due Sicilie: John Alexander Reina Newlands, nato a Londra da un Newlands, scozzese, e da una Reina, donna d’origine italiana. Nel 1864 egli pubblicò una prima forma di tavola periodica, e l’anno dopo la presentò a Londra, in una delle assise scientifiche più prestigiose dell’epoca. Ne uscì coperto ingiustamente di ridicolo. In un’analogia musicale, egli aveva parlato di legge delle ottave: la somiglianza di ciascun elemento con l’ottavo fra quelli che lo seguono.
Gli avversari scientifici lo subissarono di sarcasmo. Intanto i chimici tedeschi proseguivano i loro tentativi di sistematizzazione. Nel 1843 Leopold Gmelin aveva pubblicato una lista in cui estendeva le idee di Döbereiner, identificando 10 triadi, 3 quartetti e 1 quintetto. Nel 1864 Julius Lothar Meyer classificò 44 elementi secondo le rispettive valenze, cioè capacità di combinarsi chimicamente con gli altri. In Russia, un chimico geniale quanto estroso, Dmitrij Ivanovič Mendeleev, preferì seguire, come criterio ordinatore, il peso atomico crescente. Anche Meyer nel frattempo s’era concentrato sulla stessa intuizione, e ne nacque ovviamente una polemica in cui ciascuno dei due sosteneva la propria originalità. Il meccanismo concettuale, comunque, era il seguente: nel mettere in fila o in colonna gli elementi in ordine di peso atomico, s’andava a capo, o si cominciava una colonna nuova, quando le proprietà presentavano ripetizioni in confronto a elementi precedenti.
Il russo ebbe più successo grazie a 2 sue scelte. Innanzitutto costruì la tabella lasciando caselle vuote, dove secondo lui ciò era necessario per rispettare le analogie.
La sua fantasia spigliatissima, unita a un bel po’ di disinvoltura, lo spinse a sostenere che quei buchi aspettavano elementi ancora ignoti, dei quali si lanciò a prevedere le proprietà proprio in base alla posizione che avrebbero dovuto occupare. Inoltre, per far tornare le analogie, si permise d’invertire qua e là l’ordine rigido che sarebbe stato dettato dai pesi atomici, sostenendo che dovevano essere sbagliati.
Quando poi le scoperte di nuovi elementi andarono man mano a riempire le caselle vuote con le proprietà da lui predette, il suo credito scientifico salì alle stelle. Sui pesi atomici nei punti zoppicanti venne invece smentito: non erano sbagliati. Ma nel 1913, 6 anni dopo la sua morte, si dimostrò che, per far tornare perfettamente le cose come lui aveva intuito, bastava cambiare il criterio ordinatore: non il peso atomico, ma il numero atomico, cioè il numero dei protoni presenti nel nucleo, numero che divenne noto per i vari elementi grazie al fisico britannico Henry Gwyn Jeffreys Moseley.
Nel tempo, la tavola periodica è stata arrangiata in versioni sempre più adatte. I 4 elementi riconosciuti quest’anno vanno a completare la settima e almeno per ora ultima riga, cioè il settimo periodo. La disposizione consecutiva in righe è stata scelta in modo da far capitare in colonne, dette gruppi, gli elementi con caratteristiche simili, donde appunto il nome di periodi dato alle righe stesse. Gli elementi nuovi, coi numeri atomici 113, 115, 117 e 118, una volta ottenuti per sintesi nucleare hanno vita brevissima: un campione dell’ultimo si dimezza in meno d’un millisecondo.
Accennavamo ai nomi. Per ora l’ufficialità ce l’hanno solo gli originali inglesi: nihonium, moscovium, tennessine, oganesson, cioè 3 collegati al luogo della scoperta (Nihon, «La terra del sole nascente», è uno dei modi in cui i giapponesi chiamano la loro nazione), mentre il quarto è una sorta di patronimico. E proprio questo crea qualche problema: Jurij Colakovič Oganesian, pioniere in Russia di quel genere di ricerche, è ancora vivo e vegeto, e questo va contro una prassi che finora ha avuto un’eccezione sola (il seaborgio, numero atomico 106, così chiamato nel 1997, cioè 2 anni prima che morisse lo statunitense Glenn Theodore Seaborg). Come saranno i nomi italiani? La scienza nostrana dimostra da tempo insensibilità linguistica, accodandosi alla terminologia anglosassone e perfino ignorando i meccanismi del lessico. C’è già chi suggerisce nihonio, moscovio, tennessinio e oganessio. Ma i nomi inglesi hanno non a caso suffissi diversi: -ium per i primi 2, che vanno in uno dei primi 16 gruppi, -ine per il terzo, che va nel diciassettesimo, e -on per il quarto, che in base alle somiglianze va nel diciottesimo.
Logicamente noi pure dovremmo adattare i nomi d’ognuno dei 4 nuovi elementi ai gruppi rispettivi. Va bene il nihonio, incolonnato sotto indio e tallio. Accettabile anche il moscovio, che va sotto a elementi dai nomi costruiti in modo vario: uno è l’antimonio, per gli altri pazienza (azoto, fosforo, arsenico, bismuto: senza suffissi). Ma il tennessine, che col suffisso -ine segue per esempio brom-ine (bromo) e iod-ine (iodio), dovrebbe esser tradotto tenness-io e non tennessinio. Infine l’elemento 118: i gas nobili che lo sovrastano hanno nomi inglesi formati col suffisso -on: neon, argon, kripton, xenon, radon. Nomi ormai molto diffusi anche in italiano, dove però le forme classiche sono senza la n finale. In ogni caso inserire la i (oganess-i-o) non ha senso.
La tavola periodica degli elementi nelle parole di due premi Nobel
«Se una qualche catastrofe universale venisse a distruggere il mondo e all’umanità fosse concesso di poter conservare un solo concetto scientifico per ricostruire la civiltà, quale sarebbe questo concetto? La risposta del chimico è invariabilmente: la tavola periodica degli elementi».
(Richard P. Feynman, premio Nobel per la fisica nel 1965)
«L’argomento della mia relazione di oggi è un nuovo gas. Vi descriverò in seguito le sue curiose proprietà, ma sarei sleale se non vi informassi subito della sua più importante caratteristica: non è stato scoperto. Siccome non è ancora nato, non ha un nome...».
(William Ramsay, premio Nobel per la chimica nel 1904)
Gli elementi superpesanti: che cosa sono?
Gli elementi chimici più pesanti dell’uranio sono radioattivi e decadono in un tempo molto breve se confrontato con l’età della Terra, pertanto non si trovano in natura (solo tracce degli elementi transuranici nettunio e plutonio possono essere individuate nelle rocce contenenti uranio). Gli elementi prodotti artificialmente (in reattori nucleari o in acceleratori di particelle) in genere decadono molto rapidamente. All’inizio degli anni Cinquanta del secolo scorso è stato previsto che solo alcuni elementi aventi particolari combinazioni di protoni e neutroni, in analogia alle configurazioni elettroniche degli elementi, formassero nuclei particolarmente stabili. Gli sviluppi di questa teoria prevedono la possibilità che gli elementi con numero atomico intorno al 114 siano caratterizzati da una vita media superiore a quella della maggioranza degli elementi sintetizzati negli ultimi 50 anni. Per questi elementi, oltre il numero atomico 104, è stato coniato il nome di ‘elementi superpesanti’. Essi vengono prodotti negli acceleratori di particelle, ‘sparando’ dei nuclei relativamente leggeri contro nuclei più pesanti possibile. Lo sviluppo di queste tecniche ha permesso di ottenere nuovi nuclidi, ampliando il sistema periodico con elementi di numero atomico fino a 118.
Quando la tavola periodica ispirò la letteratura
Primo Levi pubblicò nel 1975 Il sistema periodico, suo quinto libro. Lui, chimico di professione, lavorò per 30 anni presso la fabbrica di vernici Siva di Settimo Torinese, essendone prima direttore tecnico e poi direttore commerciale. Dopo il successo editoriale di Se questo è un uomo, una delle più toccanti opere della letteratura europea sulla realtà dei lager e nei quali Levi venne chiamato a svolgere mansioni di chimico, lo scrittore volle ancora tornare con Il sistema periodico al suo particolare rapporto con la scienza dei materiali. Il libro è infatti una originalissima riflessione articolata in 21 capitoli, ciascuno dei quali viene a essere ispirato da un diverso elemento della tavola di Mendeleev. Forse è però proprio nel capitolo iniziale, intitolato Argon, che Primo Levi riesce a offrire al lettore uno dei più riusciti esempi di quell’agognato dialogo fra la cultura umanistica e quella scientifica che raramente ha fatto capolino nella letteratura. Lo scrittore torinese si serve infatti delle proprietà degli elementi del diciottesimo gruppo della tavola periodica, quello dei gas nobili o inerti, per tratteggiare con efficacia e asciuttezza le caratteristiche salienti degli avi della sua famiglia: «Ci sono nell’aria che respiriamo, i cosiddetti gas inerti. (...). Sono, appunto, talmente inerti, talmente paghi della loro condizione, che non interferiscono in alcuna reazione chimica, non si combinano con alcun altro elemento, e proprio per questo motivo sono passati inosservati per secoli (...). Il poco che so dei miei antenati li avvicina a questi gas (...) le vicende che vengono loro attribuite hanno in comune qualcosa di statico, un atteggiamento di dignitosa astensione, di volontaria (o accettata) relegazione al margine del gran fiume della vita».
La vite tellurica
Riproduzione della prima versione della vite tellurica, il modello di classificazione degli elementi proposto nel 1862 dal geologo francese Alexandre-Émile Béguyer de Chancourtois. La tavola veniva applicata attorno a un cilindro con gli elementi che in tal modo si disponevano in una spirale continua in ordine di peso atomico crescente. In tal modo gli elementi con caratteristiche simili, come per esempio ossigeno, zolfo e selenio, apparivano posizionati su linee verticali. Egli chiamò la sua vite ‘tellurica’ per evidenziare il privilegio del tellurio, posizionato proprio in mezzo alla spirale.