Neurone
Neurone
I n. sono i componenti fondamentali dei circuiti nel tessuto nervoso. Essi possiedono un'importante proprietà biofisica, quella della segnalazione elettrica, ossia la capacità di generare variazioni del potenziale elettrico di membrana per trasferire informazioni a distanza. Le cellule gliali, l'altro contingente cellulare del tessuto nervoso, non sono capaci di segnalazione elettrica, pur partecipando alla comunicazione nervosa. Da un punto di vista citologico, i n. sono simili alle altre cellule del nostro organismo: si distinguono un corpo cellulare (o soma, perikaryon, pirenoforo) e due tipi di prolungamenti chiamati rispettivamente dendriti e assone (o cilindrasse, neurite), lungo i quali il n. trasporta a distanza l'impulso nervoso. Il soma contiene il nucleo, la sostanza di Nissl (costituita da aggregati di ribosomi e di reticolo endoplasmatico rugoso) e apparati di Golgi multipli. Da esso si dipartono i vari prolungamenti. I dendriti sono prolungamenti corti (di solito inferiori a 700μm), contenenti un'impalcatura di microtubuli e neurofilamenti. Essi hanno in molti casi una specializzazione strutturale chiamata spina dendritica, sito privilegiato di comunicazione fra neuroni. La spina dendritica si interfaccia con un terminale nervoso (bottone terminale), che è l'estremità dell'assone di un altro neurone. L'assone è di solito più lungo dei dendriti (fino al metro di lunghezza nel nervo sciatico). Esso inizia dal soma con il cono di emergenza; poi segue un lungo segmento cilindrico con citoplasma, microtubuli, neurofilamenti e piccole vescicole in transito; in molti casi questo segmento è avvolto da una guaina discontinua (guaina mielinica) che lo isola dai tessuti circostanti migliorando notevolmente la propagazione degli impulsi elettrici. I siti privilegiati di comunicazione intercellulare del n. sono chiamati sinapsi. A livello di questi siti, l'impulso elettrico transita da una cellula all'altra, sfruttando un processo chiamato trasmissione sinaptica. In base alla struttura, le sinapsi si possono dividere in due tipi: elettriche e chimiche. Nelle sinapsi elettriche, comuni negli invertebrati, l'impulso nervoso transita come cariche ioniche da cellula a cellula, attraverso particolari apparati giunzionali chiamati giunzioni serrate o gap junctions. Queste giunzioni sono costituite da 'pori' proteici (connessoni) a permeabilità variabile, che connettono il citoplasma di due cellule. Le sinapsi chimiche, le più diffuse tra i vertebrati, operano invece un elaborato processo di trasduzione vettoriale del segnale, attraverso il quale un impulso elettrico viene convertito nel rilascio di un segnale chimico da parte della cellula nervosa che invia il messaggio; la cellula che lo riceve traduce il messaggio chimico in un nuovo impulso elettrico. Le sinapsi chimiche sono formate da due compartimenti, il compartimento presinaptico (o presinapsi) e quello postsinaptico (o postsinapsi), che si giustappongono, separati dalla fessura sinaptica. Nella presinapsi sono presenti organelli secretori specializzati, le vescicole sinaptiche, che contengono il segnale chimico o neurotrasmettitore. Le vescicole sinaptiche si trovano concentrate lungo un'area specializzata della membrana presinaptica, la zona attiva. L'arrivo dell'impulso nervoso provoca l'entrata del Ca++ nella presinapsi, che a sua volta scatena l'esocitosi del neurotrasmettitore nella fessura sinaptica. Da qui, esso diffonde verso specifici recettori posti nella membrana postsinaptica. Tali recettori possono essere proteine-canali che traducono il segnale chimico del neurotrasmettitore in un nuovo impulso elettrico o recettori metabotropici che attivano processi di segnalazione intracellulare. Dopo questa breve introduzione al n., ci si soffermerà su tre aspetti della neurobiologia, i cui avanzamenti sono stati così cruciali da influenzare profondamente i concetti stessi di identità e funzionalità del n. stesso.
Neurogenesi
Per neurogenesi si intende il processo attraverso il quale vengono generati nuovi n. da cellule immature. Si possono distinguere due tipi di neurogenesi: la neurogenesi durante lo sviluppo, che forma il nevrasse, e la neurogenesi dell'adulto, il cui significato è legato alla plasticità funzionale di determinate aree nervose.
Neurogenesi durante lo sviluppo
Lo scopo di questo processo consiste nell'assemblare i circuiti nervosi attraverso i quali viaggerà e verrà elaborata l'informazione nervosa, dalla più semplice (quale l'arco riflesso) alla più complessa (quali l'intelligenza e l'emozione). Lo sviluppo neuronale procede attraverso una serie di tappe ben definite che possono essere così schematizzate: a) induzione neuronale, quando una cellula ectodermica intraprende un processo di differenziamento in cellula nervosa; b) specificazione neuronale, quando una cellula nervosa si specializza per diventare un particolare tipo (e sottotipo) di n.; c) crescita assonale e riconoscimento del bersaglio, quando i n. emettono i loro prolungamenti e vanno a formare i circuiti nervosi; d) sinaptogenesi, quando vengono formate le sinapsi tra i vari n. e tra questi e le loro cellule effettrici; e) sopravvivenza neuronale, ossia il meccanismo di selezione dei circuiti efficaci e di omeostasi del tessuto nervoso.
Induzione neuronale. - Il tessuto nervoso deriva dallo stesso ectoderma dal quale si originano l'epidermide e annessi. Per induzione neuronale si intende quel processo per cui cellule ectodermiche vengono determinate a diventare cellule staminali (o precursori) neuronali. Ciò avviene a seguito del rilascio di una serie di fattori (o citochine, v.) da parte delle cellule vicine. Le cellule ectodermiche sulle quali hanno agito questi fattori tendono a non rispondere più ad altri segnali che inducono percorsi di differenziazione alternativi, diventando così progressivamente indirizzati (committed) al destino neuronale. Storicamente, la prima evidenza dell'induzione neuronale è venuta da studi di trapianto in embrioni di anfibi compiuti nella metà degli anni Venti del 20° secolo. In questi studi si era visto che se si trapiantava il labbro dorsale del blastoporo (zona successivamente chiamata organizzatore) di un embrione in gastrulazione nella regione che forma l'epidermide di un altro embrione di pari età, le cellule ectodermiche circondanti il trapianto formavano un secondo sistema nervoso completamente sviluppato. Questa osservazione ha generato l'idea che l'organizzatore sia fonte di segnali induttivi in senso proneuronale per le cellule ectodermiche vicine. Risale alla metà degli anni Novanta l'identificazione dei primi segnali molecolari secreti dall'organizzatore e l'elaborazione di un modello che ben spiega l'induzione neuronale negli anfibi.
L'idea centrale è che le cellule ectodermiche, in mancanza di altri segnali, seguano un programma spontaneo di differenziazione neuronale, mentre siano deviate verso un programma epiteliale se in esse è attivato il segnalamento dipendente da BMP (Bone Morphogenetic Protein). BMP è una proteina secreta ubiquitariamente da tutti i tessuti, che stimola potentemente tutte le cellule ectodermiche a differenziarsi in cellule epiteliali, sopprimendo il loro programma endogeno proneuronale. Durante la gastrulazione, l'organizzatore secerne però fattori che inibiscono il segnalamento di BMP, permettendo così alle cellule ectodermiche circostanti di eseguire il loro programma intrinseco di sviluppo, che è quello neuronale. Studi successivi hanno dimostrato però come l'organizzatore non sia richiesto per l'induzione neuronale negli amnioti (inclusi i mammiferi) iniziando questa allo stadio di blastula, prima della formazione dell'organizzatore. In generale, negli amnioti l'induzione neuronale appare come un processo più complesso che negli anfibi, con uno straordinario concorso di istruzioni non solo negative ma anche positive, che solamente in parte sono dipendenti dalla segnalazione di BMP.
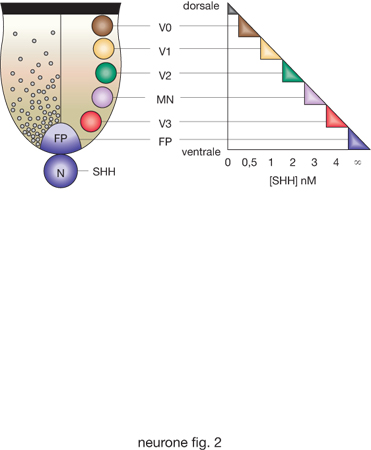
Specificazione neuronale. - Dopo l'iniziale differenziamento in senso neuronale, la successiva decisione riguarda quale tipo di n. tale cellula vuole diventare: un n. sensitivo, un n. motorio, un interneurone o un altro tipo di neurone. Poi deve scegliere quale posizione vuole occupare nel sistema nervoso e quali contatti vorrà formare con altri elementi nervosi, andando così via via a costituire i circuiti del sistema nervoso adulto. L'insieme di tutte queste decisioni, posteriori all'induzione neuronale, prende il nome di specificazione neuronale. Tale processo dipende da due sistemi di segnalazione che creano gradienti lungo i due assi principali del tubo neuronale, l'asse dorsoventrale e quello rostrocaudale. Questi due sistemi di segnalazione s'intersecano lungo tutto il tubo neurale generando una griglia di stimoli posizionali. In altre parole, la posizione delle cellule progenitrici neuronali lungo gli assi dorsoventrale e craniocaudale influenza il loro destino, a causa della differente concentrazione e identità dei segnali induttivi ai quali sono sottoposte. La differenziazione dorsale è inizialmente indotta da segnali provenienti dall'adiacente ectoderma, mentre la differenziazione ventrale dipende da segnali del mesoderma assiale che costituisce la notocorda. Questi segnali, provenienti da tessuti non-nervosi, sono rapidamente trasferiti alle cellule dorsali e ventrali del tubo neurale per induzione omogenica. Numerosi studi hanno mostrato che i segnali chiave per il differenziamento ventrale (dei motoneuroni) e dorsale (dei n. sensitivi) sono, rispettivamente, le proteine secrete SHH (Sonic Hedgehog) e BMP.
Il gradiente di concentrazione di SHH, che è progressivamente decrescente in senso ventrodorsale, permette di specificare diverse classi di motoneuroni e interneuroni ventrali (fig. 1). L'azione di BMP delinea, invece, un'intricata griglia di segnali che organizzano e determinano diversi tipi di interneuroni commissurali e associativi del corno posteriore.
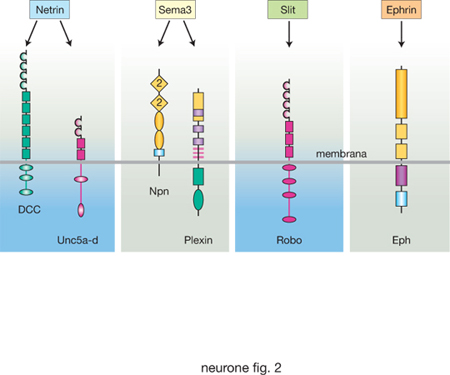
Crescita assonale. - Il prolungamento assonico è la porzione del n. che durante lo sviluppo va attivamente alla ricerca di altre cellule (nervose e non) allo scopo di stabilire con esse contatti sinaptici. Questi siti privilegiati di comunicazione non sono scelti a caso, ma rappresentano bersagli finemente selezionati in base all'analisi di molteplici segnali ambientali. Il compito di guidare l'assone verso i propri bersagli è svolto dal cono di crescita, una struttura specializzata altamente mobile, posta alla punta dell'assone. Attraverso la ciclica estensione e retrazione di sottili propaggini citoplasmatiche, chiamate filopodi, il cono di crescita esplora i segnali ambientali e seleziona accuratamente una corretta traiettoria per giungere al bersaglio. Il macchinario che permette il movimento del cono di crescita è il citoscheletro di actina, che si polimerizza e depolimerizza rapidamente in risposta agli stimoli ambientali. Le molecole che attivano la motilità del cono di crescita, guidandolo verso il bersaglio, possono essere divise, in base alla loro specifica funzione, in molecole chemotattiche o chemorepulsive; esse possono agire a breve o a lunga distanza a seconda che siano molecole ancorate alla cellula o molecole diffusibili. Sono state individuate quattro famiglie principali di fattori che regolano la crescita dei neuriti: netrin, semaphorin, ephrin e Slits e loro recettori (v. fig. 2). È importante osservare come queste molecole siano non solo essenziali per guidare gli assoni, ma anche per guidare lo sviluppo dei vasi sanguigni, dando così un importante fondamento molecolare al fatto che vasi e nervi seguono percorsi comuni. Ai fattori descritti vanno aggiunte anche neurotrofine e le solite citochine (SHH, Wnt e BMP), che collaborano, con funzione regolatoria, alla crescita neuritica.
Sinaptogenesi. - La formazione delle sinapsi nei vertebrati avviene in un arco di tempo piuttosto lungo, iniziando nell'embrione ed estendendosi poi alle fasi iniziali della vita postnatale. In alcune aree del sistema nervoso centrale (SNC), la sinaptogenesi non cessa mai, continuando anche nella vita adulta. La formazione della sinapsi durante lo sviluppo è intimamente accoppiata al processo di riconoscimento del giusto bersaglio. Tale processo è tuttavia un presupposto necessario ma non sufficiente per la sinaptogenesi. Infatti, anche dopo che il bersaglio è stato raggiunto, le sinapsi attendono ancora giorni o settimane prima di iniziare a funzionare e la maggior parte di esse non sopravvive dopo aver iniziato l'attività. Nella sinaptogenesi si possono distinguere diverse fasi, regolate da una miriade di molecole di segnalazione. Gli assoni, dopo essere stati guidati al bersaglio, incontrano fattori solubili che pur non inducendo direttamente la sinaptogenesi, favoriscono la maturazione assonale e dendritica. Questi fattori sono secreti sia dai n. sia dalla glia. Quindi, molecole di adesione cellula-cellula della famiglia delle caderine stabilizzano le iniziali interazioni fra n. e cellula bersaglio, fissando, almeno in parte, i siti dei futuri contatti sinaptici. Infine, la maturazione finale del terminale nervoso dipende dal traffico di vescicole all'interno della cellula. Infatti, i vari componenti della presinapsi e della postsinapsi vengono trasportati alla loro destinazione in pacchetti di trasporto, ossia in vescicole che riuniscono assieme proteine e lipidi necessari a espletare specifiche funzioni. È importante notare che pre- e postsinapsi maturano in maniera coordinata, mantenendo una stretta correlazione fra le dimensioni dei loro vari componenti (inclusi il volume del compartimento presinaptico e postsinaptico, il numero totale di vescicole sinaptiche, il numero di vescicole attaccate alla zona attiva, l'estensione della zona attiva e della densità postsinaptica). L'esistenza di questa correlazione fa supporre che vi sia un continuo scambio di informazioni fra pre- e postsinapsi, operato probabilmente dai complessi giunzionali che stabilizzano la sinapsi e/o da fattori secreti pre- e postsinapticamente. Il numero di sinapsi che si forma durante lo sviluppo è esorbitante, rispetto alle sinapsi presenti nell'adulto. Intrinseco alla sinaptogenesi è quindi il processo speculare di eliminazione sinaptica. Evidenze genetiche e sperimentali mostrano come l'attività sinaptica (e quindi l'uso), sia il principale mezzo di sopravvivenza dei contatti nervosi, ma non sia richiesta per la formazione delle sinapsi, potendosi generare sinapsi normali, per numero e aspetto, anche in assenza di rilascio del neurotrasmettitore. Se non c'è rilascio di neurotrasmettitore, le sinapsi non sono però stabili e degenereranno subito dopo la nascita, poiché non funzionanti.
Sopravvivenza neuronale. - La formazione dell'architettura circuitale del sistema nervoso è un processo largamente antieconomico, in cui vengono non solo generate più sinapsi del necessario, ma anche molti più n. di quelli che poi costituiranno il sistema nervoso dell'adulto. Il processo biologico che opera l'eliminazione dei n. sovrannumerari è l'apoptosi o morte cellulare programmata, un complesso programma genetico presente in tutte le cellule. Il ruolo essenziale dell'apoptosi nello sviluppo del sistema nervoso è illustrato da esperimenti genetici sul topo, in cui la mancata attivazione di questo processo porta invariabilmente a un'enorme sovraccrescita del tessuto nervoso, mentre l'effetto sugli altri tessuti è molto meno drammatico.
Numerose evidenze sperimentali mostrano che la sopravvivenza di un n. dipende da una serie di fattori trofici o di sopravvivenza rilasciati dalle cellule circostanti; questi fattori sopprimono attivamente il programma dell'apoptosi, mantenendo in vita il n. stesso. Nelle prime fasi della neurogenesi, i fattori trofici sono essenzialmente gli stessi che regolano l'induzione e la specificazione neuronale. Essi vengono poi sostituiti da fattori di crescita secreti dalle cellule gliali; questi mantengono in vita i n. fino al raggiungimento del bersaglio. Giunto in prossimità di quest'ultimo, l'assone inizia a captare e a trasportare in maniera retrograda, verso il soma, nuovi fattori neurotrofici rilasciati dal bersaglio stesso. Questi diventano rapidamente e per un periodo di tempo limitato, indispensabili per la sopravvivenza del n. che ha raggiunto il bersaglio. Il NGF (Nerve Growth Factor) è il primo identificato, più noto e meglio studiato di questi fattori; esso è essenziale per la sopravvivenza dei n. simpatici. I n. centrali necessitano invece di una pletora di fattori neurotrofici per non andare incontro ad apoptosi nel periodo critico del raggiungimento del bersaglio. Infine, quando il n. si inserisce in uno specifico circuito nervoso, è lo stabilirsi di un'efficace attività elettrica che ne evita la morte. Il programma dell'apoptosi opera incessantemente durante ogni tappa del processo di neurogenesi. Esso è tuttavia tanto più attivo quanto più i n. si instradano nel processo differenziativo, a suggerire che l'apoptosi operi un controllo di qualità atto a eliminare n. funzionalmente difettivi. Durante l'induzione e la specificazione neuronale verrebbero quindi eliminati n. con difetti proliferativi, che non rispondono correttamente ai morfogeni o che ne disturbano i gradienti; poi verrebbero eliminati i n. i cui assoni non raggiungono il bersaglio; infine verrebbero eliminati i n. che non si integrano correttamente nei circuiti nervosi.
Neurogenesi nell'adulto
All'inizio del 20° sec., le osservazioni di S. Ramon y Cajal avevano escluso che la maggior parte dei n. fosse capace di riprodursi dopo la nascita. L'introduzione di tecniche specializzate ha permesso di scoprire che in realtà vi sono due aree ristrettissime del nevrasse in cui i n. proliferano attivamente: la zona subventricolare dei ventricoli laterali e la zona subgranulare del giro dentato dell'ippocampo. Si pensa che siano specialmente gli astrociti e le cellule endoteliali delle aree neurogeniche e delle corrispondenti aree bersaglio a fornire i fattori trofici necessari per la maturazione e integrazione dei nuovi neuroni. La neurogenesi fuori da queste due zone appare estremamente limitata nell'individuo sano; tuttavia, in seguito a processi patologici, quali danni ischemici, epilessia e malattie degenerative, altre aree del sistema nervoso centrale possono diventare attivamente neurogeniche. Tuttavia, i n. che proliferano in esse o non raggiungono mai la piena integrazione funzionale, o alterano profondamente le circuitazioni nervose in cui si inseriscono, peggiorando la patologia. Il significato funzionale della neurogenesi nell'adulto è piuttosto oscuro. è provato, tuttavia, che la distruzione delle cellule staminali ippocampali (a seguito di irradiazione) produce una riduzione delle performances comportamentali dipendenti da quest'area. Parimenti, l'esercizio intensivo in alcuni di questi paradigmi stimola potentemente la neurogenesi ippocampale. Evidenze simili sono state ottenute anche per la funzione olfattiva, a indicare che la neurogenesi è cruciale per la plasticità funzionale di queste aree.
Rilascio del neurotrasmettitore
La trasmissione chimica dell'impulso nervoso da un n. all'altro (o a una cellula effettrice) avviene attraverso il rilascio del neurotrasmettitore contenuto nelle vescicole sinaptiche. A partire dalla scoperta della neurotrasmissione, è apparso quindi di fondamentale importanza identificare e caratterizzare il macchinario molecolare alla base di questo processo. Solamente dall'inizio degli anni Novanta del 20° sec. è stato però possibile procedere sistematicamente alla identificazione e caratterizzazione di molecole che regolano il traffico delle vescicole sinaptiche, grazie allo sviluppo e alla convergenza di tecniche biochimiche, biologico-molecolari, genetiche e morfologiche. Le vescicole sinaptiche sono organelli di diametro uniforme per le vescicole che contengono neurotrasmettitori ad azione rapida (circa 50 nm), le cui apparenti uniche funzioni sono caricarsi del neurotrasmettitore e rilasciarlo al momento in cui arriva l'impulso nervoso.
Per poter assolvere a queste operazioni, esse contengono due classi di componenti obbligatori: proteine che servono a riempire la vescicola con il neurotrasmettitore e fattori implicati nel traffico di membrana.
Caricamento del neurotrasmettitore
Le vescicole sinaptiche accumulano il neurotrasmettitore per trasporto attivo. L'energia usata per quest'operazione deriva dal gradiente elettrochimico creato dalla pompa protonica vacuolare, vale a dire un complesso multiproteico che consuma ATP per spostare ioni H+ all'interno del lume vescicolare. Il neurotrasmettitore entra poi nella vescicola, attraverso un proprio trasportatore di neurotrasmettitori, una proteina canale che permette il passaggio selettivo di specifici neurotrasmettitori.
Il processo di esocitosi
I fattori che controllano il traffico delle vescicole sinaptiche costituiscono un insieme molto complesso, di natura mista proteico-lipidica, di cui si conoscono in dettaglio solo alcuni aspetti. La fusione intracellulare di due compartimenti di membrana è ottenuta generalmente attraverso l'interazione di proteine SNARE (SNAP Receptors), presenti su entrambe le membrane che si fondono. Tali proteine associano spontaneamente fra loro attraverso motivi SNARE che sono costituiti da circa 70 residui aminoacidici. L'associazione di quattro differenti motivi SNARE (presenti in differenti proteine SNARE) forma il complesso di fusione che è necessario e sufficiente per guidare la fusione delle membrane. L'esocitosi sinaptica è mediata da tre proteine SNARE: synaptobrevin (anche chiamata VAMP, Vesicle Associated Membrane Protein) sulla vescicola sinaptica, e syntaxin-1 e SNAP-25 posta sulla membrana presinaptica. Synaptobrevin e syntaxin forniscono un motivo SNARE ciascuna, mentre SNAP-25 fornisce due motivi SNARE per formare il complesso di fusione la cui struttura è oggi conosciuta a livello atomico. Le vescicole sinaptiche non si fondono però spontaneamente con la membrana presinaptica, ma attendono l'entrata del Ca++ nel terminale nervoso per rilasciare il neurotrasmettitore. Il Ca++ entra nella presinapsi per l'apertura, a seguito di stimolazione elettrica, o dei canali di tipo P/Q (CaV2.1) o dei canali di tipo N (CaV2.2) del Ca++. Transienti di Ca++ intorno a 5-10 µM per meno di 1 ms sono sufficienti a scatenare un rilascio del neurotrasmettitore.
La modellizzazione matematica di questo processo ha portato a ipotizzare che il Ca++ rilasci il neurotrasmettitore per interazione con uno specifico sensore dotato di cinque siti cooperativi di legame per il Ca++ con affinità µmolare. Evidenze accumulate a partire dalla metà degli anni Novanta, in particolare in modelli genetici murini, hanno identificato nelle synaptotagmin(s) tali sensori per il Ca++. Le synaptotagmin(s) sono un'ampia famiglia di proteine transmembrana della vescicola sinaptica che legano il complesso SNARE e che sono dotate di due domini citoplasmatici che legano complessivamente 5 ioni Ca++ con bassa affinità (nel range mM); questa affinità è cooperativa e aumenta drammaticamente, fino a portarsi nel range ipotizzato dai modelli matematici, in seguito al legame di questi domini con i fosfolipidi di membrana.
Il modello proposto per spiegare l'attività di sinaptotagmin nel processo di fusione può essere così schematizzato. Il complesso SNARE è altamente instabile e, se fosse lasciato a sé stesso, indurrebbe spontaneamente la fusione di membrana. Per questa ragione, una volta assemblato, esso deve essere prontamente stabilizzato da una serie di proteine. Quindi viene reclutata synaptotagmin che può legare il complesso SNARE in maniera Ca++-indipendente. L'arrivo del Ca++ romperebbe l'equilibrio, facendo spostare rapidamente synaptotagmin dal complesso SNARE verso i lipidi della membrana per cui ne aumenterebbe l'affinità. La conseguente rapida perturbazione meccanica scatenerebbe il collasso del complesso SNARE, avvicinando le due membrane fino alla fusione. In aggiunta al Ca++ sono stati caratterizzati anche altri livelli di controllo del rilascio del neurotrasmettitore che non sono integrabili nel modello precedentemente descritto. Uno dei più importanti è rappresentato dalle proteine SM (Munc18-1, -2, -3), la cui delezione provoca invariabilmente il blocco dell'esocitosi. Queste proteine legano syntaxin e probabilmente aiutano la formazione del complesso di fusione agendo da proteine chaperon. Un altro livello è rappresentato dall'interazione del complesso SNARE con alcune proteine della zona attiva, la cui azione è anche in questo caso essenziale per l'esocitosi.
Collettivamente, questi studi mostrano come la vescicola sinaptica abbia necessità di andare verso un complesso processo di maturazione (priming) prima di essere capace di rispondere al Ca++, con la probabile funzione di migliorare il controllo sulla secrezione sinaptica. Evidenze elettrofisiologiche combinate a osservazioni morfologiche hanno evidenziato che non tutte le vescicole sinaptiche hanno la medesima probabilità di fondersi con la membrana presinaptica. In base a queste osservazioni, è possibile suddividere le vescicole sinaptiche in tre differenti pool in equilibrio fra loro. In seguito all'arrivo del potenziale d'azione, solo le vescicole attraccate (docked) alla membrana presinaptica hanno un'elevata probabilità di rilasciare il neurotrasmettitore; esse costituiscono il pool delle vescicole prontamente rilasciabili (readily-releasable pool). La stimolazione prolungata mobilizza un altro pool di vescicole, più distanti dalla membrana sinaptica, il pool di riserva, che va a rifornire il pool delle vescicole prontamente rilasciabili. In alcune sinapsi è presente un terzo pool, il pool di riposo, il più distante dalla membrana presinaptica, che è difficilmente mobilizzabile anche in presenza di prolungate stimolazioni ad alta frequenza.
In generale, il rapporto fra pool prontamente rilasciabile e pool di riserva varia in maniera dinamica in base all'attività pregressa della terminazione nervosa, attraverso un meccanismo che coinvolge i livelli intracellulari di Ca++. Il Ca++ attiverebbe quindi non solo la deplezione ma anche il riempimento del pool rilasciabile, in un equilibrio dinamico che determina l'efficienza della trasmissione sinaptica. Questo meccanismo offre una spiegazione molecolare dei processi di plasticità che coinvolgono un'aumentata o diminuita efficienza dei n. a rilasciare neurotrasmettitori.
Esperimenti morfologici, genetici e funzionali hanno implicato le sinapsine nell'organizzazione di questi pool vescicolari.
Endocitosi della vescicola sinaptica
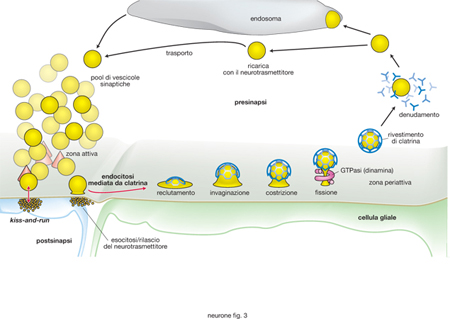
Per sostenere il rilascio del neurotrasmettitore nel tempo, i componenti della vescicola sinaptica devono essere recuperati rapidamente ed efficientemente. Sono stati proposti due modelli per spiegare meccanicisticamente questo processo (v. fig. 3). Il primo modello propone che le vescicole sinaptiche aprano un poro transitorio di fusione nella zona attiva, per la fuoriuscita del neurotrasmettitore. La semplice chiusura di questo poro porterebbe al riciclo della vescicola sinaptica nella stessa zona in cui è avvenuta la fusione (ipotesi dell'endocitosi rapida o kiss-and-run/kiss-and-stay). Nel secondo modello, le vescicole sinaptiche si fonderebbero nella zona attiva della presinapsi per rilasciare il neurotrasmettitore e poi sarebbero ricatturate fuori da questa zona (nella zona periattiva), attraverso il processo dell'endocitosi mediata da clatrina (ipotesi dell'endocitosi lenta o mediata da clatrina). Studi elettrofisiologici e morfologici mostrano come i due modelli non siano in antagonismo fra loro ma anzi coesistano in varie sinapsi, con un 5-20% di tutti gli eventi di esocitosi che si concludono con endocitosi rapida. Quest'ultima prevarrebbe nelle prime fasi di stimolazione, permettendo il riciclo della vescicola sinaptica in frazioni di secondo. La stimolazione prolungata risulterebbe invariabilmente in un'endocitosi più lenta con una costante di tempo di qualche decina di secondi. Mentre il macchinario molecolare che sostiene l'endocitosi rapida è in gran parte sconosciuto, progressi sono stati invece compiuti nella caratterizzazione dei componenti che prendono parte all'endocitosi mediata da clatrina. Si è visto, innanzitutto, che il macchinario dell'endocitosi alla presinapsi è simile a quello presente in tutte le cellule per l'endocitosi mediata da recettore. Tale processo inizia con il reclutamento del complesso adattatore tetramerico AP2 alla membrana della zona periattiva della presinapsi, mediante una serie di segnali che sono in parte proteici (synaptotagmin) e in parte lipidici (i fosfoinositidi).
Quindi AP2 recluta la clatrina che si assembla a formare un lattice piatto; un riarrangiamento spontaneo di questo lattice, e possibilmente una modificazione della composizione lipidica di membrana, portano a una progressiva invaginazione della membrana. La costrizione e fissione della membrana internalizzata richiede l'attività della GTPasi dynamin. Vengono così generate vescicole libere che sono denudate del loro rivestimento di clatrina da un apposito complesso enzimatico costituito dal chaperone Hsc70 e dalla proteina auxilin. Nella presinapsi, la vescicola è quindi riempita del neurotrasmettitore e riportata nel pool delle vescicole rilasciabili/di riserva, pronta per andare incontro a un nuovo evento esocitotico.
Oltre ai componenti strutturali dell'endocitosi sono stati identificati fattori proteici e lipidici che interagiscono con il macchinario di riciclo durante le varie fasi del processo e che servono a regolarlo e a coordinarne l'azione con altri processi intracellulari. Molti di questi fattori, chiamati collettivamente fattori accessori dell'endocitosi, sono prevalentemente espressi nella sinapsi. Questo fatto potrebbe fornire una spiegazione diretta alla rapidità e all'efficienza dell'endocitosi sinaptica che è incomparabilmente superiore all'endocitosi che avviene in tutte le cellule.
Rapporti fra neuroni e astroglia
Gli astrociti formano una rete estesa di cellule che riveste i n. e i vasi, formandone l'impalcatura di sostegno, ma anche separandoli e isolandoli fra di loro. Ogni astrocita prende contatto con decine di n. e migliaia di sinapsi, occupando un proprio territorio in cui penetrano solo poche ramificazioni di altri astrociti. Circa la metà di queste cellule ha un corpo cellulare irregolare, lunghi prolungamenti, un potenziale di membrana molto negativo, e infine la capacità di internalizzare vari neurotrasmettitori e un forte accoppiamento funzionale tramite giunzioni comunicanti. L'altra metà degli astrociti costituisce invece una popolazione cellulare estremamente eterogenea per caratteristiche morfologiche, biochimiche e funzionali. Gli astrociti sono in contatto con i terminali nervosi sia indirettamente, concorrendo a sigillare la fessura sinaptica, sia direttamente, tramite apposite sinapsi ectopiche che le cellule nervose formano sugli astrociti. I neurotrasmettitori rilasciati a questi siti sono in grado di agire su specifici recettori accoppiati a proteine G degli astrociti. Tali recettori scatenano a loro volta una cascata di segnalazione intracellulare che ha come effetto diretto l'aumento della concentrazione intracellulare di Ca++ per rilascio dai depositi intracellulari (principalmente il reticolo endoplasmatico liscio). Questi transienti di calcio diffondono nella rete astrocitaria (che può essere considerata un sincizio funzionale) e provocano l'esocitosi di gliotrasmettitori. Questi ultimi andranno ad agire sia sui n. sia su altre cellule gliali scatenando un processo di comunicazione cellula-cellula chiamato gliotrasmissione. L'effetto dei gliotrasmettitori sui n. è vario, andando a regolare il livello di eccitabilità neuronale e la plasticità sinaptica.
Data l'organizzazione tridimensionale dei processi astrocitari e il forte accoppiamento fra astrociti vicini (tramite gap junctions), è stato visto che la gliotrasmissione può sincronizzare l'attività di ampie popolazioni neuronali, non connesse sinapticamente fra di loro. La gliotrasmissione rappresenta anche un importante meccanismo per segnalare ai vasi il livello di attività nervosa, per i necessari adeguamenti del flusso ematico: quando il livello dell'attività sinaptica sale, questa induce l'attivazione degli astrociti (transienti di calcio) e la conseguente liberazione di sostanze vasoattive (fra cui NO ed eicosanoidi) che favoriscono la vasodilatazione, contribuendo a sostenere l'aumentato consumo energetico.
In conclusione, gli astrociti sono cellule 'metabolicamente eccitabili' (tramite transienti di calcio) che prendono parte attiva nella neurotrasmissione rilasciando appositi gliotrasmettitori. A differenza dei n., però, gli astrociti non sono in grado di generare potenziali d'azione (essendo privi di canali Na+ voltaggio-dipendenti), e pertanto non sono in grado di operare una segnalazione rapida e spazialmente definita come i neuroni. Tuttavia, la gliotrasmissione rappresenta una modalità lenta di segnalazione diffusa nei circuiti nervosi, con la capacità di modulare, sincronizzare e modificare l'eccitabilità neuronale, l'elaborazione delle informazioni e il flusso ematico regionale.
bibliografia
T.M. Jessell, Neuronal specification in the spinal cord: inductive signals and transcriptional codes, in Nature reviews. Genetics, 2000, 1, 1, pp. 20-29.
D. Nijhawan, N. Honarpour, X. Wang, Apoptosis in neural development and disease, in Annual review of neuroscience, 2000, 23, pp. 73-87.
V.I. Slepnev, P. De Camilli, Accessory factors in clathrin-dependent synaptic vesicle endocytosis, in Nature reviews. Neuroscience, 2000, 1, 3, pp. 161-72.
S.I. Wilson, T. Edlund, Neural induction: toward a unifying mechanism, in Nature neuroscience, 2001, 4° suppl., pp. 1161-68.
N. Bertrand, D.S. Castro, F. Guillemot, Proneural genes and the specification of neural cell types, in Nature reviews. Neuroscience, 2002, 3, 7, pp. 517-30.
L. Bally-Cuif, M. Hammerschmidt, Induction and patterning of neuronal development, and its connection to cell cycle control, in Current opinion in neurobiology, 2003, 13, 1, pp. 16-25.
G. Kempermann, L. Wiskott, F.H. Gage, Functional significance of adult neurogenesis, in Current opinion in neurobiology, 2004, 14, 2, pp. 186-91.
T.C. Sudhof, The synaptic vesicle cycle, in Annual review of neuroscience, 2004, 27, pp. 509-47.
A. Eichmann, F. Le Noble, M. Autiero et al., Guidance of vascular and neural network formation, in Current opinion in neurobiology, 2005, 15, 1, pp. 108-15.
A. Volterra, J. Meldolesi, Astrocytes, from brain glue to communication elements: the revolution continues, in Nature reviews. Neuroscience, 2005, 6, 8, pp. 626-40.
C.L. Waites, A.M. Craig, C.C. Garner, Mechanisms of vertebrate synaptogenesis, in Annual review of neuroscience, 2005, 28, pp. 251-74.