neurone
neurone
I neuroni sono cellule fondamentali per la funzione del tessuto nervoso, specializzate nella comunicazione intra- e intercellulare mediante segnali elettrici lungo i loro prolungamenti dendritici e assonali e segnali chimici attraverso le sinapsi. I neuroni assumono una grande varietà di forme differenti, per ciò che riguarda la morfologia e l’estensione sia della arborizzazione dendritica sia dell’assone. La morfologia della arborizzazione dendritica e la precisa localizzazione delle sinapsi afferenti sull’albero dendritico hanno profonde implicazioni funzionali per l’innesco o meno dei potenziali d’azione a livello assonale. La complessa morfologia dei neuroni pone il problema di come le terminazioni sinaptiche vengano rifornite efficientemente delle proteine necessarie per le loro funzioni, in relazione alla attività elettrica. Studi avanzati dimostrano la capacità dei neuroni di delocalizzare parte dei meccanismi di espressione genica, dal corpo cellulare alle terminazioni sinaptiche stesse, esercitando una sorta di controllo locale. [➔ depressione a lungo termine; differenziamento neuronale; microRNA e cervello; neurotrasmettitori; neutrofine; plasticità neurale; potenziamento a lungo termine; recettore nervoso; sinapsi; trasporto assonale]
I n. sono i componenti fondamentali dei circuiti nel tessuto nervoso. Sono cellule caratterizzate da una complessa e spazialmente estesa morfologia, specializzate nella comunicazione intra- e intercellulare. I n. possiedono, infatti, la fondamentale proprietà biofisica di generare variazioni del potenziale elettrico di membrana per trasmettere informazioni a distanza (segnalazione elettrica) e di inviare segnali chimici (segnalazione chimica), attraverso le sinapsi (➔), strutture specializzate di comunicazione tra neuroni.
Scoperta dei neuroni
L’identificazione del n. come unità funzionale indipendente del tessuto nervoso fu il risultato di un acceso dibattito, alla fine del 19° sec., tra l’italiano Camillo Golgi, che proponeva la cosiddetta teoria reticolare (secondo la quale il tessuto nervoso sarebbe una rete cellulare nervosa continua e indistinta) e il neuroanatomista spagnolo Santiago Ramón y Cajal, fautore della cosiddetta dottrina del neurone. I neuroscienziati dell’epoca incontravano infatti notevoli difficoltà a risolvere, con i microscopi e le tecniche di colorazione allora disponibili, la natura unitaria delle cellule nervose, a causa del fitto e intricato reticolo del tessuto nervoso. Dalle animate discussioni tra Golgi e Ramón y Cajal (che ricevettero nel 1906 il premio Nobel per la medicina o la fisiologia) sono nate le moderne neuroscienze. Sulla base di osservazioni al microscopio ottico di tessuto nervoso colorato secondo il metodo sviluppato da Golgi nel 1885 (metodo di impregnazione argentica o della reazione nera), Ramón y Cajal dimostrò in modo convincente (tra il 1888 e il 1891) che le cellule del sistema nervoso sono entità individuali discrete (per le quali il fisiologo tedesco Wilhelm Waldeyer coniò nel 1891 il termine neurone), che si organizzano in contiguità, ma non in continuità, con altre cellule nervose, a formare circuiti neurali. I n. comunicano tra loro attraverso contatti specializzati, che nel 1897 il fisiologo inglese Charles S. Sherrington denominò sinapsi (termine dal greco che significa «abbracciare insieme»).
Morfologia neuronale e componenti del neurone
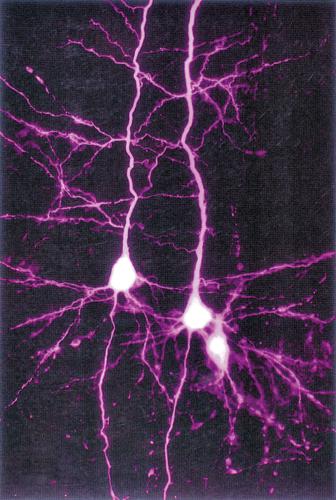
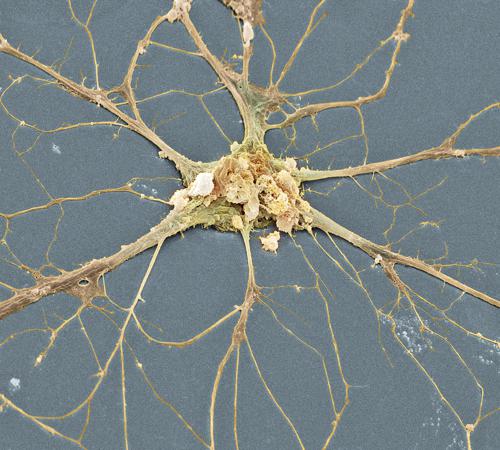
La caratteristica più evidente dei n., rispetto a qualsiasi altra cellula, è la loro morfologia spazialmente complessa, estesa e diversificata. Dal punto di vista citologico, si distinguono un corpo cellulare (o soma), da cui emergono due tipi di prolungamenti chiamati, rispettivamente, dendriti e assoni. Il soma contiene il nucleo, la cosiddetta sostanza di Nissl (costituita da aggregati di ribosomi e di reticolo endoplasmatico rugoso) e apparati di Golgi multipli.
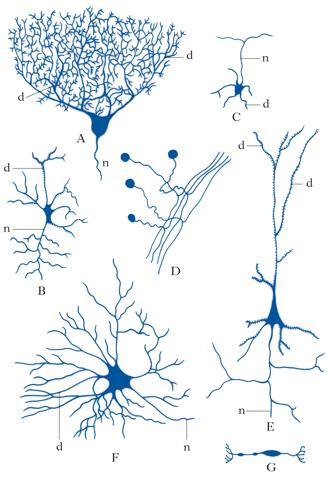
Morfologia. I n. assumono una varietà estremamente grande di forme differenti, sia per ciò che riguarda morfologia, ramificazione ed estensione dell’arborizzazione dendritica, sia per ciò che concerne l’assone. Infatti, alcuni tipi di n., come le cellule amacrine della retina, sono del tutto privi di assone, mentre altri, che costituiscono la numerosissima popolazione di n. a circuito locale, o interneuroni, presenti in tutto l’encefalo, hanno assoni molto corti, a differenza dei n. di proiezione che raggiungono, con i loro lunghi assoni, bersagli cellulari molto distanti. I determinanti molecolari della morfologia neuronale sono costituiti sia da fattori intrinseci (ossia specifici programmi genetici legati alla particolare identità di ciascun tipo neuronale), sia da fattori estrinseci, che agiscono durante la crescita di dendriti e assoni in via di sviluppo. Tra i fattori estrinseci che regolano la crescita e la morfologia dei processi neuronali vi sono fattori non diffusibili (molecole di adesione, molecole della matrice extracellulare) e fattori tropici e trofici diffusibili (attrattivi e repulsivi, tra cui neurotrofine, netrine, semaforine, slits e altri). Nel sistema nervoso adulto, aspetti più fini della morfologia dendritica (per es., densità e morfologia delle spine dendritiche) e sue modificazioni strutturali sono regolati dall’attività sinaptica (➔ plasticità neurale).
Dendriti. Sono prolungamenti relativamente corti (di solito inferiori a 700 μm), contenenti un’impalcatura citoscheletrica di microtubuli e neurofilamenti e numerosi ribosomi. I dendriti presentano una complessa arborizzazione, che costituisce la principale zona di contatto per le terminazioni sinaptiche provenienti da altri neuroni. La morfologia e l’organizzazione spaziale dell’arborizzazione dendritica neuronale determinano le modalità e il numero di contatti sinaptici tra un neurone e le cellule vicine. Il numero delle terminazioni sinaptiche che un n. riceve da n. differenti ne determina il grado di convergenza, mentre il numero dei bersagli cellulari che vengono innervati da un singolo n. determina la sua divergenza. I dendriti presentano in molti casi specializzazioni strutturali chiamate spine dendritiche, strutture dinamiche contenenti microfilamenti di actina, siti privilegiati di comunicazione fra n. che si interfacciano con un terminale nervoso (bottone terminale), ossia l’estremità dell’assone di un altro neurone.
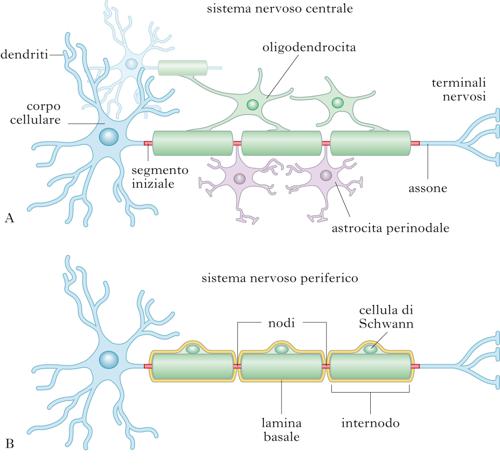
Assone. Dal soma, a livello del cono di emergenza (o monticolo assonale) emerge anche l’assone, un singolo processo nervoso (lungo da qualche millimetro fino a 1 metro nel caso del nervo sciatico), in generale anch’esso ramificato alla sua estremità distale, che contrae contatti sinaptici con altri n. o con i muscoli. L’assone contiene citoplasma, microtubuli, neurofilamenti e vari tipi di vescicole in transito. In molti casi questo segmento è avvolto da una guaina discontinua (guaina mielinica) che lo isola dai tessuti circostanti, determinando un notevole aumento della velocità di conduzione dell’impulso nervoso (conduzione saltatoria).
Sinapsi. I siti privilegiati di comunicazione intercellulare del n. sono chiamati sinapsi, in corrispondenza delle quali segnali elettrici vengono trasmessi da una cellula all’altra (trasmissione sinaptica). In base alla struttura, le sinapsi si dividono in due tipi: elettriche e chimiche. Nelle sinapsi elettriche, comuni negli invertebrati, l’impulso nervoso transita come cariche ioniche da cellula a cellula, attraverso particolari apparati giunzionali chiamati giunzioni serrate (gap junctions), costituite da pori proteici (connessoni) a permeabilità variabile, che connettono il citoplasma di due cellule. Le sinapsi chimiche, le più diffuse tra i vertebrati, operano invece un elaborato processo di trasduzione vettoriale del segnale, attraverso il quale un impulso elettrico viene convertito nel rilascio di un segnale chimico da parte della cellula nervosa che invia il messaggio; la cellula che lo riceve traduce il messaggio chimico in un nuovo impulso elettrico. Le sinapsi chimiche sono formate da due compartimenti, il compartimento presinaptico (o presinapsi) e quello postsinaptico (o postsinapsi), che si giustappongono, separati dalla fessura sinaptica. Nella presinapsi sono presenti organelli secretori specializzati, le vescicole sinaptiche, che contengono il segnale chimico o neurotrasmettitore. Le vescicole sinaptiche si trovano concentrate lungo un’area specializzata della membrana presinaptica, la zona attiva. L’arrivo dell’impulso nervoso al terminale sinaptico provoca l’entrata degli ioni calcio nella presinapsi, avvenimento che a sua volta scatena l’esocitosi del neurotrasmettitore nella fessura sinaptica. I meccanismi molecolari presinaptici di rilascio del neurotrasmettitore sono oggi ben compresi, in seguito alla identificazione e caratterizzazione sistematica delle proteine che regolano il traffico delle vescicole sinaptiche (➔ sinapsi). Il neurotrasmettitore rilasciato nella fessura sinaptica diffonde verso la membrana postsinaptica, dove si lega a specifici recettori, che possono essere proteine-canale (recettori ionotropici) o recettori metabotropici. Le proteine-canale trasducono direttamente il segnale chimico del neurotrasmettitore in una variazione del potenziale di membrana (potenziale postsinaptico eccitatorio o inibitorio), mentre i secondi attivano processi di segnalazione intracellulare, che a loro volta regolano canali ionici postsinaptici. La trasmissione sinaptica può esibire molte forme di plasticità, su uno spettro di scale temporali molto vasto (da secondi e minuti, a giorni e mesi). Le forme di plasticità sinaptica a più breve termine sono transitorie e coinvolgono in generale variazioni della quantità di neurotrasmettitori rilasciati dalle terminazioni presinaptiche. Forme più durature di plasticità sinaptica possono coinvolgere invece, in misura variabile, meccanismi sia presinaptici sia postsinaptici.
Modalità della trasmissione sinaptica. In generale, le informazioni (i segnali) trasmesse dalle varie terminazioni sinaptiche che raggiungono i dendriti di un n. sono integrate e lette a livello del cono d’emergenza dell’assone, la zona più eccitabile di un n., dove si generano i potenziali d’azione. Inoltre, la maggior parte dei n. riceve stimoli da sinapsi sia eccitatorie sia inibitorie, ciascuna delle quali è diversamente distribuita lungo l’arborizzazione dendritica. La morfologia dell’arborizzazione dendritica, e la precisa localizzazione delle sinapsi afferenti sull’albero dendritico, hanno quindi profonde implicazioni funzionali sull’elaborazione dei segnali elettrici da parte del n. e l’innesco o meno di un potenziale d’azione a livello assonale. Infatti, tutti i potenziali postsinaptici (eccitatori EPSP, o inibitori IPSP) generati sull’arborizzazione dendritica di un n. dalle migliaia di sinapsi che su di esso convergono si sommano (sommazione sinaptica), nel tempo e nello spazio, in base alle proprietà elettriche dei dendriti che, di regola, sono dominate dalle proprietà elettriche passive (cosiddette proprietà di cavo). La sommazione sinaptica dipende pertanto dalla geometria dei dendriti e delle loro arborizzazioni e ramificazioni, ed è la risultante di tutte le correnti postsinaptiche eccitatorie e inibitorie; l’esito di questa competizione elettrica determina se il n. stesso innescherà o meno uno o più potenziali d’azione. La frequenza dei potenziali d’azione è direttamente collegata alla intensita della stimolazione ricevuta, quindi all’esito della sommazione sinaptica.
Controllo dell’espressione genica e della composizione proteica nei neuroni
L’estesa e complessa morfologia dei n. pone il problema di come le terminazioni sinaptiche vengano rifornite efficientemente delle proteine necessarie per le loro funzioni, in relazione all’attività elettrica. Fin dai tempi di Ramón y Cajal, il corpo cellulare neuronale è stato considerato il centro trofico e sintetico del n., dove avviene la biosintesi delle proteine (trascrizione dai geni in mRNA e traduzione degli mRNA in proteine) necessarie per tutte le funzioni neuronali, anche quelle localizzate nelle sue parti più periferiche, come le sinapsi. Un sistema di trasporto intracellulare ha quindi la funzione di rifornire le parti più distanti del n., come le sinapsi, delle proteine necessarie per la loro attività. Esiste, infatti, nei n. un complesso sistema di trasporto intracellulare, descritto dapprima per gli assoni, ma successivamente riscontrato anche nei dendriti. Il trasporto assonale è costituito da una componente lenta (velocità di trasporto dell’ordine di 1÷2 mm/giorno) e una componente rapida (velocità di trasporto attorno a 400 mm/giorno), e ha al centro il ruolo dei microtubuli e dei motori molecolari ATP-dipendenti a essi associati, quali chinesine e dineine. I microtubuli neuronali costituiscono veri e propri binari lungo i quali scorrono, in direzione anterograda e retrograda, vescicole e organelli (mitocondri e altri). Anche se caratterizzato da tempi lenti, il sistema di trasporto assonale appariva quindi in grado di risolvere il problema concettuale posto dalla necessità del n. di controllare e regolare la composizione proteica e la funzione delle sue parti più distanti. Fino agli anni Novanta del 20° secolo, si riteneva quindi che il n. avesse un controllo molto centralizzato della espressione genica e della composizione proteica delle sue varie parti più periferiche, con una sintesi (trascrizione e traduzione) a livello del soma e con un sistema di trasporto e di smistamento differenziale e selettivo delle proteine, laddove fossero necessarie. Nel corso degli anni è emerso, tuttavia, che un meccanismo così centralizzato di controllo dell’espressione genica neuronale non è in grado di fornire adeguate risposte ad alcuni aspetti importanti della funzione neuronale in relazione alla attività elettrica, che aprono un problema neurobiologico rilevante. In partic., gli studi sulla plasticità sinaptica hanno mostrato che la transizione di un fenomeno di plasticità (e quindi di un apprendimento motorio, comportamentale, o di una memoria) da breve termine al suo consolidamento a lungo termine coinvolge cambiamenti di espressione genica che rendono duraturi e persistenti i cambiamenti molecolari innescati dall’attività sinaptica. Infatti, i cambiamenti sinaptici a breve termine sono mediati da modificazioni postraduzionali di proteine sinaptiche già presenti nelle sinapsi stesse. La durata dei cambiamenti sinaptici a breve termine è, in effetti, limitata dalla vita media delle proteine così modificate, che costituiscono gli effettori della plasticità sinaptica. La transizione dei cambiamenti sinaptici da breve a lungo termine, e il loro consolidamento duraturo nel tempo, richiedono in modo essenziale l’attivazione di un nuovo programma di espressione genica, che sintetizza nuovi effettori proteici duraturi di quei cambiamenti plastici. È questo un esempio significativo di ‘dialogo’ tra sinapsi e geni. D’altra parte, queste proteine, trascritte e tradotte in seguito alla maggiore attività di alcune sinapsi del n., devono agire soltanto su quelle sinapsi, e non sulle altre di quello stesso neurone.
Specificità sinaptica. Dato che un n. può rafforzare o indebolire selettivamente sottoinsiemi variabili delle centinaia o migliaia di sinapsi che esso contrae, si pone quindi il problema della specificità sinaptica: se la modulazione e il controllo dell’espressione genica sono esclusivamente centralizzati a livello del corpo cellulare della cellula nervosa, e riguardano quindi l’intera cellula nervosa (e tutte le migliaia di sue sinapsi), come è possibile che singole sinapsi o gruppi di sinapsi di una stessa cellula nervosa possano essere modificati indipendentemente, in modo duraturo? È chiaro che meccanismi di smistamento e trasporto selettivo di proteine dal soma verso le sinapsi attivate non possono fornire una spiegazione adeguata, spostando il problema a livello del consolidamento di questi meccanismi selettivi. La risposta che emerge dagli studi intrapresi dall’inizio del 21° sec. risiede invece nella capacità, da parte della cellula nervosa, di delocalizzare parte dei meccanismi di espressione genica, dal corpo cellulare alle terminazioni sinaptiche stesse. È stato infatti dimostrato che il n. può regolare selettivamente la composizione proteica di singole sinapsi, in funzione della loro attività, mediante una complessa serie di meccanismi biochimici, spazialmente localizzati a singole sinapsi e temporalmente collegati alla attività sinaptica locale. Tali meccanismi comprendono un fitto scambio di segnali biochimici, retrogradi e anterogradi, tra le sinapsi e il nucleo, il trasporto selettivo di RNA messaggeri, traduzionalmente repressi, alle terminazioni sinaptiche, e il controllo locale della sintesi proteica, in funzione della attività sinaptica. Il meccanismo di controllo traduzionale locale, regolato dall’attività sinaptica, è ormai ben dimostrato per i dendriti, a livello postsinaptico. La sintesi proteica locale presinaptica, a livello delle terminazioni assonali presinaptiche, è ben dimostrata per i n. di invertebrati, e per i n. di vertebrati durante lo sviluppo, a livello del cono di crescita dell’assone. La generalità della sintesi proteica locale negli assoni di mammiferi adulti è invece tuttora (2010) da verificare, pur a fronte di alcuni esempi significativi. In ogni caso, la capacità del n. di controllare localmente la composizione proteica delle sue sinapsi e quindi la loro efficacia, in relazione all’attività sinaptica, coinvolge molteplici livelli di regolazione e controllo, che includono, oltre al controllo traduzionale locale, anche la degradazione locale di mRNA e proteine localizzate alle sinapsi. Una classe emergente di molecole coinvolte nel regolare la traducibilità e la degradazione di mRNA localizzati nei dendriti è costituita dai microRNA (➔ microRNA e cervello). Antonino Cattaneo
Neuroni specchio
I meccanismi nervosi alla base della facoltà di comprendere il comportamento altrui fino a non molti anni fa erano poco conosciuti. La scoperta dei neuroni specchio nella scimmia, è la successiva dimostrazione dell’esistenza di meccanismi di rispecchiamento nel cervello umano, hanno evidenziato per la prima volta un meccanismo neurofisiologico capace di spiegare molti aspetti delle nostre capacità di relazionarci con gli altri.
Quando entrano in azione i neuroni specchio
I neuroni specchio sono stati scoperti nella corteccia premotoria (➔ corteccia motoria) del cervello del macaco (area F5). I neuroni specchio si attivano sia quando la scimmia esegue un atto motorio finalizzato, come afferrare oggetti con la mano o con la bocca, sia quando osserva un altro individuo eseguire atti motori analoghi. I neuroni specchio esemplificano un meccanismo neuronale che mette in relazione le azioni eseguite da altri con il repertorio motorio dell’osservatore. L’osservazione di un’azione induce nell’osservatore l’automatica simulazione di quell’azione. Questo meccanismo consente una forma implicita e diretta di comprensione delle azioni altrui. I neuroni specchio sono in grado di mediare la comprensione dello scopo di un’azione anche quando essa non è completamente visibile e, quindi, il suo scopo finale può solo essere immaginato, o quando l’unico elemento disponibile alla scimmia è il suono prodotto dall’azione. Dopo quelli della corteccia premotoria sono stati scoperti neuroni specchio anche nella regione del lobo parietale inferiore, reciprocamente connessa con l’area premotoria F5. Nella vita quotidiana dei primati, atti motori come afferrare un oggetto sono quasi sempre parte di azioni, ossia sequenze motorie complesse dotate di uno scopo finale. Spesso lo stesso atto motorio può appartenere ad azioni differenti: per es., si può afferrare del cibo per mangiarlo o per gettarlo via. È stata descritta una classe di neuroni specchio, presenti sia nella corteccia premotoria sia in quella parietale posteriore, che si attivano selettivamente durante l’esecuzione e l’osservazione di uno stesso atto motorio, come afferrare un oggetto, solo ed esclusivamente in relazione al tipo di atto motorio che segue, come portare l’oggetto alla bocca o porlo in un contenitore. Ciò significa che la risposta del neurone specchio predice ciò che sarà fatto successivamente dall’agente, suggerendo che tali neuroni giochino un ruolo importante non solo nella comprensione degli atti motori, ma anche nel riconoscimento dell’intenzione motoria dell’agente.
Neuroni specchio nell’uomo
Numerosi studi, condotti utilizzando diverse metodiche sperimentali, hanno dimostrato che anche il cervello umano è dotato di un meccanismo di rispecchiamento che mappa le azioni osservate sugli stessi circuiti nervosi che ne controllano l’esecuzione. La localizzazione anatomica del meccanismo neurale di rispecchiamento delle azioni nell’uomo è stata ottenuta con la tecnica della risonanza magnetica funzionale (fMRI). Studi iniziali hanno mostrato che durante l’osservazione di atti motori di prensione con la mano si ha un’attivazione delle aree premotorie 44 e 45 di Brodmann, del lobo parietale inferiore e della regione del solco temporale superiore. Questo circuito corticale corrisponde approssimativamente a quello dei neuroni specchio nella scimmia. Il meccanismo di rispecchiamento appare implicato nell’esecuzione e nell’osservazione di atti motori finalizzati al conseguimento di uno scopo, come mordere una mela, afferrare una tazza o calciare un pallone, di movimenti corporei come danzare, di atti comunicativi, e nell’imitazione degli stessi comportamenti o nell’apprendimento imitativo di nuove sequenze motorie. Ogni volta che osserviamo le azioni altrui il nostro sistema motorio ‘risuona’ assieme a quello dell’agente osservato. Vari studi sembrano suggerire che nell’uomo il meccanismo di rispecchiamento motorio possa essere alla base anche della comprensione delle intenzioni motorie delle azioni altrui. Le aree premotorie del cervello umano dotate di proprietà caratteristiche dei neuroni specchio – aree cioè che si attivano sia durante l’esecuzione sia durante l’osservazione di un atto motorio – sono coinvolte anche nella comprensione del ‘perché’ dell’azione, verosimilmente utilizzando un meccanismo neurofisiologico non dissimile da quello scoperto nei neuroni specchio parietali e premotori della scimmia.
Neuroni specchio ed emozioni
Le ricerche condotte nell’ultimo decennio hanno inoltre dimostrato che il meccanismo di rispecchiamento non è confinato al dominio delle azioni, ma attiene anche al dominio delle emozioni e delle sensazioni. Regioni cerebrali come l’insula, l’amigdala e la corteccia cingolata anteriore sono similmente attivate sia durante l’esperienza, in prima persona, di emozioni come la paura o il disgusto, o di sensazioni come il dolore, sia nella osservazione di tali emozioni negli altri. Secondo la stessa logica, le aree corticali attivate dall’esperienza, in prima persona, del tatto si attivano anche quando assistiamo alle esperienze tattili altrui.
Meccanismi di simulazione ed empatia
I dati neuroscientifici qui riassunti suggeriscono che la nostra capacità di comprendere le azioni altrui, le intenzioni motorie che le hanno generate, le emozioni e le sensazioni provate dai nostri simili non si basa esclusivamente su strategie cognitive che prevedono l’applicazione di sofisticati processi logicodeduttivi, ma anche su meccanismi di simulazione di cui i diversi meccanismi di rispecchiamento costituiscono le basi neurali. Secondo queste evidenze, la nostra capacità di empatizzare (➔ empatia) con gli altri, ossia di entrare nel mondo delle esperienze altrui, attribuendo un senso condiviso a queste stesse esperienze, è il risultato dell’attivazione di meccanismi nervosi di rispecchiamento. È solo grazie a questi meccanismi condivisi che ci è permesso di fare nostre le esperienze altrui, e quindi di comprenderle ‘dall’interno’.
Proteine proneurali e differenziamento neuronale
Il corretto sviluppo del cervello si basa sulla produzione di un vasto numero di neuroni e di cellule gliali (astrociti e oligodendrociti) in un ordine temporale e spaziale ben definito. Nello sviluppo embrionale, il primordio cerebrale è costituito da cellule neuroepiteliali che proliferano molto velocemente, assicurando la generazione di un grande numero di cellule specializzate, necessario per costituire le diverse strutture del cervello. Poco dopo questa prima fase di espansione, e in parte sovrapponendosi a essa, le cellule neuroepiteliali vanno incontro a un processo di differenziamento neuronale (➔), chiamato neurogenesi, che porta alla nascita dei neuroni del cervello.
Proteine bHLH
Il processo di differenziamento è guidato dall’attivazione delle proteine proneurali bHLH, caratterizzate dalla presenza di un dominio ‘elica-giro-elica’ basico (basic Helix-Loop-Helix). Queste proteine funzionano come fattori trascrizionali, ossia sono capaci di legare il DNA tramite un dominio specializzato a struttura bHLH, e in questo modo sono in grado di dare inizio all’attività di un grande numero di geni che, nell’insieme, portano le cellule a differenziarsi in neuroni. Le proteine proneurali nell’uomo sono all’incirca una ventina, suddivise in sei famiglie, chiamate Mash, Neurogenine, Math, Olig, NeuroD ed E12, e insieme cooperano per indurre la formazione delle diverse classi di neuroni del cervello. Queste proteine sono altamente conservate nell’evoluzione animale, a tal punto che negli insetti si ritrovano proteine con la stessa struttura, in grado di svolgere una simile funzione proneurale.
Inibizione laterale
Numerosi studi hanno permesso di apprezzare il ruolo essenziale di queste proteine nel promuovere il differenziamento neuronale. Curiosamente, però, le cellule contigue a quelle indotte a differenziare mantengono la capacità di proliferare, evitando di attivare le stesse proteine proneurali. Questo processo, che funziona durante lo sviluppo del cervello in qualsiasi classe animale – dagli insetti all’uomo –, è chiamato inibizione laterale. Un tale sistema di inibizione permette di coordinare il differenziamento neuronale mantenendo la proliferazione delle cellule necessaria per l’espansione della struttura cerebrale, e si basa sull’interazione tra cellule diverse ma contigue che esprimono i recettori di superficie Notch e Delta. La proteina Delta viene esposta sulla superficie della cellula neuroepiteliale che attiva i geni proneurali bHLH, e quindi è destinata a differenziare in neurone. Delta è in grado di legare una seconda proteina chiamata Notch esposta dalle cellule vicine. Questo legame attiva la proteina Notch, che agisce nelle cellule che la esprimono reprimendo l’attivazione delle proteine proneurali e, contemporaneamente, promuovendo i meccanismi di proliferazione cellulare. Come conseguenza di questa elegante interazione tra cellule contigue, mediata dall’interazione delle due proteine di superficie Notch e Delta, mentre una cellula differenzia in neurone la cellula vicina è inibita a iniziare lo stesso processo e viene mantenuta in uno stadio di proliferazione cellulare. Una volta formatosi, il neurone si stacca dallo strato di cellule progenitrici e migra all’interno della struttura definitiva del cervello. Il processo continua nelle cellule neuroepiteliali rimaste, per generare la moltitudine di neuroni necessari a tutte le strutture cerebrali.
Gliogenesi
Le proteine proneurali hanno anche la capacità di inibire il differenziamento delle cellule neuroepiteliali proliferanti verso cellule gliali. In questo modo, nella prima fase di sviluppo del cervello, in cui esiste una forte attività delle proteine proneurali, le cellule differenziano solo in neuroni. Solamente nelle ultime fasi embrionali le cellule neuroepiteliali iniziano a generare cellule gliali (astrociti e oligodendrociti) mentre perdono la capacità di generare neuroni, in un processo chiamato gliogenesi. Questo cambiamento è dovuto a una serie di segnali molecolari ancora non del tutto caratterizzati. Il più interessante è quello che viene generato dagli stessi neuroni nati nella prima fase dello sviluppo. Questi neuroni esprimono una proteina chiamata Sip1 che attiva a sua volta almeno due fattori, FGF9 e NTF3, che vengono rilasciati dagli stessi neuroni una volta che abbiano raggiunto un numero sufficiente per costituire le diverse strutture definitive del cervello. I due fattori inducono le cellule neuroepiteliali vicine a modificare il loro comportamento inibendo la produzione di altri neuroni per iniziare invece la produzione delle cellule gliali.
Specializzazioni delle proteine proneurali
Il cervello contiene alcune decine di classi di neuroni diversi e le proteine proneurali devono essere in grado di generare tutte queste diverse tipologie di comportamento durante la neurogenesi. Per raggiungere questo fine, le proteine proneurali si sono specializzate nel produrre ciascuna una particolare classe di neuroni, almeno in alcune regioni del cervello. Per es., la proteina proneurale Mash1 stimola la generazione di neuroni GABAergici, mentre le proteine Neurogenina 1 e 2 inducono la produzione di neuroni glutammatergici dalle cellule indifferenziate neuroepiteliali. Ciò però non è sufficiente a generare la diversità neuronale richiesta nel cervello. Per fare ciò le proteine proneurali possono associarsi ad altri fattori trascrizionali, in partic. le proteine con omeodominio (sequenza della proteina stessa che ne regola il legame con i geni bersaglio), per attivare meccanismi specifici di differenziamento neuronale. Questo è evidente nel caso della proteina proneurale Neurogenina 2 che è in grado di generare neuroni glutammatergici nella corteccia cerebrale, ma che associata con altri fattori, tra cui le proteine con omeodomio Pitx3 e Otx2, induce la formazione di neuroni dopamminergici nel mesencefalo.