NEUROIMAGING
NEUROIMAGING.
– Tomografia computerizzata. Risonanza magnetica. Diffusion tensor imaging. Diffusion-weighted imaging. Fluid attenuated inversion recovery. RM strutturale. Tomografia a emissione di positroni. Bibliografia
In neurologia, con l’espressione neuroimaging o neuroimmagine si intende l’insieme di quelle tecniche di diagnostica per immagini che, applicate all’esame del cervello, ne permettono la visualizzazione in tempo reale della struttura, del funzionamento e anche delle relative misure biochimiche e molecolari. Tra le metodiche di immagine anatomica si annoverano la tomografia computerizzata (TC) e la risonanza magnetica (RM), mentre le metodiche di immagine funzionali e molecolari sono la tomografia a emissione di fotoni singoli (SPECT, Single Photon Emission Computed Tomography) e di positroni (PET, Positron Emission Tomography). Negli ultimi decenni la diffusione e l’evoluzione di queste tecniche hanno rivoluzionato la pratica clinico-diagnostica in generale, rendendola più efficace, con risultati di particolare rilievo nel neuroimaging.
Tomografia computerizzata. – Applicata alla neuroimmagine, per anni la TC è stata il metodo d’elezione per la patologia cerebrovascolare e neuroncologica. Tuttavia, con l’avvento della RM, la sua applicazione è diventata più limitata. Per es., numerosi studi hanno dimostrato che la RM ha una sensibilità diagnostica maggiore (83% rispetto al 26% della TC), dovuta alla sua maggiore capacità di individuare lesioni cerebrovascolari, in particolare di tipo ischemico (tra gli altri, Chalela, Kidwell, Nentwich et al. 2007). In definitiva, l’utilizzo della TC rimane particolarmente indicato per valutazioni in caso di traumi cranici con danneggiamento osseo e in tutti i casi in cui non sia possibile l’esecuzione di RM (presenza di metallo, claustrofobia).
Risonanza magnetica. – Questa tecnica, che si basa sul fenomeno della risonanza magnetica nucleare, è entrata in uso negli anni Ottanta del 20° sec. e ha permesso di ottenere immagini anatomiche molto dettagliate del cervello e della spina dorsale. Alle procedure di routine, come l’utilizzo di contrasti definiti T1 e T2 per visualizzare rispettivamente l’anatomia cerebrale e il liquor o edema, negli ultimi anni sono state affiancate nuove tecniche di RM per l’acquisizione ed elaborazione delle immagini, rivelatesi importanti nella valutazione di molte patologie neurologiche: diffusion tensor imaging (DTI), diffusion-weighted imaging (DWI), fluid attenuated inversion recovery (FLAIR), RM strutturale.
Diffusion tensor imaging. – Questa indagine anatomica permette di studiare la sostanza bianca, ossia i fasci di connessione tra le varie strutture cerebrali, in particolare usando una misura dell’anisotropia frazionaria e la tratto-grafia, e quindi di esaminare aree di degenerazione degli assoni e demielinizzazione in malattie come le demenze su base degenerativa o la sclerosi multipla (Pievani, Filippini, van den Heuvel et al. 2014).
Diffusion-weighted imaging. – Questa tecnica permette misure di diffusione delle molecole d’acqua. In caso d’ischemia cerebrale, le immagini DWI sono molto sensibili ai cambiamenti patologici che avvengono nella lesione.
L’aumento del segnale DWI appare entro 5-10 minuti dall’insorgenza dei sintomi dell’attacco ischemico, da qui l’importanza di questa valutazione diagnostica rispetto alla TC, che normalmente identifica i cambiamenti nel tessuto cerebrale nell’ordine delle 24 ore.
Fluid attenuated inversion recovery. – Questa tecnica permette di visualizzare l’encefalo in T2 annullando il segnale del liquido cefalorachidiano. Le immagini risultanti dall’impiego di questa sequenza sono caratterizzate da un basso rapporto segnale/rumore. La FLAIR è molto utile nella diagnosi della sclerosi multipla cerebrale poiché le eventuali placche di sclerosi risultano fortemente iperintense; inoltre, con questa tecnica, lesioni in particolari sedi (per es., le zone periventricolari) sono più evidenti.
RM strutturale. – Tale tecnica ha un ruolo fondamentale nella pratica clinica di routine, anche grazie alla sua capacità di individuare atrofia (perdita) del tessuto cerebrale specifica per le diverse malattie neurodegenerative.
Per es., nel caso della malattia di Alzheimer (MA), la RM può evidenziare atrofia del lobo temporale mediale (struttura dell’ippocampo), considerata come supporto nei criteri diagnostici di tale patologia (McKhann, Knopman, Chertkow et al. 2011). Similmente, nello spettro della degenerazione frontotemporale (DFT), l’atrofia dei lobi frontali e/o temporali è considerata di supporto alla diagnosi nelle diverse forme (Rascovsky, Hodges, Knopman et al. 2011), in particolare nelle afasie primarie progressive (APP), dove la RM può evidenziare perdite di tessuto cerebrale specifiche e utili per una più corretta diagnosi clinica (Gorno-Tempini, Hillis, Weintraub et al. 2011). La RM è considerata fondamentale per l’interpretazione e per la caratterizzazione delle lesioni e dei fenotipi clinici nell’ambito dei disturbi vascolari (Moorhouse, Rockwood 2008). Inoltre, fondamentale è il suo ruolo nella sclerosi multipla, dove viene utilizzata per confermare la presenza di lesioni tipiche della sostanza bianca e anche della sostanza grigia, condizioni che oggi supportano la corretta diagnosi e caratterizzazione clinica (Polman, Reingold, Banwell et al. 2011). Un particolare ruolo della RM è sicuramente nell’ambito della patologia tumorale cerebrale, dove l’inserimento di questa tecnica nella pratica clinica ha rivoluzionato l’approccio diagnostico per la caratterizzazione del tumore (localizzazione, estensione, gravità). Nonostante questo, molto spesso le tectecniche convenzionali di RM non permettono la differenziazione tra diverse tipologie di tumori (Waldman, Jackson, Price et al. 2009). Per questo motivo, oltre alle T1 e T2 di routine, nuove sequenze come la FLAIR o indici come il coefficiente apparente di diffusione (ADC, Apparent Diffusion Coefficient) in DWI, sono stati sviluppati per ottenere una sempre maggiore potenza diagnostica (Waldman, Jackson, Price et al. 2009).
Tomografia a emissione di positroni. – Nel 2015, l’esame PET più diffuso in campo diagnostico neurologico è quello che utilizza come tracciante il radioisotopo [18F]-FDG (FluoroDesossiGlucosio), per studiare l’integrità dei neuroni attraverso il loro consumo metabolico di glucosio.
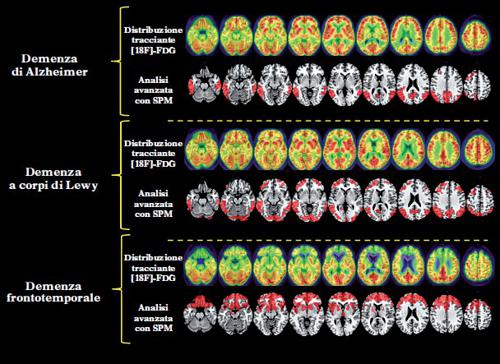
Similmente a quanto detto per la risonanza magnetica strutturale, la localizzazione e la tipologia delle alterazioni del metabolismo glucidico cerebrale (sotto forma di ipometabolismo) sono in grado di identificare malattie specifiche, contribuendo nettamente a una corretta diagnosi clinica. Nel caso della MA un ipometabolismo a livello dei lobi temporali e parietali è considerato di supporto per la diagnosi (McKhann, Knopman, Chertkow et al. 2011). Un’alterazione prominente a livello dei lobi frontali è invece suggestiva di neurodegenerazioni nello spettro delle DFT (Gorno-Tempini, Hillis, Weintraub et al. 2011; Rascovsky, Hodges, Knopman et al. 2011). Un caso particolare è quello della demenza a corpi di Lewy (DCL), dove sono considerati diagnostici sia l’ipometabolismo a livello dei lobi occipitali sia un’alterazione del sistema dopaminergico (misurata con la SPECT o con la PET con radiotraccianti adeguati; McKeith, Dickson, Lowe et al. 2005).
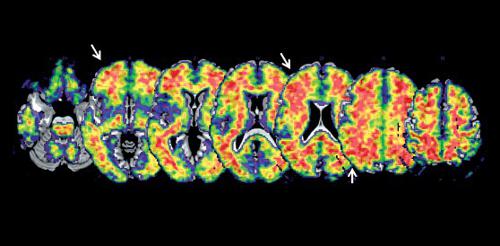
Di recente avvento sono le metodiche PET basate su radiotraccianti per la visualizzazione di placche di proteina amiloide nel cervello (PET amiloide). Nella MA l’amiloide si accumula nel cervello in modo patologico. In questa condizione, la PET amiloide esprime tutto il suo potenziale, con un’altissima sensibilità per il rilevamento degli accumuli patologici della proteina nella sostanza grigia. Una positività a questo test è considerata di supporto alla diagnosi, sia precoce sia differenziale, di MA (Dubois, Feldman, Jacova et al. 2014; fig. 1). Sviluppi recenti riguardano anche nuovi traccianti per lo studio della neuroinfiammazione cerebrale, un processo caratteristico di diverse condizioni neurodegenerative come la sclerosi multipla, dove la PET sta trovando sviluppi interessanti e importanti in ambito diagnostico, essendo in grado di rilevare la risposta infiammatoria e le sue relazioni con la disabilità (Politis, Giannetti, Su et al. 2012). Un punto importante nella moderna diagnostica per immagini riguarda la quantificazione delle misure PET, fondamentale per aumentare l’accuratezza della diagnosi (Perani, Della Rosa, Cerami et al. 2014). Queste procedure sono ormai diffuse per l’alto potenziale diagnostico in termini sia di sensibilità sia di specificità, rispetto alla valutazione visiva/qualitativa delle immagini PET. In questo modo è possibile fare confronti statistici tra il paziente e soggetti sani, ottenendo mappe di metabolismo cerebrale che possono evidenziare aree nelle quali questo è ridotto (fig. 2).
Bibliografia: I.G. McKeith, D.W. Dickson, J. Lowe et al., Diagnosis and management of dementia with Lewy bodies: third report of the DLB Consortium, «Neurology», 2005, 65, 12, pp. 1863-72; J.A. Chalela, C.S. Kidwell, L.M. Nent wich et al., Magnetic resonance imaging and computed tomography in emergency assessment of patients with suspected acute stroke: a prospective comparison, «The lancet», 2007, 369, 9558, pp. 293-98; P. Moorhouse, K. Rockwood, Vascular cognitive impairment: current concepts and clinical developments, «The lancet. Neurology», 2008, 7, 3, pp. 246-55; A.D. Waldman, A. Jackson, S.J. Price et al., Quantitative imaging biomarkers in neuro-oncology, «Nature reviews. Clinical oncology», 2009, 6, 8, pp. 445-54; M.L. Gorno-Tempini, A.E. Hillis, S. Weintraub et al., Classification of primary progressive aphasia and its variants, «Neurology», 2011, 76, 11, pp. 1006-14; G.M. McKhann, D.S. Knopman, H. Chertkow et al., The diagnosis of dementia due to Alzheimer’s disease: recommendations from the National Institute on aging-Alzheimer’s association workgroups on diagnostic guidelines for Alzheimer’s disease, «Alzheimer’s & dementia», 2011, 7, 3, pp. 263-69; C.H. Polman, S.C. Reingold, B. Banwell et al., Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald criteria, «Annals of neurology», 2011, 69, 2, pp. 292-302; K. Rascovsky, J.R. Hodges, D. Knopman et al., Sensitivity of revised diagnostic criteria for the behavioural variant of frontotemporal dementia, «Brain», 2011, 134, 9, pp. 2456-77; M. Politis, P. Giannetti, P. Su et al., Increased PK11195 PET binding in the cortex of patients with MS correlates with disability, «Neurology», 2012, 79, 6, pp. 523-30; B. Dubois, H.H. Feldman, C. Jacova et al., Advancing research diagnostic criteria for Alzheimer’s disease: the IWG-2 criteria, «The lancet. Neurology», 2014, 13, 6, pp. 614-29; D. Perani, P.A. Della Rosa, C. Cerami et al., Validation of an optimized SPM procedure for FDG-PET in dementia diagnosis in a clinical setting, «Neuroimage: clinical», 2014, 6, pp. 445-54; M. Pievani, N. Filippini, M.P. van den Heuvel et al., Brain connectivity in neurodegenerative diseases: from phenotype to proteinopathy, «Nature reviews. Neurology», 2014, 10, 11, pp. 620-33.