Nerve growth factor
Nerve growth factor
*La voce enciclopedica Nerve Growth Factor è stata ripubblicata da Treccani libri, arricchita e aggiornata da un contributo di Elena Cattaneo.
Non è azzardato affermare che la scoperta del Nerve growth factor (NGF), presto seguita dall'identificazione dell'Epidermal growth factor (EGF), costituisce un avanzamento delle nostre conoscenze nel campo biologico paragonabile a quello che si è verificato con l'identificazione del primo ormone o del primo neurotrasmettitore. Il ruolo biologico di molti fattori di crescita, inoltre, è fortemente interconnesso con l'insorgenza di vari tipi di tumori; una mutazione nel gene che codifica la sintesi del fattore di crescita o del recettore corrispettivo può indurre una proliferazione incontrollata della cellula bersaglio con conseguente trasformazione da normale a neoplastica. La scoperta del NGF ha suggerito l'ipotesi, in seguito confermata, che esistano proteine analoghe al NGF ma dotate di azione su altre popolazioni nervose che sono collettivamente denominate 'neurotrofine'. La funzione del NGF e di altre neurotrofine consiste principalmente nel promuovere il differenziamento delle cellule bersaglio e nel garantirne la sopravvivenza una volta che abbiano raggiunto la piena maturazione strutturale e funzionale. Nell'ultimo decennio del Novecento è emerso in modo inequivocabile che quest'azione trofica o vitale non sempre si esplica in modo, per così dire, 'attivo' ma, al contrario, consiste in un'azione inibitoria, nel tenere cioè sotto controllo un programma di morte che è presente nel DNA di ogni cellula e denominato 'apoptosi'. Nel sistema nervoso il programma di morte per apoptosi svolge un ruolo fondamentale sia nello sviluppo sia nell'adulto. Nei primi anni di vita postnatale il cervello è costituito da un numero circa doppio di neuroni rispetto a quelli presenti al termine dell'adolescenza: quelli che falliscono nella costituzione delle reti nervose debbono essere eliminati tramite l'apoptosi per evitare l'eccedenza numerica. Tra i fattori modulatori della fomazione dei circuiti vi è anche il NGF e vi sono evidenze sperimentali che numerose malattie degenerative, fra le quali si annoverano anche le demenze senili, siano provocate dalla carenza, per motivi vari, di una o più neurotrofine come il NGF.
Le indagini condotte nell'ultimo decennio hanno messo sempre più in evidenza il ruolo 'organismico' del NGF, con la dimostrazione di un suo coinvolgimento non solo nel sistema nervoso centrale e periferico ma anche nel sistema endocrino e in quello che presiede alla difesa dell'organismo. Queste scoperte, a loro volta, si inseriscono nella necessità di valutare le singole azioni del NGF in un contesto che analizza e valuta una determinata risposta tramite un approccio globale, olistico. Non a caso è nata e si va sempre più affermando una nuova disciplina denominata con la locuzione anglosassone system biology. Disciplina che non sarebbe potuta nascere un decennio fa poiché richiede un duplice intervento ‒ multi- e interdisciplinare ‒ i cui risultati possono solo oggi essere valutati grazie all'impiego di tecnologie sofisticate e all'analisi dei dati raccolti tramite potenti elaboratori elettronici.
L'ipotesi del fattore umorale
Negli anni Quaranta del secolo scorso, un problema a lungo dibattuto fra gli embriologi dell'epoca era centrato sul ruolo del territorio periferico e sull'entità dell'innervazione dello stesso territorio. Poiché si osservava una stretta relazione fra questi due parametri ‒ quanto maggiore era il territorio tanto superiore era l'innervazione, quanto minore il territorio altrettanto ridotta l'innervazione ‒ due erano le ipotesi funzionali al riguardo. Una, sostenuta fra gli altri da un allievo di Hans Speeman, Victor Hamburger, attribuiva al territorio stesso da innervare un ruolo 'attivo'. Secondo questa ipotesi le fibre nervose in crescita ed espansione 'sentivano' la dimensione e si comportavano di conseguenza. A dimostrazione di questa conclusione si adduceva un esperimento effettuato da Helmer D. Bueker nel quale anche un territorio 'amorfo', come quello costituito da un tumore, induceva un'abnorme crescita di fibre nervose.
Secondo un'altra ipotesi sostenuta da Rita Levi-Montalcini, nel frattempo invitata da Hamburger alla Washington University di Saint Louis a studiare questo problema, il territorio periferico o il tumore impiantato nell'embrione rilasciava un fattore diffusibile che induceva la crescita delle fibre nervose. La ripetizione degli esperimenti di Bueker rivelò un fatto nuovo e stupefacente: gangli simpatici, a notevole distanza dal tumore e nell'impossibilità di stabilire un contatto con il tessuto neoplastico, andavano incontro a uno straordinario aumento di volume, simile a quello dei gangli che innervavano il tumore stesso. Le fibre soprannumerarie prodotte dai gangli simpatici invadevano in modo caotico e anomalo gli organi che, in condizioni normali, a questo stadio dello sviluppo embrionale non erano ancora innervati e non stabilivano rapporti sinaptici con le cellule degli organi, infrangendo il principio basilare che stabilisce di norma un contatto diretto tra fibre nervose e cellule innervate. L'atipicità dell'effetto provocato dall'innesto del tumore denominato Sarcoma 37 (S37) era messa in evidenza dal fatto che le fibre simpatiche non solo invadevano i visceri, ma perforavano la tunica dei vasi sanguigni penetrando all'interno di piccole e grandi vene. Superata la parete vascolare essi protrudevano come grossi gomitoli fibrosi (definiti, in termini neuropatologici, 'neuromi') che fluttuavano all'interno dei vasi (figg. 2 e 4).
Questo effetto era una prova irrefutabile che le cellule neoplastiche rilasciavano un fattore umorale che alterava i normali processi differenziativi delle cellule nervose simpatiche recettive alla sua azione. Allo stesso tempo il reperto di fibre simpatiche entro il lume delle vene dell'embrione parve indicativo di un'azione neurotropica esercitata dalla sostanza rilasciata dalle cellule neoplastiche nel circolo. Al fine di ottenere una definitiva conferma dell'ipotesi che i tumori producessero e rilasciassero una sostanza umorale responsabile degli effetti descritti, venne innestato il tumore non nel tessuto embrionale, ma sulla membrana corio-allantoidea. Come noto, le sostanze nutritive del tuorlo d'uovo pervengono all'organismo in via di sviluppo tramite il circolo sanguigno, che decorre nella membrana extraembrionale (corio-allantoidea) e, attraverso i vasi convergenti verso l'embrione a livello ombelicale, porta ai tessuti il sangue ricco degli elementi nutritivi. In questa serie di esperimenti il tessuto neoplastico e quelli embrionali condividevano la circolazione, ma non avevano alcun rapporto diretto con l'uno e con l'altro. Questi esperimenti dimostrarono in modo inequivocabile che il tumore trapiantato liberava una sostanza di natura diffusibile che promuoveva la crescita abnorme di fibre nervose. Dopo aver scoperto che i tumori maligni S180 e S37 rilasciavano questo fattore umorale, si trattava di identificare il fattore stesso. Presa la decisione di ricorrere al metodo di coltura dei tessuti in vitro appreso a Torino dal grande istologo Giuseppe Levi, fu necessario trasferire le ricerche a Rio de Janeiro, all'Istituto di Biofisica diretto da Carlo Chagas. Gli esperimenti condotti nel reparto di colture in quella sede diedero risultati di eccezionale interesse.
L'effetto alone
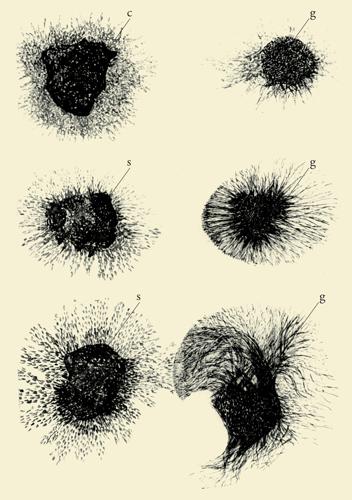
Frammenti dei tumori S37 e S180, previo il loro innesto in embrioni di pollo, venivano trapiantati in mezzi di coltura semisolidi in prossimità di gangli sensitivi e simpatici di embrioni di otto giorni. Dalle cellule di questi gangli, coltivati per ventiquattro ore in vitro, in prossimità, ma non a diretto contatto dei tumori, si diramava un fittissimo alone di fibre nervose a forma di raggiera (fig. 5). Al contrario, gangli coltivati soli o in presenza di altri tessuti normali o neoplastici davano origine in questo breve periodo a un alone di cellule fibroblastiche con pochissime fibre nervose. Inoltre, nei gangli coltivati per un periodo più lungo, due o tre giorni anziché ventiquattro ore, le fibre dal lato prospiciente il frammento di tumore non soltanto erano molto più dense che dal lato opposto, ma era ben evidente il loro orientamento verso il tessuto neoplastico. Gli esperimenti condotti in quei mesi dimostrarono che gli effetti indotti dai due tumori in vitro erano provocati dallo stesso fattore umorale descritto negli embrioni di pollo in via di sviluppo.
Nel 1953, la collaborazione con il biochimico Stanley Cohen consentì la parziale identificazione chimica della frazione tumorale attiva estratta dai tumori in una molecola nucleoproteica. Questa frazione nel 1954 fu denominata Nerve growth promoting factor e in seguito, con la forma tuttora in uso, Nerve growth factor per via delle sue proprietà di stimolare la crescita di due stipiti di cellule nervose embrionali. Rimaneva da accertare se l'attività fosse esplicata dall'intera frazione nucleoproteica o da una delle due componenti: nucleica o proteica. Cohen utilizzò il veleno di serpente che contiene grandi quantità di enzimi che distruggono gli acidi nucleici. Se essi fossero stati una componente essenziale di NGF, la loro degradazione enzimatica avrebbe dovuto annullare l'attività biologica del fattore neoplastico. Se, al contrario, l'attività fosse persistita, avrebbe significato che responsabile dell'effetto sulla crescita doveva essere la componente proteica e non quella nucleica. L'esame delle colture di gangli coltivati in un mezzo contenente sia l'estratto tumorale ad azione NGF sia il veleno di serpente svelò un effetto del tutto imprevedibile. L'alone di fibre nervose che irradiava dai gangli era centuplicato a paragone di quelli coltivati in presenza del solo fattore tumorale. Da questa insperata e imprevedibile nuova sorgente di NGF Cohen isolò parzialmente il fattore NGF, che risultò presente in misura di gran lunga maggiore che nell'estratto dei due tumori di topo.
Iniezioni di NGF, estratto dal veleno di serpenti, in embrioni di pollo tra il quarto e l'ottavo giorno di vita provocavano un effetto identico a quello ottenuto innestando frammenti di S180 e S37 in embrioni di pollo al terzo giorno di incubazione. L'identità degli effetti provocati dal sarcoma e dal veleno di serpente sia in esperimenti in vitro che in vivo dimostrava che il fattore estratto dal veleno e dal tumore era della stessa natura. La scoperta tanto fortunata quanto accidentale che due tumori maligni di topo e il veleno di serpente fossero dotati della proprietà così singolare di stimolare il differenziamento di cellule nervose provenienti da una comune matrice, la cresta neurale, e di promuovere la crescita delle loro fibre, faceva ritenere del tutto improbabile che questa proprietà fosse limitata a tessuti e fluidi così distanti l'uno dall'altro quali quelli citati. Le ghiandole salivari sottomascellari dei topi maschi furono le prime a essere saggiate come sorgenti alternative del fattore NGF. Queste ghiandole, infatti, sono le sole tra quelle dei Mammiferi a esercitare un'azione tossica paragonabile a quella del veleno di serpente e inoltre presentano una somiglianza istologica con le ghiandole che producono il veleno dei serpenti. Al di là di ogni aspettativa, le ghiandole salivari di topo maschio dimostrarono di essere la terza e di gran lunga la più cospicua sorgente di NGF. L'alta quantità di NGF estratto dalle ghiandole salivari murine rese possibile saggiare l'effetto non soltanto nell'embrione di pollo, ma in animali neonati e adulti. Il topo per le sue minute dimensioni e la facilità di allevamento in laboratorio divenne l'oggetto favorito di questi esperimenti.
Attività neurotrofica, immunosimpatectomia e scoperta di un nuovo fattore di crescita
Sin dalla sua scoperta la molecola NGF, estratta e purificata dalla ghiandola salivare di topo maschio adulto, fu a disposizione dei biochimici e dei biologi in quantità dell'ordine di milligrammi, e cioè migliaia di volte maggiore rispetto a quella presente nei tumori S180 e S37. Divenne quindi possibile estendere le ricerche sull'attività neurotrofica di questo fattore non soltanto agli embrioni di pollo, ma anche ai Mammiferi, in prevalenza neonati e adulti. L'iniezione sottocutanea di NGF purificato (dosi da 15 a 20 μg) per un periodo di 10 giorni provocava un aumento dei gangli simpatici delle catene para- e prevertebrali anche più imponente di quello che avveniva negli embrioni di pollo. I gangli raggiungevano un volume pari a 10÷12 volte quello dei gangli di controllo in animali neonati (Roditori). L'ipertrofia e l'iperplasia delle cellule simpatiche in Roditori neonati e in altre specie trattati con NGF causano un'imponente iperinnervazione degli organi e dei tessuti periferici. Sembrava, tuttavia, che gli animali trattati non traessero alcun vantaggio da questo eccezionale aumento del sistema di controllo della vita vegetativa anzi, i risultati conseguiti nella prima serie di esperimenti nel 1958 fecero sospettare un effetto nocivo. Si notò, infatti, una forte riduzione nella crescita degli animali da esperimento, concomitante con curiose aberrazioni somatiche, quali per esempio l'apertura precoce della rima palpebrale e l'eruzione precoce degli incisivi. L'osservazione di questi effetti a livello epidermico condusse all'identificazione di un altro fattore presente nelle preparazioni solo parzialmente purificate di NGF. Il fattore fu denominato a causa delle sue proprietà Epidermal growth factor o EGF.
NGF ed EGF si sarebbero in seguito rivelati costituire la parte emergente di un iceberg formato da un grande numero di fattori di natura proteica (IGF-1, IGF-2, le famiglie delle neurotrofine, TNF ecc.), dotati di azioni specifiche su tutti gli organi e tessuti di un organismo. La prova del ruolo chiave svolto dalla molecola NGF nel corso dello sviluppo fu ottenuta nel 1959, in base a esperimenti finalizzati a saggiare l'azione di anticorpi diretti contro NGF sulle cellule nervose che formano i gangli simpatici. L'antisiero preparato da Cohen con le consuete tecniche immunologiche fu iniettato in topi tra il primo e il terzo giorno di vita. L'ispezione istologica condotta successivamente dimostrò che i gangli simpatici erano ridotti a noduli sclerotici consistenti di cellule gliali e di un numero esiguo di cellule nervose in avanzato stato atrofico. Il fenomeno, reso noto nel 1960 con il termine 'immunosimpatectomia', fu introdotto nella letteratura scientifica per designare l'effetto della distruzione delle cellule nervose simpatiche ottenuta con la somministrazione di un anticorpo specifico contro il NGF ad animali neonati.
La rapidità del fenomeno e l'entità dei processi regressivi, che culminano nella morte delle cellule nervose, furono interpretate all'atto della scoperta di questo fenomeno come prova irrefutabile della proprietà del NGF di esplicare un ruolo trofico (vitale) essenziale per la vita delle cellule stesse. La carenza di questa molecola provocava un processo fatale nelle cellule bersaglio. Molti anni più tardi il fenomeno sarebbe stato interpretato in modo differente, e cioè non come l'azione di un fattore essenziale per la vita delle cellule, ma come effetto dell'inibizione del processo attivo di morte programmata, designato nel 1972 con il termine di 'apoptosi'. La morte apoptotica delle cellule bersaglio del NGF si verifica anche per somministrazione di farmaci, quali la 6-idrossidopammina (6-OHDA) e la vinblastina che, con meccanismi differenti, bloccano la captazione e il trasporto retrogrado del fattore NGF, prodotto dalle cellule bersaglio, dalle fibre nervose al corpo cellulare. In tutti i casi descritti, e designati rispettivamente come immunosimpatectomia e simpatectomia chimica, benché i processi dell'apoptosi si verifichino in modo differente, il comune denominatore è lo stesso, e cioè il suicidio cellulare o morte programmata conseguente alla deprivazione del NGF.
Attività neurotropica
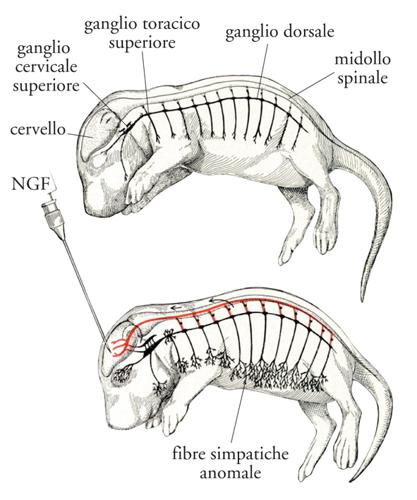
Esperimenti condotti in vivo e in vitro su colture di cellule di gangli sensitivi e simpatici hanno messo in evidenza una funzione non meno importante del NGF: la proprietà di guidare il percorso delle fibre nervose in via di accrescimento lungo il proprio gradiente di concentrazione. Quest'azione direttiva era stata denominata con il termine 'tropismo' o 'chemiotassi', prospettato per la prima volta da Santiago Ramón y Cajal, il quale riteneva che questo processo nella neurogenesi intervenisse nella formazione delle giunzioni tra i nervi e gli organi innervati con cui essi stabiliscono connessioni morfologiche e funzionali. Questa ipotesi era confutata dalla comunità scientifica per l'impossibilità di identificare il presunto fattore neurotropico. Spettava al NGF dare la prima prova dell'esistenza di questa azione in base ai risultati di esperimenti condotti sia in organismi viventi sia in sistemi isolati in vitro. NGF iniettato a mezzo di un microcapillare nel pavimento del quarto ventricolo in Roditori neonati provocava non solo la consueta ipertrofia dei gangli simpatici, ma la formazione di un fascio di fibre nervose ectopiche che si dirigevano verso la fonte intracerebrale di NGF (fig. 8). La presenza di questo fascio di fibre ectopico e aberrante e la sua scomparsa a seguito della sospensione dell'iniezione del NGF fornivano la prima prova della proprietà del NGF di dirigere fibre nervose simpatiche lungo il suo gradiente di diffusione. Una prova anche più rigorosa della proprietà chemiotattica del NGF fu ottenuta da parte di altri sperimentatori. In esperimenti eseguiti in vitro questi dimostrarono che il cono di crescita di fibre nervose prodotto da cellule sensitive embrionali si orienta, come attratto da una calamita, nella direzione di un capillare che rilascia in continuo una soluzione contenente NGF.
Modulazione fenotipica
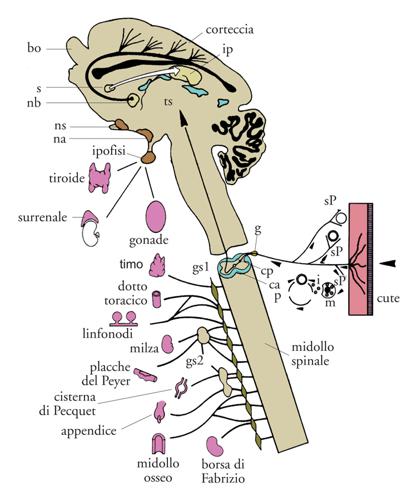
Una terza proprietà del NGF è quella di determinare la scelta nel programma differenziativo di cellule che hanno origine da un comune precursore. Tipico esempio è quello delle cellule nervose simpatiche e delle cellule ghiandolari cromaffiniche che derivano da una comune cellula progenitrice della cresta neurale. Gli esperimenti condotti nel nostro laboratorio, infatti, dimostrarono che l'iniezione di NGF in embrioni di pollo o in feti e neonati di Roditori determina la sequenza di processi differenziativi in direzione della cellula nervosa simpatica, anziché di quella cromaffinica, a partire da un comune precursore delle cellule ghiandolari adrenaliniche e di quelle di natura nervosa, sia simpatiche sia adrenergiche. La modificazione della componente corticale della ghiandola surrenale è provocata dall'ammasso di fibre nervose originate dalle cellule nervose della componente midollare. Sia in embrioni sia in Roditori neonati l'iniezione del NGF salivare provocava la deviazione fenotipica delle cellule della componente midollare, che assumevano tutte le proprietà morfologiche e funzionali delle cellule simpatiche. La stessa alterazione fenotipica era stata notata in piccoli raggruppamenti di tipo ghiandolare scaglionati nell'organismo.
La struttura del NGF e il suo gene
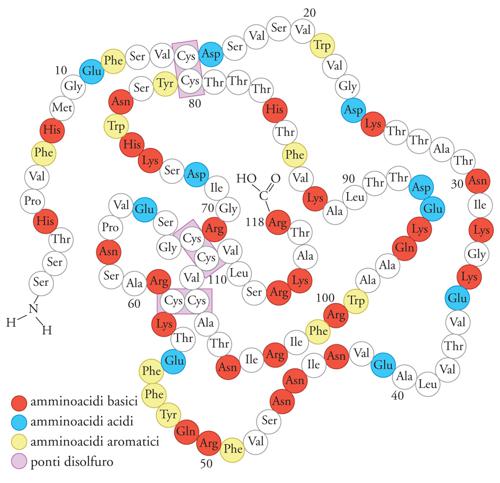
Nel 1971 Ruth Hogue Angeletti e Ralph Bradshaw, avvalendosi della molecola del NGF purificata dalla ghiandola salivare murina, ne elucidarono la struttura (fig.10). La molecola NGF è costituita da due catene polipeptidiche: ciascuna ha peso molecolare di 13.250 kDa ed è formata da 118 amminoacidi. Ciascuna catena o monomero possiede tre ponti disolfuro che formano legami covalenti tra due residui dell'amminoacido cisteina che conferiscono una forte stabilità alla struttura tridimensionale della proteina, proprietà strutturale comune alla maggior parte di ormoni e fattori di crescita. I due monomeri del NGF, uniti l'uno all'altro da legami deboli, formano un dimero di peso molecolare di 26.500 kDa. In base a questo peso molecolare il NGF fu denominato 2.5 S NGF per distinguerlo da una forma più grande (denominata 7S) contenente altre proteine ad attività enzimatica ma irrilevanti per quanto riguarda le proprietà biologiche del NGF. È stato dimostrato che il dimero è dotato dell'attività biologica NGF, mentre il monomero è privo di tale attività. Le tecniche dell'ingegneria genetica permisero negli anni Ottanta di identificare il gene umano che codificava la molecola NGF. Il gene NGF è localizzato nel braccio corto del cromosoma 1 e codifica per la sintesi di una molecola molto più grande di quella di peso molecolare di 26.500 kDa che costituisce il NGF circolante e biologicamente attivo. Il gene NGF infatti fornisce le istruzioni per la sintesi di un precursore NGF o pro-NGF di grandi dimensioni. È stato dimostrato che il gene NGF è altamente conservato in specie differenti, dagli Uccelli all'uomo. Un reperto che convalida l'ipotesi che questo gene svolga un ruolo essenziale nella vita e nello sviluppo delle cellule recettive alla sua azione.
NGF, neurotrofine e recettori
La scoperta del NGF, presto seguita da quella del EGF, ha portato alla luce l'esistenza di un'intera classe di nuove molecole proteiche (i fattori di crescita) e alla dimostrazione che oltre al NGF esistono altri fattori ad azione specifica nell'ambito del sistema nervoso. Questa famiglia di proteine è stata denominata con il termine collettivo di 'neurotrofine' e comprende, oltre al NGF, anche il BDNF (Brain derived growth factor), l'NT3 (Neurotrophin 3) e l'NT4. Considereremo insieme alcune delle loro proprietà, poiché sia il sistema di trasduzione dei loro segnali (recettori) all'interno delle cellule nervose, sia le numerose azioni che ne derivano hanno molte proprietà in comune. In senso lato il NGF e le neurotrofine non svolgono solo un ruolo nel corso dello sviluppo del sistema nervoso, ma essi sono anche coinvolti in numerose malattie neurodegenerative e in disordini di natura psichiatrica.
Come affermato da Moses V. Chao, che contribuì in modo determinante agli studi sul recettore NGF: "La scoperta, per certi versi sorprendente, che le neurotrofine non sono presenti in organismi 'semplici' come Drosophila melanogaster o Caenorhabditis elegans ‒ due modelli animali di invertebrati ampiamente impiegati da genetisti e biologi molecolari ‒ ha rinforzato la nozione che NGF e neurotrofine in genere non sono necessari in via assoluta per lo sviluppo della circuiteria neuronale per sé, ma sono coinvolti in attività di ordine superiore. Per esempio, neurotrofine e recettori influenzano diversi aspetti dell'attività neuronale, come la generazione di nuovi collegamenti sinaptici di lunga durata collegati con i processi di apprendimento e memoria. Alterazioni nei livelli di neurotrofine hanno effetti profondi in una varietà di fenomeni come la morte programmata delle rispettive cellule bersaglio, la mielinizzazione, la rigenerazione nervosa, il dolore, il comportamento aggressivo, l'ansia, la depressione e l'abuso di sostanze stupefacenti".
L'azione del NGF e delle altre neurotrofine dipende da due tipi di sistemi di trasduzione del loro segnale tramite recettori transmembrana: i due recettori sono denominati, rispettivamente, Trk (Transmembrane tirosine kinase receptor) e p75. Topi privati tramite manipolazioni genetiche di una delle neurotrofine muoiono poche settimane dopo la nascita. Topi eterozigoti, i quali esprimono concentrazioni di NGF o di altre neurotrofine ridotti a metà del normale, sono vitali ma mostrano un insieme considerevole e inaspettato di deficit come, nel caso del NGF, una diminuzione dell'innervazione colinergica dell'ippocampo, una diminuita capacità di acquisizione di eventi mnemonici e, nella loro ritenzione per tempi lunghi, una perdita di intere popolazioni neuronali nel sistema nervoso sia centrale sia periferico. Quest'ultimo dato conferma quanto già ampiamente dimostrato con gli esperimenti di immunosimpatectomia eseguiti alcuni decenni prima. Le neurotrofine sono inizialmente sintetizzate, come già accennato per il NGF, sotto forma di precursori o proneurotrofine, che sono in seguito scisse a formare la proteina matura dotata di un peso molecolare di 12 kDa che forma dimeri di peso molecolare doppio. Le neurotrofine dimostrano specificità di legame per recettori differenti, denominati TrkA per il NGF, TrkB per il BDNF e l'NT4 e TrkC per l'NT3. Tali recettori sono dotati di elevata affinità per il loro rispettivo ligando solo se la loro interazione coinvolge un secondo tipo di recettore, denominato p75 e comune a tutte le neurotrofine.
Studi recenti hanno portato alla luce una proprietà peculiare di p75. Questo recettore, infatti, può andare incontro ad attacco proteolitico da parte di proteasi che generano un peptide intracellulare capace, tramite interazioni con altri elementi intracellulari, di modulare l'espressione genica di numerosi geni. Tra questi geni di primaria importanza vi sono quelli che fanno parte del programma di morte per apoptosi. Questo evento svolge un ruolo determinante nel corso dello sviluppo, quando le singole fibre nervose debbono prendere contatto con le cellule bersaglio. Eventi apoptotici potrebbero costituire un mezzo per il refinement dell'innervazione corretta nel corso dello sviluppo, eliminando le cellule che non sono innervate dalle fibre nervose. È stato calcolato che circa il 50% dei neuroni presenti alla nascita viene eliminato tramite questo processo di 'selezione sinaptica'. È interessante notare, inoltre, che gli enzimi devoluti a processare p75 hanno proprietà assimilabili a β- e γ- secretasi, due enzimi che generano un peptide altamente neurotossico il β-amiloide, ritenuto la causa primaria di malattie degenerative come il morbo di Alzheimer, evidenziando ulteriormente il legame stretto fra alterata concentrazione di NGF o del processamento di p75 e insorgenza di questa malattia.
Lo stato attuale degli studi sul NGF, sulle neurotrofine e sui loro recettori dimostra che questo insieme di messaggeri extracellulari e dei loro recettori presiede principalmente a processi di funzionamento neuronale e in taluni casi organismico di tipo pleiotropico, ma può anche, in determinate condizioni funzionali nel corso dello sviluppo e anche nell'adulto, attivare programmi di autoeliminazione delle cellule bersaglio. Questa duplice, opposta proprietà funzionale di NGF e neurotrofine trova una spiegazione funzionale in relazione allo sviluppo dell'organismo. Le proforme delle neurotrofine sarebbero devolute ad attivare preferenzialmente p75 e inoltre a mediare eventi apoptotici nello sviluppo, mentre le forme mature sarebbero preposte ad attivare i recettori di tipo Trk per la sopravvivenza delle popolazioni nervose bersaglio. Gli effetti biologici delle neurotrofine richiedono che i loro segnali siano portati a lunghe distanze, spesso di diversi centimetri.
La dimostrazione che il NGF può essere trasportato all'interno delle fibre nervose sia in direzione anterograda (dal corpo del neurone alle terminazioni sinaptiche) sia in senso retrogrado (dalle sinapsi al corpo dei neuroni) ha pertanto consentito di acquisire una nozione fondamentale per la comprensione del ruolo funzionale di questa molecola; proprietà che studi successivi hanno allargato a tutte le neurotrofine.
Ruolo del NGF nella scacchiera delle neuroscienze
La prima dimostrazione di un'attività pleiotropica del NGF si è avuta nel 1981, in esperimenti consistenti nell'iniezione intracerebrale di anticorpi diretti contro il NGF in singoli feti di ratti esposti, a seguito di taglio cesareo, nella settimana prenatale. Questo intervento intracerebrale non impediva che la gestazione venisse portata a termine. I neonati sottoposti a questo trattamento nei controlli non differivano dagli altri, tuttavia nella prima settimana di vita un numero rilevante moriva a causa di un progressivo decadimento di tutte le funzioni vitali. I sopravvissuti andavano incontro a un notevole arresto della crescita e a uno sviluppo fortemente deficitario del sistema neuro-endocrino, come dimostrato dall'imponente riduzione in volume dell'ipofisi, della tiroide e del surrene.
L'ipotesi che l'inattivazione della molecola NGF da parte degli anticorpi si esercitasse a livello di determinati nuclei cerebrali (ipotalamici) preposti allo sviluppo dell'asse neuroendocrino è stata confermata ed estesa da studi condotti in collaborazione con altri istituti di ricerca. È stato infatti rilevato che in condizioni normali la molecola NGF viene sintetizzata e rilasciata nei nuclei suddetti. Inoltre, studi condotti in parallelo da altri ricercatori dimostravano che popolazioni endocrine, in condizioni fisiologiche normali, sono dotate della proprietà di sintetizzare e rilasciare la molecola NGF. I risultati di questi studi confermavano un'ulteriore estensione dell'attività svolta dalla molecola NGF non ristretta al sistema nervoso periferico e centrale, né ai centri nervosi preposti alle funzioni dell'asse neuroendocrino, ma comune anche alle cellule che fanno parte di questi organi indipendentemente dall'azione esplicata su di loro dall'asse ipotalamo-ipofisi-surrene.
Da fattore di crescita specifico a modulatore dei tre fondamentali sistemi omeodinamici
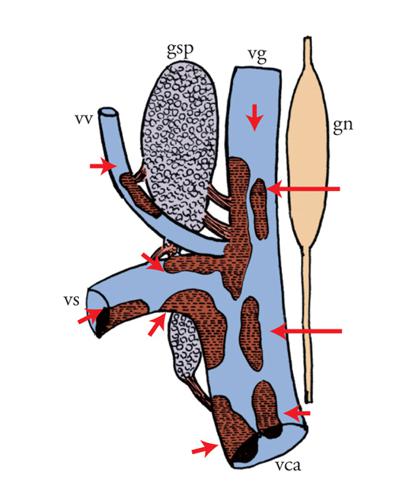
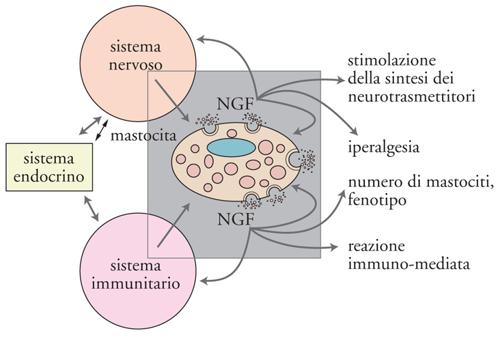
I risultati sopra descritti hanno rivelato altre attività dello spettro d'azione del NGF, che suggeriscono un ruolo della massima importanza, consistente nel coinvolgimento operativo di tipo modulatorio nei sistemi nervoso, endocrino e immunitario (fig. 11). Nel 1975 gli studi condotti nel nostro laboratorio avevano evidenziato che iniezioni di NGF in Roditori neonati provocavano uno straordinario aumento numerico di cellule appartenenti al sistema immunitario, note come mastociti. L'iniziale denominazione di Mastzellen, coniata da Paul Erlich alla fine dell'Ottocento per denominare i mastociti, indica cellule ripiene di granuli a valenza nutritiva e viene attualmente decodificata da alcuni autori in termini di cellula 'master', cioè principale o importante, data la capacità del mastocita di sintetizzare e immagazzinare all'interno dei propri granuli una grande varietà di mediatori che, sotto le più svariate stimolazioni, vengono rilasciati per andare a influenzare un numero straordinario di processi biologici (fig. 12).
L'importanza del reperto ottenuto nel nostro laboratorio non era stata immediatamente percepita da quanti ne erano venuti a conoscenza. Il ruolo assegnato alle cellule che rivelarono questa nuova attività del NGF era quello di difendere l'organismo da agenti nocivi quali vermi e parassiti di diversa natura. Ricerche condotte precedentemente nel nostro e in altri laboratori avevano evidenziato la presenza di mastociti in stretta vicinanza a terminazioni di fibre sensitive nocicettive e nella compagine di organi dei sistemi endocrino e immunitario. La loro associazione con il tessuto nervoso deponeva per un'interdipendenza morfofunzionale, ipotesi confermata da rilevamenti istologici ed elettrofisiologici. È oggi noto che i mastociti sono corredati di recettori a bassa e ad alta affinità per il NGF, che lo sintetizzano e che possono anche attivare meccanismi della sua captazione o del suo rilascio insieme ad altre sostanze ad attività biologica come l'istamina, la prostaglandina, il TNF (Tumor necrosis factor), che sono alla base dei fenomeni infiammatori di differente eziopatogenesi. In base all'attività esplicata dal NGF sulle componenti dei sistemi citati si svelava una proprietà di questa molecola che non rientrava in quella che gli era stata attribuita nei tre decenni successivi alla sua scoperta, designata con il termine di 'neurotrofina', ma si inseriva nella categoria più ampia di sostanze umorali, note con il termine generico di 'citochine', sintetizzate e rilasciate dalle cellule appartenenti ai sistemi della rete omeodinamica.
Aumento del NGF circolante in stato di stress e di ansia
Un aspetto del tutto nuovo dell'attività biologica del NGF è venuto alla ribalta nel 1986, quando è stata ripresa in esame una delle osservazioni più interessanti emerse dallo studio del NGF, e cioè che la sintesi di grandi quantità di questo polipeptide nei tubuli convoluti delle ghiandole salivari sottomascellari di topo maschio adulto è sotto controllo del testosterone. In condizioni naturali, infatti, i topi maschi mostrano un comportamento aggressivo nei riguardi dei maschi della loro stessa colonia, ingaggiando combattimenti intraspecifici che finiscono con gravi morsicature e talvolta con l'uccisione di uno dei due contendenti. Un comportamento aggressivo del tutto simile si osserva in topi maschi allevati in laboratorio, mantenuti in isolamento sociale per un periodo di 446 settimane e posti quindi con un altro maschio nella stessa gabbia. L'osservazione di elevati livelli di NGF nel sangue di entrambi i contendenti, immediatamente dopo ogni episodio di aggressione, suggeriva che questo rilascio di NGF dalle ghiandole salivari potesse avere un ben definito ruolo fisiologico, attivato e/o potenziato da specifiche condizioni di stress. Indagini precedenti, dalle quali risultava che il NGF esogeno induce ipertrofia del surrene e stimola l'attività funzionale sia della sezione midollare sia di quella corticale di questa ghiandola, suggerivano che quest'organo rappresentasse il bersaglio più probabile del polipeptide. Questa ipotesi ricevette una conferma dalla dimostrazione dell'esistenza di una correlazione fra prolungati episodi di combattimenti e un'ipertrofia sia della componente corticale sia di quella midollare del surrene.
Un'ulteriore significativa osservazione riguardo al ruolo del NGF nell'interazione antagonista nel topo si riferisce al fatto che il suo livello nel sangue circolante raggiunge costantemente un valore più elevato nel partner subordinato che in quello dominante. In altri termini, il massiccio rilascio di NGF dalle ghiandole salivari nel sangue circolante è espressione non solo dell'attivazione di un comportamento aggressivo, ma anche dell'ansia, che è ovviamente più grave nel topo subordinato. Questi risultati hanno posto il problema se anche nella specie umana lo stato ansioso provochi un aumentato livello di NGF. A questo scopo sono stati analizzati i livelli ematici in giovani reclute che per la prima volta si lanciavano con il paracadute. I risultati hanno messo in evidenza un aumento di NGF nel sangue sia nel momento in cui veniva notificato alle reclute che si sarebbero dovute lanciare (ventiquattro ore prima del lancio) sia immediatamente dopo il lancio stesso (stress fisico ed emotivo).
Prima del lancio il livello ematico del NGF era aumentato dell'84%; venti minuti dopo l'atterraggio il livello NGF era ulteriormente salito al 107% in un gruppo di ventisei individui. Due dati di notevole interesse emergono da questi reperti: lo stress di natura emotiva e/o fisico-emotiva provoca un aumentato rilascio in circolo di NGF da sorgenti attualmente non identificate, senza tuttavia alterare il livello di altre interleuchine intimamente associate al NGF, quali l'interleuchina IL-1 e il TNF; l'immediato aumento del NGF circolante e quello simultaneo dei recettori NGF sui linfociti nel sangue dei soggetti sottoposti al duplice stress emotivo e fisico prospettano l'ipotesi che la molecola NGF non soltanto agisca in modo sinergico sui tre sistemi (nervoso, endocrino e immunitario), ma svolga un ruolo di attivazione dei sistemi preposti a mettere in atto meccanismi di difesa.
Ruolo del NGF nelle neuropatie periferiche e nelle lesioni corneali
Nell'ambito del network neurocutaneo, il NGF non solo presiede allo sviluppo e al differenziamento dei neuroni sensoriali e simpatici, ma è anche in grado di modulare nell'adulto l'arborizzazione terminale delle fibre amieliniche, nonché la sensibilità termica e traumatica dei nocicettori afferenti, che nell'epidermide formano un complesso network tridimensionale. I suoi effetti cutanei sono stati recentemente messi in evidenza da studi effettuati su topi transgenici che sovraesprimono NGF nella pelle. In questi animali si è dimostrato un aumento del 100% del numero di neuroni sensoriali presenti nei gangli delle radici dorsali, nonché un forte incremento di fibre contenenti CGRP (Calcitonin gene related peptide) nel corno dorsale del midollo spinale. A livello cutaneo, inoltre, l'aumentata espressione locale di NGF sbilancia il rapporto tra fibre simpatiche colinergiche (innervazione ghiandole sudoripare), noradrenergiche (innervazione vascolare) e sensoriali (plesso nervoso dermo-epidermico). Tale squilibrio determina un netto prevalere delle terminazioni sensoriali e una localizzazione aberrante degli assoni simpatici che si concentrano a canestro intorno ai neuroni sensoriali, analogamente a quanto accade in condizioni di dolore cronico.
Elemento cutaneo per eccellenza, il cheratinocita è la cellula maggiormente presente nella pelle, dove la sua organizzazione stratificata e il suo specifico turnover determinano le proprietà di rinnovamento e cheratinizzazione epidermica, nonché le fondamentali caratteristiche della barriera cutanea. È stato dimostrato che mediante modalità paracrine e autocrine il NGF regola la sopravvivenza, la proliferazione e il differenziamento dei cheratinociti. Anche i fibroblasti, particolarmente abbondanti a livello dermico, rappresentano fonti cutanee di NGF; sotto stimolo citochinico (TNF e IL-1 in particolare), essi producono e liberano quantità discrete di questo fattore, che andrà a esercitare i propri effetti a livello cheratinocitario, ovvero su quelle cellule dermoimmunitarie da molti definite 'spazzini tessutali' ‒ i macrofagi ‒ nei quali il NGF è in grado di stimolare la fagocitosi, l'espressione recettoriale, la produzione e il rilascio di citochine, come l'IL-1. È infine importante considerare anche quelle cellule immunitarie che, pur non essendo resistenti a livello cutaneo, vengono attivate in numerose condizioni fisiologiche o patologiche e particolarmente in quelle di tipo flogistico di varia natura.
Monociti, linfociti T, linfociti B, neutrofili, eosinofili, basofili rappresentano le braccia mobili del sistema immunitario, capaci di migrare sotto stimolo chemiotattico dal letto circolatorio al tessuto cutaneo che ne richieda l'intervento. Tutte queste cellule rispondono in maniera attiva al NGF, ne esprimono il recettore e alcune sono in grado di sintetizzare e rilasciare questa neurochina. In base alle sue proprietà il NGF è coinvolto in meccanismi dermo-epidermici di difesa. Tra questi, uno dei principali sistemi difensivi è rappresentato dall'iperalgesia, cioè dalla percezione dolorifica di stimolazioni cutanee normalmente non risultanti in sensazioni dolorose. Si tratta di un meccanismo messo in atto dalla natura per proteggere tessuti lesi o in via di riparazione. Un esempio classico è l'iperalgesia della cute ferita e/o in via di cicatrizzazione, dove la sensibilità dolorifica a stimoli meccanici e termici è notevolmente amplificata. I meccanismi neurobiologici dell'iperalgesia vedono il NGF giocare un ruolo cruciale. È del 1960 la prima evidenza che l'infiammazione provoca aumenti dei livelli locali di NGF, ma ci sono voluti più di tre decenni per definire che tale aumento è responsabile dell'iperalgesia dei tessuti infiammati. Il NGF è in grado di aumentare la sintesi di neuropeptidi, come CGRP e SP (Substance P), con conseguente abbassamento della soglia nocicettiva.
Il NGF si delinea come iniziatore di due fasi cardinali della fisiopatologia cutanea: l'iperalgica e l'infiammatoria. Queste stesse fasi sono assolutamente cruciali in uno dei più noti fenomeni di riparazione cutanea: la cicatrizzazione delle ferite. Indipendentemente dall'origine cellulare, gli aumenti di NGF in sede di ferita possono stimolare la cicatrizzazione anche attraverso modalità diverse da quelle nervose. La sua capacità di influenzare le cellule cutanee rende, infatti, il NGF un ottimo candidato al ruolo di orchestratore delle fasi cicatriziali, prima fra tutte quella infiammatoria. L'induzione e il potenziamento della degranulazione mastocitaria costituiscono senza dubbio il meccanismo fondamentale tramite il quale il NGF attiva il processo infiammatorio. L'azione proliferativa sui cheratinociti rende conto del ruolo del NGF nella riepitelizzazione, evento chiave della cicatrizzazione cutanea, attraverso il quale i cheratinociti migrano dai margini della ferita e proliferano fino a ricoprire completamente la soluzione di continuo. Esami di laboratorio condotti su topi sia normali che diabetici hanno confermato che l'applicazione topica di NGF su ferite a tutto spessore accelera la velocità di cicatrizzazione. In particolare, il trattamento ha aumentato il grado di riepitelizzazione, lo spessore del tessuto di granulazione e la densità della matrice extracellulare.
Alterazioni di natura neurologica sono provocate da compressione da trauma di nervi sensoriali o da neuropatie, quali per esempio il diabete, le complicazioni insorgenti durante la chemioterapia antitumorale (per es., da cisplatino o da taxolo), in seguito a terapie antivirali, come complicazioni dell'alcolismo o del fumo, o nel decorso dell'AIDS. La sofferenza dei nervi periferici rappresenta nei diabetici una complicazione relativamente frequente (10% ca.), che non appare sempre correlabile alla gravità e alla durata della malattia. La causa non è ancora stata chiarita, ma sono stati chiamati in causa fattori quali appunto un danno alle fibre nervose che innervano i vasi capillari degli stessi nervi. La perdita graduale della sensibilità cutanea provoca nel paziente ferite e lesioni, talvolta anche gravi, alle estremità, aumentando così il danno iniziale. Il peggioramento progressivo di ulcere e piaghe può portare talvolta alla necessità di ricorrere all'amputazione. La terapia delle neuropatie diabetiche si è indirizzata finora al controllo del diabete mediante mantenimento del tasso di glucosio del sangue a livelli accettabili: l'iniezione sottocutanea di NGF in microgrammi determina un significativo miglioramento della sensibilità al caldo e al freddo nel 75% dei pazienti e ha un effetto positivo anche a carico di altri tipi di sensibilità.
Un'altra imprevedibile attività del NGF è stata recentemente evidenziata dall'azione svolta da questa molecola in ulcere corneali di qualunque natura, che provocano lesioni causando la perdita della vista per la mancata riparazione dei tessuti lesi con terapie farmacologiche. La scoperta di recettori ad alta affinità (TrkA) nelle cellule epiteliali della cornea, che è stata realizzata grazie a studi in vitro condotti in precedenza, ha suggerito la sperimentazione in vivo in modelli animali (conigli) ai quali era stata inflitta una lesione dell'epitelio corneale. I risultati conseguiti hanno dimostrato che l'aggiunta del NGF al mezzo di coltura portava al ripristino delle cellule lese e hanno incoraggiato lo studio dell'attività del NGF sulla cornea di pazienti affetti da lesioni di differente natura. Di queste, la più frequente è quella provocata dall'infezione del tessuto corneale da Herpes simplex, seguita, dal punto di vista numerico, dalle lesioni provocate da infezioni batteriche, virali o conseguenti ad alterazioni traumatiche (lenti a contatto, oggetti ecc.). Il NGF è stato somministrato per via topica (collirio) e nel 100% dei pazienti trattati (a tutt'oggi una cinquantina) si è verificata una completa riparazione del tessuto corneale, che si evidenzia poche settimane dopo i primi trattamenti e perdura nei periodi successivi. Ulcere corneali possono anche essere provocate da mancata innervazione per lesioni del nervo trigemino. Si tratta in questo caso di ulcere corneali di origine neurogena, come dimostrato dall'alterazione dell'epitelio corneale a seguito della sezione della componente oculare del nervo trigemino in modelli animali. Lesioni di questo nervo riducono il metabolismo e la vitalità del tessuto corneale, probabilmente a causa della mancata funzione di un non identificato fattore trofico.
L'effetto riparativo, studiato a livello istologico nel modello animale, ha dimostrato che questo è dovuto sia al fatto che le cellule corneali possiedono i recettori ad alta affinità e sono quindi in grado di captare il fattore NGF, sia al fatto che il NGF determina la reinnervazione del tessuto leso. Le patologie alle quali si è accennato, pur essendo eterogenee tra di loro sia come eziologia sia come localizzazione, potendo interessare livelli distrettuali diversi, sono unificate nel segno dei processi infiammatori che ne sostengono il danno patologico. I risultati conseguiti in questi ultimi decenni hanno portato a enormi passi avanti nel cammino verso la comprensione dei meccanismi fisiopatologici preposti alla salute dell'uomo. A questi si è pervenuti integrando il metodo riduzionistico con quello olistico, che si avvale dello studio delle singole parti per ottenere una visione globale. Non si contempla un mosaico concentrando l'attenzione sulle singole tessere: infatti, l'analisi più minuziosa delle parti non può fornire l'idea dell'insieme. Da questa filosofia di base nasce un nuovo approccio sperimentale, volto a collegare, integrare, associare, così come sono collegati, i sistemi che operano per mantenere l'equilibrio dell'organismo. Le fasi di sviluppo delineate per sommi capi non devono essere considerate 'un inventario di fatti', indipendenti l'uno dall'altro, ma una sequenza logica di fenomeni collegati tra loro da un filo conduttore. Questo approccio multi- e interdisciplinare, che ha caratterizzato l'ultimo decennio delle ricerche sul NGF, trova attualmente una realizzazione sistematica nel campo delle ricerche biologiche, tanto da aver dato luogo a una ricerca olistica denominata 'biologia sistemica'.
Gli studi che avrebbero portato alla scoperta del NGF si ponevano al loro inizio l'obiettivo di indagare quale ruolo giocassero i tessuti e gli organi periferici sui centri nervosi del midollo spinale da loro innervati. Era un problema che si apriva a quei tempi, nella vasta panoramica delle neuroscienze, come periferico nel doppio senso di questo termine: nel primo, perché le cellule attive avevano una locazione e una funzione periferica, nel secondo, perché queste cellule sono preposte a funzioni di scarsa rilevanza a paragone di quelle del sistema nervoso centrale, implicate nelle funzioni cognitive (elaborazione di pensiero, memoria, creatività e, nel complesso, delle funzioni psicoemotive). La scoperta del NGF ha portato alla luce l'esistenza di un'intera classe di nuove sostanze collettivamente denominate 'fattori di crescita' e appartenenti alla più vasta categoria dei messaggeri extracellulari, che comprendono ormoni e vitamine. In questo contesto il ruolo svolto dal NGF non è limitato al sistema nervoso centrale e periferico (azione che ha inizialmente ispirato la sua denominazione), ma si estende a numerose funzioni nel contesto di network operativi a livello organismico.
bibliografia
Aloe 1981: Aloe, Luigi e altri, Somatic and behavioural postnatal effects of fetal injections of nerve growth factor antibodies in the rat, "Nature", 291, 1981, pp. 413-415.
Aloe, Levi-Montalcini 1977: Aloe, Luigi - Levi-Montalcini, Rita, Mast cells increase in tissues of neonatal rats injected with the nerve growth factor, "Brain research", 133, 1977, pp. 358-366.
Angeletti, Levi-Montalcini 1970: Angeletti, Pietro U. - Levi-Montalcini, Rita, Sympathetic nerve cell destruction in newborn mammals, "Proceedings of the National Academy of Sciences USA", 65, 1970, pp. 114-121.
Calissano, Levi-Montalcini 1979: Calissano, Pietro - Levi-Montalcini, Rita, Is NGF an enzyme?, "Nature", 280, 1979, p. 359.
Levi-Montalcini 1952: Levi-Montalcini, Rita, Effects of mouse tumor transplantation on the nervous system, in: The chick embryo in biological research, edited by David A. Karnofsky and Mary E. Rawles, New York, New York Academy of Sciences, 1952, pp. 330-343.
Levi-Montalcini 1953: Levi-Montalcini, Rita - Meyer, Herta - Hamburger, Victor, In vitro experiments on the effects of mouse sarcomas 180 and 37 on the spinal and sympathetic ganglia of the chick embryo, "Cancer research", 14, 1953, pp. 49-57.
Levi-Montalcini 1956: Levi-Montalcini, Rita - Cohen, Stanley, In vitro experiments on the effects of a nerve growth-stimulating agent isolated from snake venom, "Proceedings of the National Academy of Sciences USA", 42, 1956, pp. 695-699.
Levi-Montalcini 1960: Levi-Montalcini, Rita - Cohen, Stanley, Effects of the extract of the mouse submaxillary salivary glands on the sympathetic system of mammals, "Annals of the New York Academy of Sciences", 85, 1960, pp. 324-341.
Levi-Montalcini 1964: Levi-Montalcini, Rita, Growth control of nerve cells by a protein factor and its antiserum, "Science", 143, 1964, pp. 105-110.
Levi-Montalcini 1965: Levi-Montalcini, Rita, The nerve growth factor: its mode of action on sensory and sympathetic nerve cells, "Harvey lectures", 60, 1965, pp. 217-259.
Levi-Montalcini 1975: Levi-Montalcini, Rita, NGF: an uncharted route, in: The neurosciences: paths of discovery, edited by Frederic G. Worden, Judith P. Swazey, George Adelman, Cambridge (Mass.)-London, MIT Press, 1975, pp. 245-265.
Levi-Montalcini 1990: Levi-Montalcini, Rita - Aloe, Luigi - Alleva, Enrico, A role for nerve growth factor in nervous, endocrine and immune systems, "Progress in neuroendocrinimmunology", 3, 1990, pp. 1-10.
Levi-Montalcini 1996: Levi-Montalcini, Rita, Nerve growth factor: from neurotrophine to neurokine, "Trends in neurosciences", 19, 1996, pp. 514-520.
Levi-Montalcini, Calissano 1979: Levi-Montalcini, Rita - Calissano, Pietro, The nerve growth factor, "Scientific American", 240, 1979, pp. 67-77.
Levi-Montalcini, Hamburger 1951: Levi-Montalcini, Rita - Hamburger, Victor, Selective growth-stimulating effects of mouse sarcoma on the sensory and sympathetic system of the chick embryo, "Journal of experimental zoology", 116, 1951, pp. 321-36.
Levi-Montalcini, Levi 1942: Levi-Montalcini, Rita - Levi, Giuseppe, Les conséquences de la destruction d'un territoire d'innervation périphérique sur le développement des centres nerveux correspondants dans l'embryon de poulet, "Archives de biologie", 1942, pp. 537-545.
Menesini Chen 1977: Menesini Chen, Maria G. e altri, NGF prevents vinblastine destructive effects on sympathetic ganglia in newborn mice, "Proceedings of the National Academy of Sciences USA", 74, 1977, p. 5559.